RNA干扰沉默survivin基因对Eca-109细胞增殖与凋亡的影响*
2015-02-23牛朝霞李宁宁李宜培彭蕤蕤秦紫芳
牛朝霞,李宁宁,陈 洁,李宜培,彭蕤蕤,秦紫芳
河南医学高等专科学校病理生理学教研室 郑州 451191
△女,1979年10月生,硕士,讲师,研究方向:恶性肿瘤功能基因组学,E-mail:nzx99@163.com
RNA干扰沉默survivin基因对Eca-109细胞增殖与凋亡的影响*
牛朝霞△,李宁宁,陈洁,李宜培,彭蕤蕤,秦紫芳
河南医学高等专科学校病理生理学教研室 郑州 451191
△女,1979年10月生,硕士,讲师,研究方向:恶性肿瘤功能基因组学,E-mail:nzx99@163.com
关键词RNA干扰;survivin;细胞增殖;细胞凋亡;Eca-109细胞
摘要目的:通过RNA干扰抑制食管癌细胞Eca-109 survivin基因的表达,观察survivin基因沉默对Eca-109细胞增殖与凋亡的影响。方法:构建靶向survivin基因的siRNA表达载体并借助脂质体稳定转染Eca-109细胞(干扰组),同时设转染无关干扰质粒的Eca-109细胞为阴性对照,未转染细胞为空白对照。采用Western blot检测survivin基因沉默效果,MTT、平板克隆形成实验及流式细胞术分析干扰前后Eca-109细胞增殖与凋亡的变化。结果:与两对照组相比,干扰组Survivin蛋白的表达降低(F=79.397,P<0.001);MTT检测结果显示,干扰组抑制细胞增殖效果优于两对照组,而平板克隆形成实验显示干扰组克隆形成率低于两对照组(F=162.026,P<0.001);流式细胞术分析显示,干扰组凋亡指数高于两对照组(F=2 284.205,P<0.001)。结论:RNA干扰可特异性沉默survivin基因的表达,抑制Eca-109细胞的增殖,诱导细胞凋亡。
AbstractAim: To inhibit endogenous survivin expression by RNA interference technology and investigate the effects on proliferation and apoptosis of Eca-109 cells.Methods: An siRNA expressing vector targeting survivin was constructed and transfected into Eca-109 cells via LipofectamineTM2000 to establish stable transfection cell line.The Eca-109 cells transfected non-sense sequence and those untransfected were used as control.The expression level of Survivin protein was detected by Western blot to observe the interference effect; cell proliferation of Eca-109 cells was determined by MTT assay and colony formation assay; cell apoptosis of Eca-109 cells was measured by flow cytometry analysis.Results: Compared with the 2 control groups, the expression level of Survivin protein in the interference group was significantly reduced(F=79.397,P<0.001); cell proliferation in the interference group was distinctly inhibited(F=162.026,P<0.001); the apoptosis index in the interference group was significantly increased(F=2 284.205,P<0.001). Conclusion: Knockdown of endogenous survivin via specific RNA interference can effectively inhibit cell proliferation and significantly induce cell apoptosis of Eca-109 cells.
Survivin作为一种在肿瘤发生发展中起重要作用的凋亡抑制蛋白,广泛表达于人类多种肿瘤,具有调节细胞周期、抑制细胞凋亡等功能[1-4]。食管癌是我国常见的消化系统恶性肿瘤之一,其发生发展是多因素参与、多阶段进展的过程。目前针对食管癌中晚期患者临床上依然采取手术根治辅以放化疗,但术后5 a生存率较低,预后较差[5]。由此,人们尝试将分子靶向基因治疗应用于临床实践中。目前已证实[6],survivin基因高表达于食管癌组织中,而在正常食管组织中基本不表达。因此,survivin有望成为食管癌患者基因治疗的潜在新靶点。该研究选择survivin基因作为干扰靶点,利用RNA干扰技术检测沉默该基因对食管癌Eca-109细胞增殖与凋亡的影响,为食管癌的诊断与治疗提供理论基础。
1材料与方法
1.1材料Eca-109细胞由上海细胞生物研究所建株。RPMI 1640培养基、胰蛋白酶、胎牛血清(FBS)购自Gibco公司,MTT、DMSO及LipofectamineTM2000转染试剂盒购自Invitrogen 公司,引物DNA、T4 DNA连接酶、BamHⅠ/HindⅢ限制性内切酶、Taq DNA聚合酶均购自TaKaRa公司,蛋白质相对分子质量标准购自Promega公司,BCA蛋白浓度检测试剂盒、ECL化学发光检测试剂盒均购自美国Pierce公司,质粒抽提试剂盒购自上海华舜生物工程公司,Survivin和β-actin抗体购自Santa Cruz公司,干扰质粒pRNAT-U6.1/Neo、阴性对照干扰质粒siRNA购自Gencript公司,Annexin V-FITC凋亡检测试剂盒购自美国BD公司。
1.2细胞培养Eca-109细胞培养于含体积分数10%FBS的RPMI 1640培养基中,置于37 ℃、体积分数5%CO2的培养箱内培养,待细胞融合度达70%~80%时,以2.5 g/L胰蛋白酶进行消化与传代。
1.3靶向survivin的寡核苷酸序列的设计利用生物信息学软件,针对survivin基因487~505 bp的靶位点设计两条互补的DNA链,其序列分别为:5’-GATCCAGAATTTGAGGAAACTGCGCTGTGAAGCCAC AGATGGGCGCAGTTTCCTCAAATTCTTTTTTA-3’和3’-GTCTTAAACTCCTTTGACGCGACACTTCGGTGTCT ACCCGCGTCAAAGGAGTTTAAGAAAAAATTCGA-5’;两条DNA链的结构均为:BamHⅠ+正义序列+茎环序列+反义序列+转录终止子+HindⅢ,在细胞内形成所谓的“发夹结构”。
1.4siRNA表达质粒的构建载体pRNAT-U6.1/Neo经BamH Ⅰ和Hind Ⅲ双酶切后与由TaKaRa公司合成的靶向survivin的寡核苷酸退火后连接,并进行转化,随后挑取克隆,进行质粒抽提、菌落PCR鉴定及测序,得到针对survivin的siRNA表达质粒pRNAT-siRNA-survivin,同法构建阴性对照质粒:pRNAT-siRNA-control,最后两质粒分别大量抽提后备用。
1.5细胞转染待Eca-109细胞达对数生长期时,将干扰质粒pRNAT-siRNA-survivin和阴性对照质粒pRNAT-siRNA-control按照LipofectamineTM2000转染试剂盒说明分别转染Eca-109细胞,48 h后用G418筛选2~3周,可见典型的抗性克隆,扩大培养,建成稳定转染细胞系,分别为干扰组和阴性对照组,同时设未转染的Eca-109细胞为空白对照。
1.6survivin基因沉默效果的Western blot检测
取对数生长期的上述3组细胞,按蛋白抽提要求进行处置,分别取50 μg总蛋白进行不连续SDS-PAGE电泳;电泳结束后,用半干石墨电转移2 h,将分离出的蛋白转移至硝酸纤维素膜上,用PBS配制的50 g/L脱脂奶粉溶液在室温摇床上封闭1~2 h,加入鼠抗人单克隆一抗(按1300稀释),4 ℃过夜孵育,洗膜,再加入相应二抗,室温孵育1.5 h,再洗膜,经ECL化学发光检测和拍照,以β-actin作为内对照,结果进行灰度扫描,以Survivin/β-actin灰度值的比值作为Survivin蛋白的表达水平。重复实验3次。
1.7细胞增殖的MTT检测分别将对数生长期的上述3组细胞按0.5×104个/孔接种于96孔板,每孔200 μL,每组接种8孔;培养24 h,待细胞融合达80%左右时每孔加MTT 20 μL,继续孵育4 h,弃培养液,每孔再加入150 μL DMSO,振荡10 min;然后在酶标仪上测定490 nm处的OD值进行比色;如此每隔24 h重复上述步骤,共检测6 d。最后以OD值为纵坐标,间隔时间为横坐标,绘制生长曲线。
1.8细胞增殖的平板克隆形成检测取对数生长期的上述3组细胞,分别行常规胰蛋白酶消化,并吹打成单细胞悬液,按200个/孔接种于6孔板,每种细胞接种3孔,置37 ℃、体积分数5%CO2培养箱中静置培养2~3周,直至肉眼可见细胞克隆,终止培养;弃去上清液,用PBS小心浸洗2次;加甲醇5 mL固定15 min,弃去固定液;加Giemsa液室温染色10~30 min,用清水缓慢洗去染色液,空气中干燥,将平皿倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆数,并计算克隆形成率(克隆形成率=克隆数/接种细胞数×100%)。重复实验3次。
1.9细胞凋亡率的流式细胞术检测取对数生长期的上述3组细胞各3瓶,按照Annexin V-FITC凋亡检测试剂盒说明分别检测各组细胞凋亡,计算凋亡指数(apoptosis index,AI),AI=凋亡细胞数/观察细胞数×100%。重复实验3次。
1.10统计学处理采用SPSS 17.0处理数据,应用单因素方差分析比较3组细胞Survivin蛋白的表达水平、克隆形成率及AI的差异,两两比较采用LSD-t检验,检验水准α=0.05。
2结果
2.13组细胞Survivin蛋白的表达见图1。空白对照组、阴性对照组及干扰组Survivin蛋白的表达水平分别为(46.20±2.62)、(44.17±3.15)和(18.75±3.12),3组间相比,F=79.397,P<0.001;与两对照组相比,干扰组Survivin蛋白的表达水平降低(P<0.05)。

图1 3组细胞中Survivin蛋白的表达
2.23组细胞增殖的变化见图2、3,表1。由图2可知,从第4天开始,干扰组Eca-109细胞的生长活力比阴性对照组和空白对照组降低,而后两者的细胞生长活力无明显变化。由图3、表1可知,与两对照组相比,干扰组的细胞克隆生长速度较慢,形成的克隆较小,克隆数较少;干扰组克隆形成率较阴性对照组及空白对照组低。
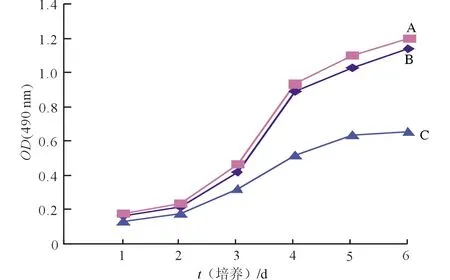
图2 3组细胞的生长曲线

图3 3组细胞的平板克隆形成情况
2.33组细胞AI的比较见表1。由表1可知,与两对照组相比,干扰组细胞的AI升高。

表1 3组细胞平均克隆形成率和AI的比较 %
*:与两对照组相比,P<0.05。
3讨论
survivin作为一种抗凋亡基因,与肿瘤的生长、肿瘤血管生成、肿瘤细胞对放化疗药物的敏感性以及肿瘤的诊断、治疗、预后及复发等密切相关;抑制survivin基因的表达能够在一定程度上诱导肿瘤细胞凋亡,进而提高细胞对放化疗药物的敏感性[7]。同时survivin基因具有高度保守性,几乎高表达于人类所有的肿瘤组织中,与恶性肿瘤的关系尤为密切,而在分化成熟的成年组织及癌旁正常组织中均无表达[8]。针对该特点,研究者[9-11]开展了大量有关食管癌与survivin的研究,结果均表明survivin在食管癌组织中高表达,可能作为癌基因参与食管癌的发生、发展与形成,而在正常食管组织中基本不表达。因此,survivin有望成为食管癌基因治疗的特异性靶点,进而更好地实现包括手术、放化疗及基因治疗等在内的理想的综合治疗措施。
RNA干扰技术作为近年来研究哺乳动物细胞功能基因组学的一个新工具,具有高度序列专一性,可以特异地产生由双链DNA介导的转录后特定基因沉默的效果[12];依据该原理,针对siRNA的RNA干扰技术已经广泛应用于生物学、医学及药物研究等众多研究领域中,同时也为临床众多恶性肿瘤尤其是中晚期肿瘤患者开辟了基因治疗的新路径。
该研究中作者利用RNA干扰和重组体技术构建靶向survivin基因的siRNA表达质粒pRNAT-siRNA-survivin,并稳定转染Eca-109细胞,结果显示干扰后Survivin蛋白的表达水平较转染阴性对照质粒的阴性对照组及未转染的空白对照组下调,亦证实了构建的pRNAT-siRNA-survivin表达质粒具有高度特异性;MTT和平板克隆形成实验结果表明干扰后Eca-109细胞较两对照组的细胞活力明显下降,生长缓慢,其克隆形成较小,数量较少,证实沉默survivin基因的表达能够抑制Eca-109细胞的增殖;流式细胞术检测结果同时证实了抑制survivin基因的表达也可诱导细胞凋亡。
总之,该研究主要通过体外实验证实了沉默survivin基因可抑制Eca-109细胞的增殖,诱导细胞凋亡;为了更好地指导临床实践,作者拟进一步探索沉默survivin基因对食管癌细胞重要信号转导通路的影响,以及通过动物实验更直观地观察靶向survivin的siRNA与食管癌发生发展的关系。
参考文献
[1]彭冬先,何援利,丘立文.慢病毒介导shRNA沉默survivin基因对鸡胚绒毛尿囊膜子宫内膜异位症模型的影响[J].南方医科大学学报,2012,32(7):995
[2]Kang YM,Ding MJ,Tian GY,et al.Overexpression of Numb suppresses tumor cell growth and enhances sensitivity to cisplatin in epithelioid malignant pleural mesothelioma[J].Oncol Rep,2013,30(1):313
[3]吕喜英,李青山,张秀琴.凋亡抑制蛋白survivin和血管内皮生长因子在非小细胞肺癌中的表达及与其预后的关系[J].中国实用内科杂志,2007,27(22):1782
[4]鲁德玕,姬晓青.非小细胞肺癌中survivin及bcl-xl基因蛋白的表达及其相关性研究[J].中国实用内科杂志,2006,26(19):1523
[5]王立东,崔纪丽.食管癌转化医学研究的理解和思考[J].郑州大学学报:医学版,2012,47(5):593
[6]李春光,李志刚,陈和忠,等.食管癌诊断治疗的重要靶标Survivin[J].诊断学理论与实践,2011,10(6):571
[7]刘杰文,路喜安,郝利芬,等.凋亡抑制蛋白Survivin和缺氧诱导因子-1α在前列腺癌中的表达及其相关性[J].肿瘤研究与临床,2014,26(1):36
[8]Yang L,Zhu HJ,Liu DX,et al.Aspirin suppresses growth of human gastric carcinoma cell by inhibiting survivin expression[J].J Biomed Res,2011,25(4):246
[9]王涛,侯桂琴.食管鳞状细胞癌组织中Survivin与Caspase-3蛋白的表达[J].郑州大学学报:医学版,2010,45(3):362
[10]Bongiovanni L,D'Andrea A,Romanucci M,et al.Epithelial-to-mesenchymal transition:immunohistochemical investigation of related molecules in canine cutaneous epithelial tumours[J].Vet Dermatol,2013,24(1):195
[11]Bin Hafeez B,Zhong WX,Fischer JW,et al.Plumbagin, a medicinal plant(Plumbago zeylanica)-derived 1,4-naphthoquinone, inhibits growth and metastasis of human prostate cancer PC-3M-luciferase cells in an orthotopic xenograft mouse model[J].Mol Oncol,2013,7(3):428
[12]Zhang Y,Fang L,Zhang Q,et al.An oncolytic adenovirus regulated by a radiation-inducible promoter selectively mediates hSulf-1 gene expression and mutually reinforces antitumor activity of I131-metuximab in hepatocellular carcinoma[J].Mol Oncol,2013,7(3):346
*国家留学基金委河南省地方合作项目201308410293;河南省教育厅科学技术研究重点项目(基础研究计划)13A320436;河南省科技厅基础与前沿科技研究项目132300410464;河南省卫生厅及郑州大学第一附属医院共建项目;河南省卫生科技创新型人才工程中青年科技创新人才项目4099;河南省医学科技攻关计划项目2011020038
Effects of silencing survivin gene by RNA interference on proliferation and apoptosis of Eca-109 cells
NIUZhaoxia,LINingning,CHENJie,LIYipei,PENGRuirui,QINZifang
DepartmentofPathophysiology,HenanMedicalCollege,Zhengzhou451191
Key wordsRNA interference;survivin;cell proliferation;cell apoptosis;Eca-109 cell
doi:10.13705/j.issn.1671-6825.2015.06.003
中图分类号R735.1
