地塞米松调节T细胞免疫应答保护小鼠急性炎性肝损伤的作用
2015-02-22刘焕荣,陆芸,张正国等
地塞米松调节T细胞免疫应答保护小鼠急性炎性肝损伤的作用
刘焕荣1,2*陆芸2张正国2王健2王昱2刘光伟2薛峰1#
上海交通大学医学院附属仁济医院肝脏外科1(200127)复旦大学基础医学院免疫学系2

*Email: liuhr1103@163.com
背景:在小鼠急性炎性肝损伤中,地塞米松(Dex)可通过抑制天然免疫细胞功能抑制肝损伤进展,然而T细胞是否参与此保护作用尚少见报道。目的:探讨Dex在急性炎性肝损伤中对T细胞免疫应答的调节效应。方法:6只雄性C57BL/6J小鼠随机分为实验组和模型组,在以脂多糖诱导急性炎性肝损伤模型前1 h,两组分别腹腔注射Dex 5 mg/kg和等体积PBS。建模12 h后处死小鼠,行临床评分并检测肝功能;分离脾脏单个核细胞,分析T细胞活化情况以及各T细胞亚群的细胞因子表达、分泌和转录因子表达。结果:实验组小鼠临床评分和血清转氨酶水平均明显低于模型组,脾脏CD44+CD62L-T细胞(活化或记忆性T细胞)比率显著降低,Th1型细胞因子IFN-γ表达、分泌减少,Th2型细胞因子IL-4表达、分泌增加,调节性T细胞(Treg细胞)比率、Th2/Th1、Treg/Th1比值增加;同时,Th1细胞特异性转录因子表达下调,Th2、Treg细胞特异性转录因子表达上调。结论:Dex通过抑制T细胞活化并调节T细胞亚群分化(抑制Th1细胞分化,促进Th2、Treg细胞分化),在急性炎性肝损伤中起一定保护作用。
关键词肝损伤;地塞米松;淋巴细胞活化;细胞分化;Th1-Th2平衡
随着生活质量的不断提升,免疫性肝损伤正逐渐成为一个重要的人类健康问题,细菌感染引起的肝损伤是其中不容忽视的一类,该类肝损伤主要由革兰阴性杆菌的胞壁成分脂多糖(LPS)引起[1],天然免疫在其发生、发展中起极其重要的作用,如肝脏局部巨噬细胞Kupffer细胞释放白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)等促炎细胞因子,可加速肝损伤进展,以药物抑制Kupffer细胞活化后,炎症因子释放减少,肝损伤明显减轻[2-3]。此外,间质干细胞可通过募集调节性树突细胞抑制炎性肝损伤发生[4]。研究[1]发现在小鼠急性炎性肝损伤中,糖皮质激素地塞米松(dexamethasone, Dex)可通过抑制天然免疫细胞功能抑制肝损伤进展,然而T细胞是否参与此保护作用尚少见报道。本研究以LPS诱导小鼠急性炎性肝损伤模型,探讨Dex在急性炎性肝损伤中对T细胞免疫应答的调节效应,为临床用药提供理论依据。
材料与方法
一、实验动物、主要试剂和仪器
雄性C57BL/6J小鼠6只,6~8周龄,购自复旦大学实验动物中心。小鼠于清洁环境下昼夜规律喂养,自由进食、饮水。
地塞米松磷酸钠注射液(1 mL∶5 mg,国药准字H37021969,辰欣药业股份有限公司),LPS、佛波酯(phorbol-12-myristate-13-acetate, PMA)、离子霉素(ionomycin, ION)(Sigma-Aldrich Co.),小鼠TNF-α ELISA试剂盒(eBioscience, Inc.),抗小鼠CD4-PE-Cy5、CD8-APC、CD44-FITC、CD62L-PE、干扰素-γ(IFN-γ)-FITC、IL-4-PE、CD25-APC和Foxp3-PE抗体、红细胞裂解液、BD GolgiStopTM蛋白转运抑制剂(BD Biosciences),RNeasy Mini Kit(QIAGEN),SuperScript®Ⅲ逆转录酶(Thermo Fisher Scientific Inc.),FastStart Universal SYBR Green Master (Rox) (Roche Diagnostics), real-time PCR引物设计、合成[生工生物工程(上海)股份有限公司]。
德灵全自动生化分析仪,Applied Biosystems 7900HT Fast Real-Time PCR仪,Beckman Coulter CyAnTMADP流式细胞仪。
二、实验方法
1. 模型建立和给药方案:采用随机数字表法将小鼠分为2组:①实验组:腹腔注射Dex 5 mg/kg,1 h后腹腔注射LPS 10 mg/kg;②模型组:腹腔注射与实验组等体积的PBS,1 h后腹腔注射 LPS 10 mg/kg。12 h后处死小鼠,取脾脏进行后续实验。
2. 分离脾脏单个核细胞:取一干净平皿,放入过滤网,将小鼠脾脏置于过滤网下,加入适量PBS,以研磨棒轻轻研磨,收集平皿内细胞悬液,经200目过滤网过滤至15 mL EP管中,1 500×g离心5 min,弃上清液,加入2 mL红细胞裂解液,2 min后1 500×g离心5 min,弃上清液,PBS重悬,即获得脾脏单个核细胞。
3. 观察指标:①临床评分:建模12 h后观察小鼠状态,从立毛、抱团、腹泻、对周围环境失去兴趣、丧失自动扶正反射五个方面进行评定,出现1项计1分。②肝功能检测:建模12 h后眼球取血制备血清,以全自动生化分析仪测定血清转氨酶水平。③血清TNF-α检测:按小鼠TNF-α ELISA试剂盒说明书进行操作。④T细胞活化检测:取1×106个单个核细胞,加入20 μL相应抗体(抗小鼠CD4-PE-Cy5、CD8-APC、CD44-FITC、CD62L-PE抗体)稀释液,4 ℃避光孵育30 min,加入500 μL PBS洗涤,1 500×g离心5 min,弃上清液,PBS重悬,上流式细胞仪检测。⑤T细胞细胞因子分泌检测:将单个核细胞以1×106/孔加入24孔板,同时加入T细胞刺激物PMA 100 ng/mL、ION 1 μg/mL和高尔基体阻断剂GolgiStopTM1.5 μL/mL,于细胞培养箱中培养5 h,收集细胞,进行相应的表面染色、打孔、固定、胞内染色等,PBS重悬,上流式细胞仪检测。⑥T细胞亚群细胞因子、转录因子表达分析:建模12 h后取脾脏 制备单细胞悬液,以流式细胞方法分选得到CD4+T细胞,RNeasy Mini Kit提取细胞总RNA,SuperScript®Ⅲ逆转录酶逆转录合成cDNA,以之为模板,分别以IFN-γ、IL-4、T-bet、GATA3、Foxp3引物行real-time PCR,以相应软件分析样本Ct值,2-ΔΔCt法计算目的基因mRNA相对表达量。
三、统计学分析
应用Graphpad Prism 5.0统计软件,计量资料以±s表示,两组间比较采用两独立样本t检验,P<0.05为差异有统计学意义。
结果
一、Dex对急性炎性肝损伤的保护作用
建模12 h后,实验组小鼠临床评分明显低于模型组(P=0.003,图1A),血清ALT(P=0.004)、AST(P=0.022)水平以及天然免疫细胞分泌的主要细胞因子TNF-α(P=0.001)水平亦显著降低(图1B、1C),提示Dex可明显缓解急性炎性肝损伤,并抑制天然免疫细胞功能。
二、Dex对急性炎性肝损伤时T细胞活化的影响
实验组小鼠脾脏中CD4+T细胞、CD8+T细胞比率和绝对数(P=0.021和P=0.040)均明显低于模型组(图2),CD44+CD62L-T细胞(活化或记忆性T细胞)比率亦显著降低(CD4:P=0.001; CD8:P=0.001)(图3),提示Dex在急性炎性肝损伤时可抑制T细胞活化。
三、Dex对急性炎性肝损伤时T细胞亚群分化的影响
与模型组相比,实验组小鼠脾脏中T细胞Th1型细胞因子IFN-γ分泌减少(CD4:P=0.005, CD8:P=0.024)(图4A),Th2型细胞因子IL-4分泌增加(P=0.014)(图4B),CD4+CD25+Foxp3+调节性T细胞(Treg细胞)比率增加(P=0.004)(图4B);各T细胞亚群绝对数分析显示,实验组Th2/Th1比值(P=0.000)、Treg/Th1比值(P=0.000)显著增高(图4C)。将每组分选得到的CD4+T细胞混和,行转录水平分析,real-time PCR结果显示,实验组T细胞IFN-γ mRNA表达下调,IL-4 mRNA表达上调,Th1细胞特异性转录因子T-bet mRNA表达下调,Th2细胞特异性转录因子GATA3 mRNA、Treg细胞特异性转录因子Foxp3 mRNA表达上调(图5),与流式细胞分析结果相符,提示Dex在保护急性炎性肝损伤时,可抑制Th1细胞分化,促进Th2、Treg细胞分化。

*与模型组比较,P<0.05

*与模型组比较,P<0.05

*与模型组比较,P<0.05

*与模型组比较,P<0.05
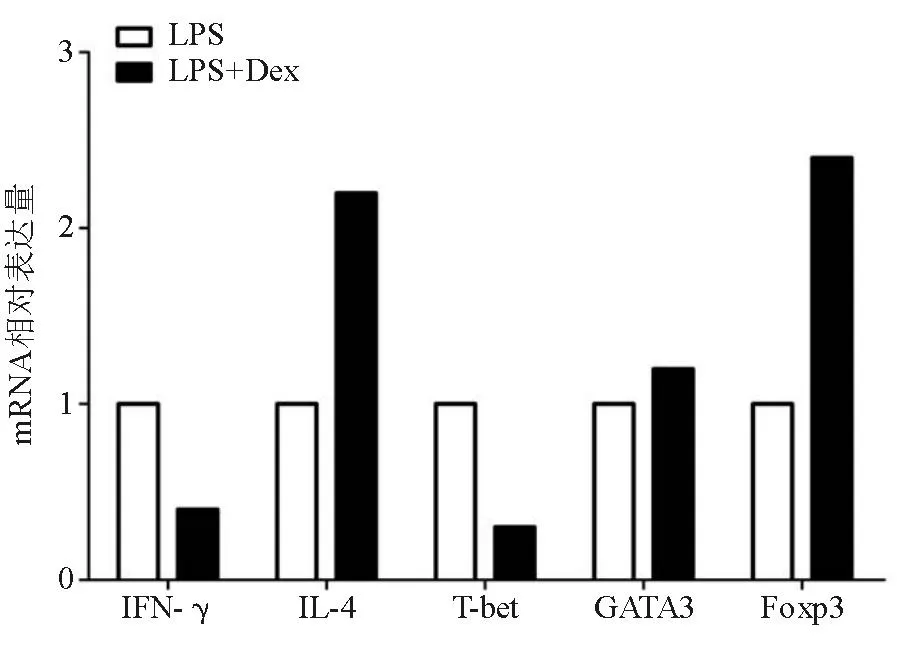
图5急性炎性肝损伤时Dex改变T细胞细胞因子和不同亚群特异性转录因子表达
讨论
肝损伤性疾病是威胁人类健康的重要疾病,主要包括酒精性肝损伤、药物性肝损伤、免疫性肝损伤等,其中免疫性肝损伤包括自身免疫性肝炎、病毒性肝炎、细菌感染性肝损伤等,相关调查显示其发病率逐年增高,成为肝脏病学领域的研究热点之一。了解免疫性肝损伤的致病因素、发病机制以及免疫细胞的变化,对于制订正确的治疗策略具有重要意义。
糖皮质激素因其强大的抗炎、抗病毒作用而成为治疗免疫相关疾病的常用药物之一[5]。既往文献报道,Dex可抑制树突细胞分化、成熟,进而抑制相关炎症发生[6];或通过诱导巨噬细胞向M2型(替代性活化的巨噬细胞,抗原呈递能力较弱,可通过分泌抑制性细胞因子下调免疫应答)分化,达到抑制炎症的目的[7]。此外,Dex还可诱导髓源抑制性细胞产生,该类细胞具有强烈的免疫抑制功能,从而抑制炎性疾病进展[8]。
众所周知,自身免疫性肝炎主要是由适应性免疫所介导,Dex通过调节T细胞免疫应答,成为临床上治疗该类疾病的常用药物[9-10]。然而本研究发现,在由天然免疫介导的急性炎性肝损伤中,Dex亦可通过影响T细胞发挥保护作用。T细胞活化是介导细胞免疫、促进相关炎症发生的前提条件。本研究发现,在急性炎性肝损伤早期,Dex可明显抑制T细胞活化,并影响T细胞亚群分化。流式细胞分析和real-time PCR检测结果显示,Dex可明显抑制T细胞的IFN-γ表达和分泌,即抑制Th1细胞分化,同时促进IL-4表达和分泌,即诱导Th2细胞分化。Treg细胞是一类具有免疫抑制功能的T细胞,可通过分泌转化生长因子-β(TGF-β)、IL-10等细胞因子抑制免疫反应[11]。本研究对各T细胞亚群数量的分析显示,予Dex处理的实验组小鼠Th2/Th1、Treg/Th1比值显著增高,提示Dex有助于增加保护性T细胞亚群(Th2和Treg),同时限制致病性T细胞亚群(Th1)。不同T细胞亚群分化的特异性转录因子是决定T细胞分化方向的关键因素,T-bet、GATA3、Foxp3分别是Th1、Th2、Treg细胞分化的特异性转录因子[12-13]。本研究在转录水平证实,急性炎性肝损伤时,Dex可下调T-bet表达,同时上调GATA3、Foxp3表达,与流式细胞T细胞亚群数量分析结果相符。
综上所述,Dex可缓解急性炎性肝损伤,抑制T细胞活化并调节T细胞亚群分化(抑制Th1细胞分化,促进Th2、Treg细胞分化),可能有利于其发挥保护作用。
参考文献
1 Wei SD, Li JZ, Liu ZJ, et al. Dexamethasone attenuates lipopolysaccharide-induced liver injury by downregulating glucocorticoid-induced tumor necrosis factor receptor ligand in Kupffer cells[J]. Hepatol Res, 2011, 41 (10): 989-999.
2 Yao HW, Li J, Chen JQ, et al. Leflunomide attenuates hepatocyte injury by inhibiting Kupffer cells[J]. World J Gastroenterol, 2004, 10 (11): 1608-1611.
3 Rutella S, Danese S, Leone G. Tolerogenic dendritic cells: cytokine modulation comes of age[J]. Blood, 2006, 108 (5): 1435-1440.
4 Zhang Y, Cai W, Huang Q, et al. Mesenchymal stem cells alleviate bacteria-induced liver injury in mice by inducing regulatory dendritic cells[J]. Hepatology, 2014, 59 (2): 671-682.
5 Lewis-Tuffin LJ, Cidlowski JA. The physiology of human glucocorticoid receptor beta (hGRbeta) and glucocorticoid resistance[J]. Ann N Y Acad Sci, 2006, 1069: 1-9.
6 Hackstein H, Thomson AW. Dendritic cells: emerging pharmacological targets of immunosuppressive drugs[J]. Nat Rev Immunol, 2004, 4 (1): 24-34.
7 Zheng G, Zhong S, Geng Y, et al. Dexamethasone promotes toleranceinvivoby enriching CD11clo CD40lo tolerogenic macrophages[J]. Eur J Immunol, 2013, 43(1): 219-227.
8 Varga G, Ehrchen J, Tsianakas A, et al. Glucocorticoids induce an activated, anti-inflammatory monocyte subset in mice that resembles myeloid-derived suppressor cells[J]. J Leukoc Biol, 2008, 84 (3): 644-650.
9 Kwon HJ, Won YS, Park O, et al. Opposing effects of prednisolone treatment on T/NKT cell- and hepatotoxin-mediated hepatitis in mice[J]. Hepatology, 2014, 59 (3): 1094-1106.
10Maruoka R, Aoki N, Kido M, et al. Splenectomy prolongs the effects of corticosteroids in mouse models of autoimmune hepatitis[J]. Gastroenterology, 2013, 145 (1): 209-220.e9.
11Zhang Y, Wu BX, Metelli A, et al. GP96 is a GARP chaperone and controls regulatory T cell functions[J]. J Clin Invest, 2015, 125 (2): 859-869.
12Liberman AC, Druker J, Refojo D, et al. Glucocorticoids inhibit GATA-3 phosphorylation and activity in T cells[J]. FASEB J, 2009, 23 (5): 1558-1571.
13Karagiannidis C, Akdis M, Holopainen P, et al. Glucocorticoids upregulate FOXP3 expression and regulatory T cells in asthma[J]. J Allergy Clin Immunol, 2004, 114 (6): 1425-1433.
(2015-01-29收稿;2015-03-01修回)
Dexamethasone Protects Mice against Acute Inflammatory Liver Injury by Regulating T Cell Immune ResponseLIUHuanrong1,2,LUYun2,ZHANGZhengguo2,WANGJian2,WANGYu2,LIUGuangwei2,XUEFeng1.1DepartmentofLiverSurgery,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity,Shanghai(200127);2DepartmentofImmunology,SchoolofBasicMedicalSciences,FudanUniversity,Shanghai
Correspondence to: XUE Feng, Email: fengxue6879@163.com
Background: Dexamethasone can protect mice against the acute inflammatory liver injury by inhibiting innate immune cell function. However, the roles of T cell in this protective effect remain unknown. Aims: To investigate the regulatory effect of dexamethasone on T cell immune response in acute inflammatory liver injury. Methods: Six male C57BL/6J mice were randomly divided into 2 groups. One hour before induction of acute inflammatory liver injury by lipopolysaccharide, dexamethasone 5 mg/kg and PBS were given intraperitoneally in experimental group and model group, respectively. All the mice were sacrificed 12 hours after model construction. The clinical score and liver function parameters were assessed; splenic mononuclear cells were isolated for measurements of T cell activation, as well as cytokine expression, secretion, and transcriptional factor expression for different T-cell subsets. Results: Clinical score and serum levels of transaminase were significantly lower in experimental group when compared with the model group. Meanwhile, percentage of CD44+CD62L-T cells (i.e. activated or memory T cells) from spleen was significantly decreased in experimental group. Among splenic T cell population, expression and secretion of IFN-γ, a Th1-type cytokine, was decreased; expression and secretion of IL-4, a Th2-type cytokine, percentage of regulatory T cells (Treg cells), and ratios of Th2/Th1 and Treg/Th1 were increased; transcriptional factor specific for Th1 cells was down-regulated, and those for Th2 and Treg cells were up-regulated. Conclusions: Dexamethasone inhibits T cell activation and directs the reciprocal T cell lineage differentiation (repressing Th1 cell differentiation, promoting Th2 and Treg cell differentiation), which may contribute to the protection against acute inflammatory liver injury.
Key wordsLiver Injury;Dexamethasone;Lymphocyte Activation;Cell Differentiation;Th1-Th2 Balance
通信作者#本文,Email: fengxue6879@163.com
DOI:10.3969/j.issn.1008-7125.2015.06.002
