紫杉烷类PEG-PDLLA纳米粒的制备及其体外评价
2015-02-22张英新张晓敏蒋成君周一峰
魏 炜,张英新,张晓敏,蒋成君,周一峰
(1.浙江科技学院 生物与化学工程学院,杭州 310023;2.浙江省农产品化学与生物加工技术重点实验室,
杭州 310023;3.杭州普施康生物科技有限公司,杭州 310021)
浙江科技学院学报,第27卷第1期,2015年2月
Journal of Zhejiang University of Science and Technology
Vol.27 No.1, Feb. 2015

紫杉烷类PEG-PDLLA纳米粒的制备及其体外评价
魏炜1,2,张英新3,张晓敏3,蒋成君1,2,周一峰1,2
(1.浙江科技学院 生物与化学工程学院,杭州 310023;2.浙江省农产品化学与生物加工技术重点实验室,
杭州 310023;3.杭州普施康生物科技有限公司,杭州 310021)
摘要:采用乳化-溶剂蒸发法制备紫杉烷类PEG-PDLLA纳米粒,马尔文激光粒度仪测其粒径及Zeta电位;HPLC法测定纳米粒包封率和载药量;研究载药纳米粒在PBS中的释放动力学;初步评价载药纳米粒在MGC803、HeLa细胞中的摄取及细胞毒性。结果表明,通过包载形成的纳米粒的粒径为(13±1)nm,分布较集中。载体与药物的质量比在20∶1时,紫杉醇的均一性最好,卡巴他赛的包封率最高,达到88.77%。载药纳米粒具有较好的缓释作用,MGC803、HeLa细胞的存活率降低,与临床用注射剂效果相近。紫杉烷类PEG-PDLLA纳米粒的性质、释放、细胞抑瘤率都较好,可为开发紫杉烷类新型静脉注射制剂提供实验依据。
关键词:紫杉烷类;PEG-PDLLA;纳米粒;体外评价;细胞毒性
紫杉烷类药物主要包括紫杉醇(PTX)、多烯紫杉醇(DTX)、卡巴他赛(CBT),是目前临床上最有效的抗肿瘤药物之一。临床研究已经证实了PTX在治疗多种实体肿瘤,包括乳腺癌、晚期卵巢癌、肺癌、脑部和颈部肿瘤及急性白血病等方面,都有显著的作用。DTX的作用机制与紫杉醇相似,但抗肿瘤活性更好,对乳腺癌、非小细胞肺癌等癌症具有明显的治疗效果[1-2]。CBT是为DTX耐药的转移性去势抗性前列腺癌(CRPC)的一个重要的新的治疗选择,临床上与泼尼松联用治疗既往用含DTX治疗方案的激素难治性转移性前列腺癌患者[3]。
紫杉烷类药物其水溶性较低(约1~10 μg/mL),因此,临床上所使用的Taxol®和Taxotere®均需要分别使用表面活性剂聚氧乙烯蓖麻油(Cremophor EL)和聚山梨醇80(吐温80),以及助溶剂乙醇来达到溶解药物的目的。聚氧乙烯蓖麻油已被证明会导致严重的过敏反应、神经毒性、肾毒性和低血压等。此外,聚氧乙烯蓖麻油还可在血液中形成微小颗粒包裹紫杉醇分子,影响药物分子向组织间扩散,降低抗肿瘤效果。吐温80的使用易引发病人严重的过敏反应,在化疗前,病人往往需预先服用或注射抗过敏药物(皮质类激素和H2受体拮抗剂),在输液过程中,还需连接微孔过滤器以防止药物在稀释过程中产生的结晶微粒进入病人血液循环系统,这些均给临床应用带来极大的风险和不便[4-5]。
为消除现有紫杉烷类药物剂型的不良反应,增加紫杉烷药物的溶解度、稳定性,降低毒性,国内外研究者展开了大量紫杉烷类药物新剂型的研究,包括环糊精包合物、胶束、脂质体、白蛋白等。这些新剂型虽然从一定程度上改善了现有制剂的不足,但均存在各自的缺陷,如:环糊精本身存在极高的肾毒性,脂质体制剂包封率低、不稳定、易泄露等,白蛋白紫杉醇制备工艺复杂等[6]。这些难以克服的缺陷限制了上述新型制剂的产业化发展和试剂临床应用。因此,有必要开发新的紫杉烷类药物递送系统。在新剂型中,纳米载药体系就是其中的热点之一[7-8]。纳米材料由于其粒径小、比表面积大,载药量高,表面容易修饰,可以达到控制药物的释放,实现长循环,增加稳定性,提高药物的靶向性的目的,从而也在一定程度上降低了药物的耐药性。
聚乙二醇-聚乳酸嵌段共聚物(PEG-PDLLA)胶束由于其理想的增溶特性和EPR行为吸引了广泛关注。韩国Samyang公司的Genexol PM是以PEG-PDLLA为材料的紫杉醇聚合物,体外和动物体内的生物相溶性较好,未见明显毒性,紫杉醇同位素体内分布实验表明,胶束进入体内后迅速解离,释放药物,聚合物在体内可以在15 h内降解。Genexol PM于2002年由FDA(food and drug administration,食品药品监督管理局)批准进入临床研究。Genexol PM胶束制剂已在韩国上市,也在美国进入了临床Ⅱ期。与其他的纳米制剂相比,聚合物胶束具有强大的增溶能力,如紫杉醇,其固有溶解度约为1 μg/mL,制成脂质体可增溶到3.4 mg/mL;而聚合物胶束的增溶能力则可达到10 mg/mL以上,药载比可达到25%以上;此外,制得的聚合物胶束可过滤除菌,进一步制成冻干粉制剂,在储存时间和易用性方面将得到提升[9-10]。
本研究以PEG-PDLLA为载体,采用乳化-溶剂蒸发法,成功制备了分别载PTX、DTX和CBT的纳米粒。本研究对3种紫杉烷类药物进行了评价,通过改变载体与药物的比例,以期得到更好的剂型。通过激光粒度仪、液相色谱等仪器表征纳米粒的形貌和释药性能,通过模拟体外释放表征纳米粒的包封率与载药量[11-12],通过体外细胞毒性数据、细胞摄取数据表征纳米粒的体外抗肿瘤性能[13-14]。希望通过一系列的实验得到比较好的制备工艺和比较全面的体内外数据,为纳米粒抗肿瘤制剂的开发提供理论和实验支持。
1材料与仪器
PEG2000-PDLLA2000(济南岱罡生物工程有限公司),PTX、DTX、CBT(纯度≥98%,上海龙翔生物医药开发有限公司),噻唑蓝(MTT)(美国Gibco公司),乙腈(HPLC级,Honeywell),其他试剂均为分析纯;人胃癌细胞(MGC-803)和HeLa(人宫颈癌细胞)购自中国科学院细胞库。
Zetasizer Nano ZS ZEN3600(英国Malvern公司),高效液相色谱LC-20A(岛津科技有限公司),恒温震荡箱HZ-9610KB(太仓市华利达实验设备有限公司),酶联免疫检测仪MK3(美国Thermo公司),CO2孵箱2406-2(上海巴玖实业有限公司),透析袋(截留相对分子质量14 000,上海源聚生物有限公司)。
2方法
2.1 载药纳米粒的制备
称取紫杉醇2 mg,按1∶10比例称取PEG2000-PDLLA200020 mg,溶解于2 mL乙腈中,超声处理15 min,在60 ℃、20 r/min的条件下减压蒸馏,蒸干溶剂后容器底部形成透明胶状基质。向基质中加入10 mL蒸馏水,在60 ℃条件下使基质溶化,得透明胶束溶液[15]。
用1∶20、1∶40的比例,即分别加入PEG2000-PDLLA200040、80 mg,其他条件不变,制备纳米粒。再以多烯紫杉醇和卡巴他赛为原料,根据上述方法分别进行操作,共9组。
2.2 载药纳米粒的表征
用Zetasizer Nano分析仪测定纳米粒的平均粒径(DLS)、粒径分布(用多分散系数表示,PDI)及其Zeta电位(Zeta potential)。
2.3 载药量及包封率的测定
将制备的纳米粒先在2 000 r/min转速下离心10 min,取上清液在10 000 r/min、4 ℃条件下离心30 min,将离心得到的沉淀加高纯水重新溶解,然后取适量的复溶待测液加同等体积的乙腈超声5 min破乳,将制备的初始纳米粒和破乳得到的待测液分别取20 μL注入液相色谱柱,测量紫杉醇的质量浓度。进而根据以下公式求得包封率(encapsulation efficiency, EE)和载药量(drug loading capacity, DL) :


取一定量的载药纳米粒溶液,加入适量乙腈溶解材料,采用HPLC法测定纳米粒中紫杉烷类药物的含量。色谱条件如下:紫杉醇,用Hypersil ODS2 C18色谱柱(250 mm×4.6 mm,5 μm),流动相为乙腈∶水(50∶50,体积比),流速为1.0 mL/min,检测波长为227 nm,柱温30 ℃,进样量20 μL。多西他赛,检测波长为230 nm,其他与紫杉醇条件相同。卡巴他赛,流动相为乙腈∶水(60∶40,体积比);检测波长为230 nm,其他与紫杉醇条件相同。
2.4 载药纳米粒的体外释放性质研究
采用动态透析法考察载药纳米粒的体外释放特征,以吐温-80(0.2%)-PBS(pH7.4)为释放介质,精密吸取用蒸馏水溶解的纳米粒分散液0.5 mL(含药约1.0 mg),将其稀释到10 mL;取1 mL作为零点,其余的放到透析袋中(截留相对分子质量14 000);取50 mL PBS加入吐温-80至质量分数为0.2%;将透析袋放在50 mL PBS的烧杯中,用保鲜膜封好,再用锡箔纸包好;在100 r/min、(37±0.5)℃条件下的摇床中进行体外释放试验,分别于1、2、4、8、12、24 h取1 mL透析介质,同时向透析介质中补充1 mL的空白释放介质。向取出的1 mL待测液中加入1 mL乙腈,涡旋混合均匀;按照HPLC法检测各取样点中紫杉烷类药物的含量,计算不同时间的累积释放百分率(release rate),制作释放曲线。
式中:ct—各取样点中紫杉醇的含量;V0—释放介质体积;V—取样体积;M0—释放介质中的紫杉醇总量。
2.5 体外抗肿瘤活性
将人宫颈癌HeLa细胞株以含10%胎牛血清的RPM-I1640(含青霉素100 U/mL和链霉素100 mg/L),在37 ℃、5%的CO2孵育箱中培养,取对数生长期的细胞进行试验。
将胃癌MGC803细胞以含有56 ℃、30 min灭活后的10%胎牛血清和12 U/mL庆大霉素的RPMI-1640培养液中培养,在37 ℃、5%的CO2孵育箱中培养,取对数生长期的细胞进行试验。
用胰酶消化对数生长期细胞,稀释细胞至(5~10)×104个/mL。以0.1 mL/孔铺96孔板,于细胞培养箱中培养过夜。吸出培养液,将载药纳米粒用培养液调整到不同质量浓度,分别加入到96孔板中(设空白组和对照组),每个质量浓度设4个复孔。48 h后每孔中加入30 μL的MTT溶液继续孵育4 h。待MTT与细胞反应形成紫色结晶后,轻轻吸去上清,加入150 μL的DMSO溶液,低速振荡反应10 min,溶出胞内紫色结晶。在酶标仪上于570 nm波长处测定吸光度(A)值,按照下式计算细胞存活率(cell viability):
3结果与讨论
3.1 原药差异及载体用量对纳米粒的影响
考察PEG-PDLLA的用量对纳米粒的影响,结果如表1所示。
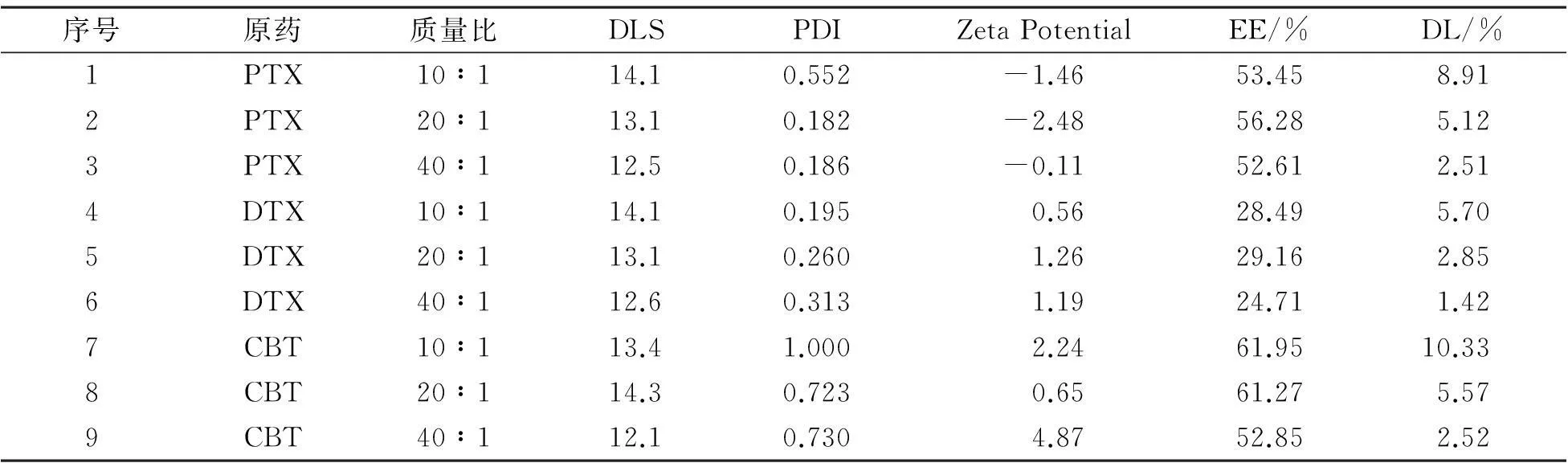
表1 原药差异及载体用量对载药纳米粒的影响
紫杉醇纳米粒的DLS为(13±1)nm。在10∶1的条件下,PDI较大,分散均一性不够好,而在20∶1与40∶1的条件下,PDI为0.18左右,粒径大小与分布基本均匀。包封率在50%左右,且2号最高,达到56.28%。2号配方最好。
多西他赛纳米粒的DLS为(13±1)nm。随着载体用量增加,DLS减小,PDI更大,说明分散性反而不好。包封率在20%~30%之间,且5号最高。但PEG-PDLLA对多西他赛的包封效果不理想。5号配方最好。
卡巴他赛纳米粒的DLS为(13±1)nm。其中,在10∶1的条件下,PDI很大,分散均一性不好,而在20∶1与40∶1的条件下,PDI为0.73左右,稳定性稍有改善,但还是偏大。包封率在50%以上,且7号和8号均达到了60%以上。8号配方最好。
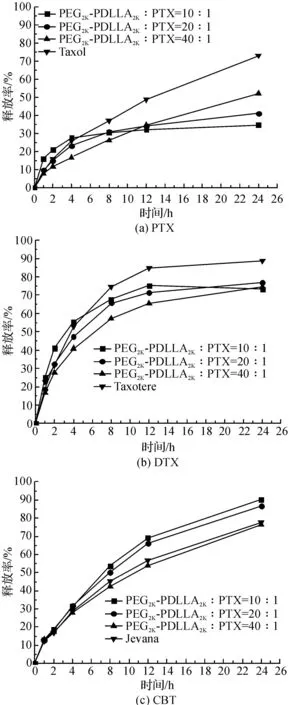
图1 载药PEG-PDLLA纳米粒释放曲线Fig.1 Release curves of drug loadedPEG-PDLLA nanoparticle
综上,PEG-PDLLA用量是影响紫杉烷类纳米粒的质量和制备工艺的重要因素。一般情况下,PEG-PDLLA用量增大,药物收率和包封率亦增大,趋于平衡;载药量随PEG-PDLLA用量的增大而降低。综合考虑,PEG-PDLLA的用量不宜过大或过小。分析可知,3种最优配方都是在载体与药物用量比为20∶1时,因此,20∶1为最佳载体用量。紫杉烷类药物的种类在纳米粒的形成过程中起重要作用,紫杉烷类的内在性质直接影响到纳米粒的形成。3种药物的平均粒径接近,都为(13±1)nm。紫杉醇的均一性最好,卡巴他赛的包封率最高,达到61.95%。Zeta电位都在±5 mV内,在此范围内,生物相容性较好。
3.2 载药纳米粒的体外释放行为
为了显示释放效果,选用市场上销售的紫杉醇注射剂Taxol®、多西他赛注射剂Taxotere®和多卡巴他赛注射剂Jevana®作为比照。Taxol®的释放速率较快,24 h释放73.1%,3号释放最多,达到52.23%,3种纳米粒与其开始阶段的释放现象相似,都具有缓慢释放的特性。实验结果表明,本实验制备的纳米粒具有较好的缓释效果,可以长期起到作用,但在释放量上Taxol®占有优势。对比3种纳米粒,发现载体用量越多,释放度越大。3种多西他赛纳米粒与Taxotere®的释放速率及释放度都相近,具有缓慢释放的特性。Taxotere®最大释放量达到88.65%,5号释放最多,达到75.00%。3种卡巴他赛纳米粒与Jevana®的释放速率及释放度都相近,且在10∶1与20∶1的条件下制备的纳米粒释放度比Jevana®更大,20∶1时释放度最大,达到85.50%(图1)。结果表明,本研究制备的纳米粒具有较好的缓释效果,可以长期起到作用。
3.3 载紫杉烷类药物纳米粒的体外抑瘤活性
用MTT法研究了临床应用的注射剂,载紫杉烷类药物纳米粒的体外抑瘤活性,结果见图2~图4。
随着纳米粒中PTX质量浓度的增加,MGC-803与HeLa细胞存活率有明显下降,但效果并不如Taxol®。且载体与PTX的质量比为20∶1时,抑瘤效果最好。从图3可以看出,随着纳米粒中DTX质量浓度的增加,细胞存活率有明显下降,但效果与Taxotere®相似。3种配方抑瘤效果相当。随着纳米粒中DTX质量浓度的增加,细胞存活率有明显下降,但效果与Jevana®相似,且载体与CBT的质量比为20∶1时效果最好。
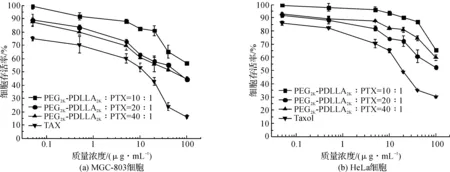
图2 PTX纳米粒质量浓度与MGC-803细胞、HeLa细胞存活率的关系Fig.2 In-vitro cytotoxicity of PEG-PDLLA in nanoparticle containing PTX at various concentrations(0.01-100 μg/mL) against MGC-803 and HeLa cancer cells at 48 h
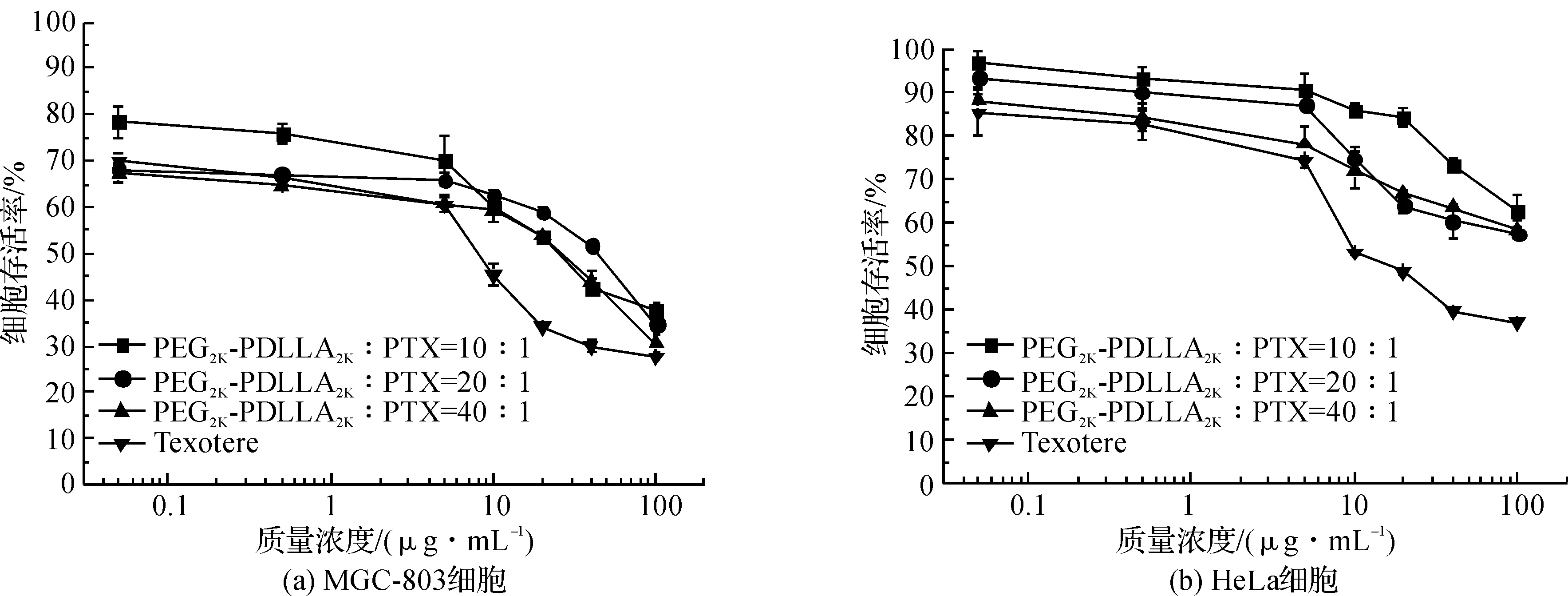
图3 DTX纳米粒质量浓度与MGC-803细胞和HeLa细胞存活率的关系Fig.3 In vitro cytotoxicity of PEG-PDLLA in nanoparticle containing DTX at various concentrations(0.01-100 μg/mL) against MGC-803 and HeLa cancer cells at 48 h
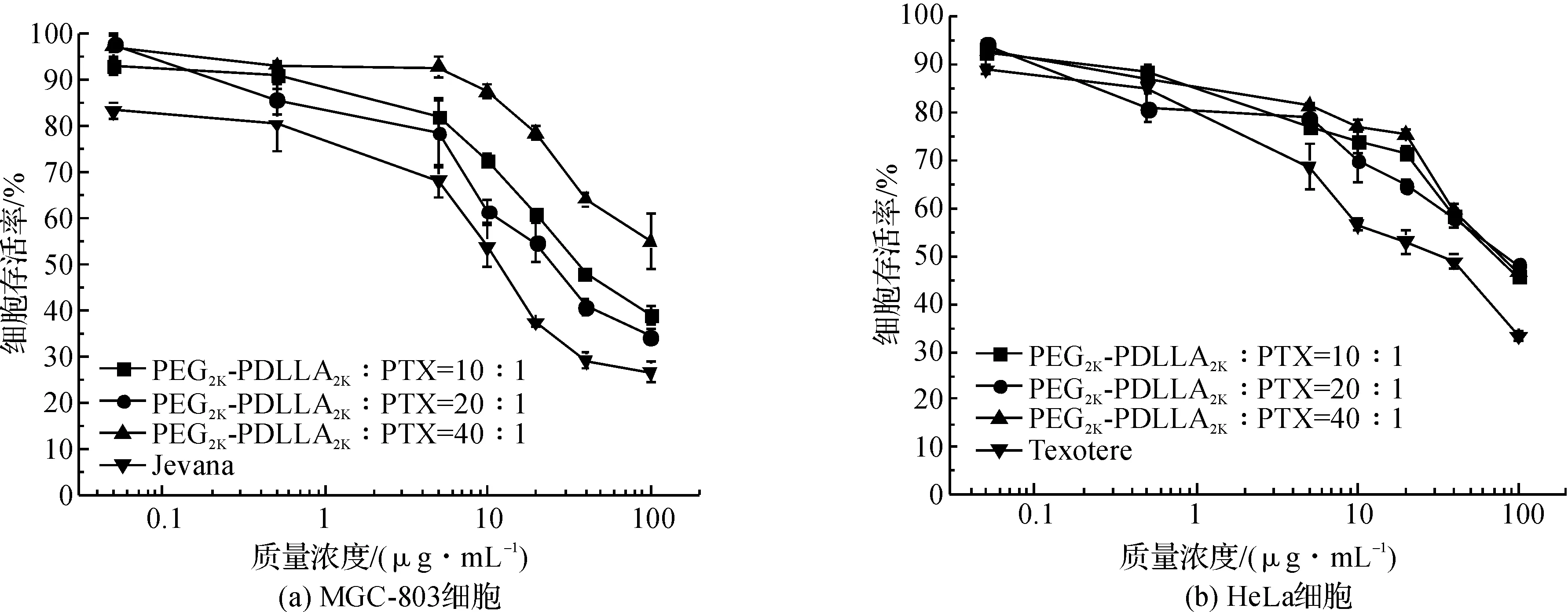
图4 CBT纳米粒质量浓度与MGC-803细胞和HeLa细胞存活率的关系Fig.4 In vitro cytotoxicity of PEG-PDLLA in nanoparticle containing CBT at various concentrations(0.01-100 μg/mL) against MGC-803 and HeLa cancer cells at 48 h
4结论
为了解决紫杉醇的溶解性,降低毒副作用,本研究采用生物可降解材料PEG-PDLLA,研究了影响纳米粒形成和药物包封的主要因素,通过体外细胞毒性和细胞摄取实验,考察了制备纳米粒的体外抗肿瘤活性。本研究主要得出如下结论:
1)PEG-PDLLA用量是影响紫杉烷类纳米粒的质量和制备工艺的重要因素。一般情况下,PEG-PDLLA用量增大,载药量随载体用量的增大而降低,但药物包封率增大,即包封效果好,纳米粒中药物释放的有效浓度增大。但当载体用量达到质量比40∶1时,稳定性与包封率也不一定高。综合考虑,PEG-PDLLA的用量不宜过大或过小,以20∶1为宜。
2)紫杉烷类药物的种类在纳米粒的形成过程中起重要作用,紫杉烷类的内在性质直接影响到纳米粒的形成。3种药物的平均粒径接近,都为(13±1)nm,粒径分布也较集中,可满足纳米粒载药体系的要求。紫杉醇的均一性最好,卡巴他赛的包封率最高。
3)载药纳米粒中药物均有一定程度的比较弱的突然释放,因此这些纳米粒具有较好的缓释作用。随着时间的延长,紫杉烷类药物释放速率慢慢降低,由于聚合物在室温中性溶液中降解速度的缓慢,药物的累积释放率也增加缓慢。载紫杉醇与多烯紫杉醇纳米粒的释放效果与市售药物相近,载卡巴他赛纳米粒的释放效果比市售药物更好。
4)载紫杉烷类药物纳米粒可提高药物的生物利用度,包封于纳米粒后其活性没有降低,而且可以从纳米粒中逐渐释放出来而在更长的时间内作用于癌细胞。另外,采用载紫杉醇纳米粒的形式给药,无需使用对人体有不良副作用的Cremophor EL等,更加有益于其临床应用。细胞存活率明显下降,与市售药物效果相近。
5)以PEG-PDLLA为载体包载紫杉烷类药物,并尝试通过改变载体用量来改善其溶解性的思路可行,但还需要更多的尝试。
参考文献:
[1]Paller C J, Antonarakis E S. Cabazitaxel: A novel second-line treatment for metastatic castration-resistant prostate cancer[J]. Drug Design Development and Therapy,2011(5):117-124.
[2]史清文.天然药物化学史话:紫杉醇[J].中草药,2011,42(10):1878-1884.
[3]Petrylak D P, Tangen C M, Hussain M H, et al. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer[J]. New England Journal of Medicine,2004,351(15):1513-1520.
[4]Gaucher G, Marchessault R H, Leroux J C. Polyester-based micelles and nanoparticles for the parenteral delivery of taxanes[J]. Journal of Controlled Release,2010,143(1):2-12.
[5]Le Broc-Ryckewaert D, Carpentier R, Lipka E, et al. Development of innovative paclitaxel-loaded small PLGA nanoparticles: Study of their antiproliferative activity and their molecular interactions on prostatic cancer cells[J]. International Journal of Pharmaceutics,2013,454(2):712-719.
[6]赵明明,肇丽梅.紫杉烷类抗肿瘤药物纳米制剂的研究进展[J].中草药,2013,44(24):3575-3581.
[7]Haley B, Frenkel E. Nanoparticles for drug delivery in cancer treatment[J].Urologic Oncology: Seminars and Original Investigations,2008,26(1):57-64.
[8]Fanciullino R, Ciccolini J, Milano G. Challenges, expectations and limits for nanoparticles-based therapeutics in cancer: A focus on nano-albumin-bound drugs[J]. Critical Reviews in Oncology Hematology,2013,88(3):504-513.
[9]钟克利,杜晓,励建荣.聚乙二醇改性壳聚糖作为小分子药物载体的研究进展[J].化学通报,2014,77(2):131-136.
[10]Sohn J S, Jin J I, Hess M, et al. Polymer prodrug approaches applied to paclitaxel[J]. Polymer Chemistry, 2010, 1(6): 778-792.
[11]王银松,王玉玫,李荣珊,等.新型壳聚糖基自组装纳米胶束紫杉醇药物释放载体[J].高等学校化学学报,2008,29(5):1065-1069.
[12]Yerlikaya F, Ozgen A, Vural I, et al. Development and evaluation of paclitaxel nanoparticles using a quality-by-design approach[J]. Journal of Pharmaceutical Sciences,2013,102(10):3748-3761.
[13]Jiang X Y, Xin H L, Ren Q Y, et al. Nanoparticles of 2-deoxy-d-glucose functionalized poly (ethylene glycol)-co-poly (trimethylene carbonate) for dual-targeted drug delivery in glioma treatment[J]. Biomaterials,2014,35(1):518-529.
[14]Wang Y, Ma S R, Xie Z S, et al. A synergistic combination therapy with paclitaxel and doxorubicin loaded micellar nanoparticles[J]. Colloids and Surfaces B: Biointerfaces,2014,116:41-48.
[15]Gu G Z, Xia H M, Hu Q Y, et al. PEG-co-PCL nanoparticles modified with MMP-2/9 activatable low molecular weight protamine for enhanced targeted glioblastoma therapy[J]. Biomaterials,2013,34(1):196-208.
Preparation and in-vitro evaluation of PEG-PDLLA
in nanoparticle containing taxanes
WEI Wei1,2, ZHANG Yingxin3, ZHANG Xiaomin3, JIANG Chengjun1,2, ZHOU Yifeng1,2
(1.School of Biological and Chemical Engineering, Zhejiang University of Science and Technology,
Hangzhou 310023, China; 2.Zhejiang Provincial Key Laboratory for Chemical and Biological
Processing Technology of Farm Produce, Hangzhou 310023, China;
3.Pushikang Biological Technology Co., Ltd., Hangzhou 310021, China)
Abstract:PEG-PDLLA in nanoparticle containing taxanes was prepared by emulsion solvent evaporation method. The particle size and Zeta potential were evaluated by Malvern Zerta sizer. The encapsulation efficiency and drug-loading content were examined by HPLC method. The kinetics of taxanes released from the nanoparticle in phosphate buffer solution (PBS) was studied. The uptake and cell toxicity of drug-loading nanoparticle in MGC803 and HeLa were preliminary evaluated. The result showed that the particle size is (13±1) nm, and distribution is concentrated. The ratio of the carrier and the drug is preferably 20∶1. The homogeneity of taxol is best, and encapsulation efficiency of cabazitaxel is highest, reach 88.77%. The nanoparticle with drug has a better sustained release. Survival of cancer cells in vitro anti-tumor decreased with similar clinical results with injections.The nature, release, and cell inhibition rate of PEG-PDLLA in nanoparticle containing taxanes is good.The test provides an experimental basis for the development of novel taxanes intravenous formulations.
Key words:taxanes; PEG-PDLLA; nanoparticle; in-vitro evaluation; cytotoxicity
中图分类号:R979.1;R965
文献标志码:A
文章编号:1671-8798(2015)01-0015-07
通信作者:蒋成君,高级工程师,博士,主要从事制药工程研究。
作者简介:魏炜(1992—),女,浙江省嵊州人,硕士研究生,研究方向为药物制剂。
基金项目:中国博士后科学 (2014M551745)
收稿日期:2014-10-11
doi:10.3969/j.issn.1671-8798.2015.01.004
