棉花GhWRKY4a基因的分离及表达分析
2015-02-21王存兴王琛赵光栋
王存兴,王琛,赵光栋
1.济宁高级职业学校,山东济宁272100
2.山东农业大学生命科学学院,山东泰安271018
棉花GhWRKY4a基因的分离及表达分析
王存兴1,王琛2,赵光栋2
1.济宁高级职业学校,山东济宁272100
2.山东农业大学生命科学学院,山东泰安271018
WRKY转录因子是主要存在于植物中的一类转录因子,在植物的衰老、生长发育、生物和非生物胁迫应答等过程中起着重要的调控作用。本研究通过电子克隆结合RT-PCR技术从陆地棉(Gossypium hirsutum)中分离得到一个GhWRKY4a基因。序列分析表明,该基因开放阅读框1539 bp,编码512个氨基酸,其预测蛋白含有一个WRKY结构域和C2H2型锌指结构,属于典型的Ⅱ类b族WRKY基因。亚细胞定位分析显示,GhWRKY4a特异性的定位在细胞核中。此外,利用PlantCare数据库预测该基因启动子含有多个生物与非生物胁迫响应、光应答和生长发育相关的顺势作用元件。利用qRT-PCR方法研究GhWRKY4a基因在转录水平的表达特性,结果表明该基因的表达受到多种生物和非生物胁迫的影响。由此推测,GhWRKY4a可能参与了复杂的植物信号途径并在植物的抗逆反应中发挥了重要的作用。
棉花;基因克隆;GhWRKY4a;表达分析
由于植物的固着属性及自然界的环境变化,植物时刻遭受着各种生物和非生物的胁迫,如病虫害、干旱、低温、高盐等。为了适应多变的环境条件,植物在进化过程中形成了一系列调节机制。研究结果表明,转录因子在这一系列的调控中具有重要作用[1,2],有关高等植物转录因子编码基因的结构和功能及其在植物改良中的应用研究,已成为植物基因表达调控领域的热门课题,尤其是拟南芥基因组测序完成后,对其转录因子的研究更为突出[3]。其中WRKY转录因子家族是近年来研究较广泛的一类重要的转录因子。
WRKY蛋白是主要存在于植物中的转录调节因子。自从它的第一个家族成员在甘薯中被发现后[4],WRKY转录因子逐渐成为人们研究的热点,在拟南芥(Arabidopsis thaliana)和水稻(Oryza sativa)中分别分离了74和109个WRKY基因[5],雷蒙德氏棉(Gossypium raimondii)和陆地棉(Gossypium hirsutum)中分别得到116和103个WRKY基因[6]。WRKY转录因子含有一个或两个保守的、约60个氨基酸的DNA结合结构域(被称为WRKY结构域)。WRKY结构域N端为高度保守的氨基酸序列(WRKYGQK),因此命名为WRKY转录因子;C端为锌指结构(C-X4-5-C-X22-23-H-X1-H型或C-X7-C-X23-H-X1-C型)[7]。WRKY结构域能够通过与核心序列为(T)(T)TGAC(T/C)的W-box顺式元件特异结合而调节基因的表达[8]。根据WRKY结构域的数量和锌指结构的特点,可将WRKY转录因子家族分为三大类(Ⅰ,Ⅱ,Ⅲ)。根据额外的保守结构,II类WRKY转录因子进一步分为IIa、IIb、IIc、IId和IIe五个亚族[9]。
WRKY基因在植物体内并非组成型表达,而是受生物胁迫、各种环境因子(干旱、低温、高温、高盐、机械胁迫等)和信号分子的诱导表达。例如,在辣椒(Capsicum annuum)中,CaWRKY27作为一个正调节因子通过SA、JA/ET介导的信号途径提高了转基因烟草对青枯菌(R.solanacearum)的抗性[10]。烟草用烟草花叶病毒(TMV)或者细菌进行感染,再或者使用真菌诱导、水杨酸(SA)以及H2O2处理后,将强烈诱导WRKY基因的超量表达[11-13]。在拟南芥中,49/72的被测试WRKY基因均对细菌感染和SA处理做出了快速反应[14]。非生物胁迫如创伤、干旱、低温的适应性、热诱导的骤冷耐受性也会引发WRKY基因在植物中的表达[15-17]。大量研究表明,WRKY类家族基因在植物的抗逆性方面起着重要的作用。
WRKY转录因子作为植物应对外界生物与非生物胁迫中重要的响应蛋白,已经越来越多的引起了人们的关注。因此,阐明WRKY转录因子在防御网络中调控与作用机理,对于培育抗逆作物品种具有重要的理论与实践意义。棉花是一种非常重要的纤维和油料作物,其产量和品质常常受到各种复杂环境的影响,本研究我们从陆地棉(Gossypium hirsutum)中分离出一个典型的II类b族的WRKY基因,命名为GhWRKY4a,并分析了棉花在受到各种生物胁迫和非生物胁迫后GhWRKY4a的响应特性。研究发现,病原菌及多种抗病相关激素可以影响GhWRKY4a基因的表达,GhWRKY4a可能参与复杂的信号传导途径,并在激素介导的植物的抗病反应中起重要作用。本实验为进一步研究该基因在棉花抗病反应中的作用奠定了理论基础,并为棉花基因工程育种提供新的基因资源。
1 材料和方法
1.1 实验材料
1.1.1 植物材料供试材料陆地棉(Gossypium hirsutum)鲁棉22为本实验室保存。
1.1.2 菌株与质粒本研究所用的克隆载体pEASY-T1 simple购于Transgen公司,大肠杆菌菌种Escherichia coli(DH5α)为本实验室保存。
1.1.3 酶及生化试剂RNA反转录试剂盒为康为世纪公司产品,cDNA纯化试剂盒Wizard DNA Clean-up System购自Promega公司,质粒提取试剂盒Plasmid Mini Kit购自OMEGA公司,胶回收试剂盒购自索莱宝公司。CTAB、DEPC、Tris、β-巯基乙醇等化学试剂均购于Sigma公司。
1.1.4 PCR引物PCR引物(表1)由上海生物工程公司合成。

表1 本实验所用的引物序列Table 1 The primers used in this study
1.2 棉花材料处理
棉花种子经自来水冲洗后用湿润的纱网包住置于25℃培养箱中避光催芽萌发,萌发的棉花种子去壳后摆放到纱网上于光照培养箱中水培,相对湿度60~75%,光照强度1500 Lux,光照条件为16 h光照/8 h黑暗。对子叶期幼苗(约萌发后的第7 d),进行如下胁迫处理:
(1)非生物胁迫处理:
200 mM/L NaCl处理0 h,2 h,4 h,6 h,8 h,12 h;用200 mM NaCl的水培幼苗。
15%PEG6000处理0 h,2 h,4 h,6 h,8 h,12 h;用浓度为15%的PEG6000(w/v)水培幼苗。
(2)信号分子处理:
10 mmol/L SA处理0 h,2 h,4 h,6 h,8 h,12 h;喷洒叶片。
100 μM/L MeJA处理0 h,2 h,4 h,6 h,8 h,12 h;喷洒叶片。
5 mmol/L ET处理0 h,2 h,4 h,6 h,8 h,12 h;喷洒乙烯利于叶片。
10 mmol/L H2O2处理0 h,2 h,4 h,6 h,8 h,12 h;喷洒叶片。
(3)用青枯病菌、立枯病菌的悬浮液滴灌法接种根,处理时间段为1 d,2 d,3 d,4 d,5 d。清水作对照。在不同的处理时间分别取子叶置于液氮中冷冻,-80°C保存备用。
1.3 RNA的提取,cDNA的合成和DNA的分离
RNA的提取根据TaKaRa公司的TRIzol试剂盒说明书进行,RNA提取物经过不含RNA酶的DNaseI(Promega公司)纯化后,用康为世纪公司的反转录试剂盒合成cDNA。DNA的提取根据CTAB法进行[18]。
1.4 GhWRKY4a CDS全长的克隆
根据雷蒙德氏棉基因组数据库,设计特异性引物WRKY-5和WRKY-3,以cDNA为模板进行PCR,琼脂糖凝胶电泳检测结果。将获得的目的片段回收后连接到克隆载体pEASY-T1 simple上,然后转化大肠杆菌DH5α感受态细胞,在含Amp的LB固体培养基上37℃培养过夜后,挑取单菌落,于600 μLLB(Amp)液体培养基中,37℃振荡培养3 h后进行菌液PCR鉴定。将鉴定好的菌液寄往上海生物工程公司测序。
1.5 GhWRKY4a基因组全长及启动子序列的克隆
利用特异性引物WRKY-5和WRKY-3,以棉花DNA为模板进行PCR,并将获得的目的片段回收后连接到克隆载体pEASY-T1 simple上,转入大肠杆菌感受态细胞中,筛选阳性克隆后送上海生物工程公司进行测序,得到GhWRKY4a的基因组全长序列。
设计特异性引物WRKY-Q-5和WRKY-Q-3,以棉花DNA为模板进行PCR,PCR产物经琼脂糖凝胶电泳进行检测,切下目的条带后与克隆载体pEASY-T1 simple相连,筛选阳性克隆后送上海生物工程公司测序得到GhWRKY4a的启动子序列。
1.6 亚细胞定位分析
利用引物WRKY-L-F(含XbaI酶切位点)和WRKY-L-R(含KpnI酶切位点)来扩增GhWRKY4a全长cDNA片段,并将目的片段与pEASY-T1 simple载体连接,选择阳性克隆送上海生物工程公司测序。测序正确后,利用XbaI和KpnI进行双酶切,将目的片段与PBI121-GFP质粒连接构建重组质粒。通过基因枪注射,将重组质粒转入洋葱表皮细胞中,利用荧光显微镜观察绿色荧光并拍照。
1.7 GhWRKY4a基因的表达模式分析
以GhUBI基因为内参基因,利用qRT-PCR分析GhWRKY4a基因的表达模式。RNA的提取和cDNA的合成与上述方法相同。qRT-PCR所用的SYBR Premix Ex Taq购自TaRaKa公司,荧光定量PCR仪CFX96TMReal-time Detection System购自Bio-Rad公司。
1.8 生物信息学分析
利用NCBI网站的BLAST(http://www.ncbi.nlm.gov/blast)和DNAman software 5.2.2进行同源序列比对和分析;用MEGA4.1构建系统进化树;用PSORT程序进行蛋白预测。利用PlantCare(bioinformatics.psb.ugent.be/webtools/plantcare/html/)数据库分析启动子序列。
2 结果与分析
2.1 GhWRKY4a基因的分离
利用特异性引物WRKY-5和WRKY-3,以棉花总RNA的反转录产物为模板进行PCR,扩增得到一条约1600 bp的条带。测序鉴定后,利用DNAman software 5.2.2对序列进行分析,该序列与雷蒙德氏棉基因组数据库中的Cotton-D_gene-10023049基因的同源性为98%,初步证明该PCR片段为所要克隆的棉花目的基因,命名为GhWRKY4a。该序列包含1539 bp的开放阅读框,编码512个氨基酸残基,预测蛋白质的分子质量为55.04 kDa(图1)。

图1 GhWRKY4a全长CDS序列及其推导的氨基酸序列WRKYGQK序列、翻译起始密码子(ATG)与终止密码子(TAG)用方框标出Fig.1 Nucleotide sequences of CDS and deduced sequence of amino acid residues of GhWRKY4aWRJKYGQK sequence,translation initiation codon(ATG)and termination codon(TAG)were marked in box

图2 GhWRKY4a与其他WRKY蛋白序列的同源性比较相同的氨基酸用黑色阴影标出;60个氨基酸残基的WRKY结构域用箭头标出;WRKYGQK序列用方框标出Fig.2 Comparison of homology between GhWRKY4a and other WRKYprotein sequenceThe same amino acids were shaded in black. The WRKY structure domains of 60 amino acids were indicated with arrows. WRJKYGQK sequence was marked in box
2.2 GhWRKY4a蛋白序列分析
同源蛋白序列比对发现,GhWRKY4a蛋白在284~290位氨基酸残基为一个典型的WRKY结构域(图2),是WRKY的典型特征。该WRKY结构域由60个氨基酸残基组成,包含一个保守的WRKYGQK氨基酸序列和一个C-X4-5-C-X22-23-H-X1-H型锌指结构(图2)。这些结构特征表明所得基因确实为第II亚族的WRKY成员。通过雷蒙德氏棉基因组数据库和TAIR网站查到一些已知分类的WRKY基因,利用MEGA4.1软件对这些WRKY蛋白进行聚类分析,构建了同源进化树。聚类分析表明WRKY蛋白分为三类(第I、II、III族),其中第II族可进一步分为五个亚族(IIa、IIb、IIc、IId和IIe)。GhWRKY4a与IIb亚族的WRKY成员进化关系密切,包括AtWRKY42、GrWRKY4(图3)。由进化树可以看出,GhWRKY4a属于IIb亚族。WRKY类转录因子在进化上的多样性,也预示了其功能的多样性,而且不同物种的同一个亚族的成员间可能在功能上具有相似性。
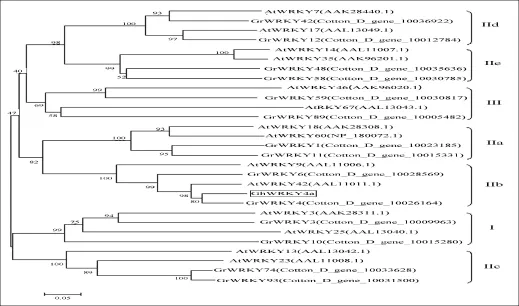
图3 GhWRKY4a蛋白序列与雷蒙德氏棉、拟南芥WRKY蛋白质序列的聚类分析GhWRKY4a用方框标出Fig.3 Dendrogram of cluster analysis on GhWRKY4a protein and Gossypium raimondii and Arabidopsis WRKY proteins sequenceGhWRKY4a was marked in box
2.3 GhWRKY4a基因组序列分析
根据已获得的GhWRKY4a基因cDNA全长序列设计了一对特异性引物(WRKY-Q-F和WRKY-Q-R),以棉花基因组DNA为模板,进行PCR扩增,得到长度为1888 bp的片段。将GhWRKY4a的DNA序列与CDS序列进行比较后,发现该基因共含有4个内含子(图4)。并且这4个内含子都具有植物内含子的典型特征:富含AT;在5′和3′端的剪切位点均含有保守的5′-GT和AG-3′序列。

图4 GhWRKY4aDNA结构示意图灰色方块代表外显子,直线代表内含子Fig.4 Schematic representation of the DNA structure of GhWRKY4aGrey boxes indicated exons,and lines indicated introns
2.4 GhWRKY4a基因的启动子序列分析
利用雷蒙德氏棉基因组数据库,设计特异性引物WRKY-Q-F和WRKY-Q-R,克隆得到1098 bp的启动子序列。用PlantCare软件分析预测后发现,在该启动子中,包含多种胁迫相关的应答元件,部分预测的顺式作用原件序列及位置如图5。该序列中存在典型的TATA-box和CAAT-box。除此之外,这该区域中还存在非生物胁迫应答元件(如CGTCA-motif(响应信号分子MeJA),ERE(响应信号分子ethylene),TC-rich repeats(胁迫和防御反应元件),以及与干旱胁迫有关的MBS元件等),生物胁迫应答元件,光响应元件及生长发育相关的元件。预测结果表明,GhWRKY4a可能与植物的生物和非生物胁迫应答和生长发育相关。

图5 GhWRKY4a启动子部分作用元件Fig.5 Functional partial elements of the promoter of GhWRKY4a
2.5 亚细胞定位分析
运用在线分析软件PSORT,预测GhWRKY4a蛋白定位在细胞核。为了进一步确认GhWRKY4a蛋白在细胞内的亚细胞定位,将CaMV35S启动子与GhWRKY4a连接构建了pBI121-GhWRKY4a-GFP表达载体,35S::GFP作对照(图6-A)。然后用基因枪法将重组质粒和空载体转化入洋葱表皮细胞使其瞬时表达,经DAPI染色观察细胞核后,利用GFP发射的荧光观察GhWRKY4a的定位。如图6-B所示,含有GhWRKY4a-GFP融合蛋白在洋葱表皮中瞬时表达定位在细胞核,对照35S-GFP质粒转化洋葱表皮后起GFP荧光信号在细胞质和细胞核中都有表达,通过此结果可以推断GhWRKY4a定位于细胞核内。该实验结果与软件预测一致。
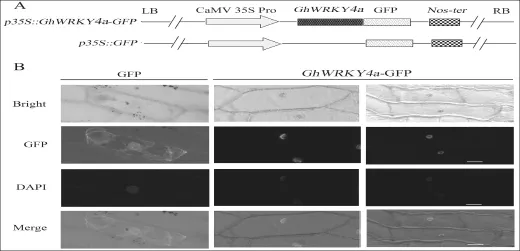
图6 GhWRKY4a::GFP融合蛋白的亚细胞定位(A)35S-GhWRKY4a::GFP和35S-GFP载体构建图;(B)35S-GFP和35S-GhWRKY4a::GFP在洋葱表皮中的瞬时表达。基因枪轰击洋葱表皮后12 h通过荧光显微镜进行观察Fig.6 Subcellular localization of GhWRKY4a::GFPfusion protein(A) Schematic representation of 35S-GhWRKY4a::GFP fusion construct and 35S-GFP construct. (B) Transient expression of the 35S-GhWRKY4a::GFP and 35S-GFPconstructs in onion epidermal cells. The cells were viewed by confocal laser scanning microscope at 12 h after particle bombardment.
2.6 GhWRKY4a基因的表达模式分析
通过对GhWRKY4a启动子序列的预测分析,可以推测GhWRKY4a可能参与到植物的胁迫应答过程中。为进一步研究GhWRKY4a的功能,我们通过实时荧光定量PCR的方法,检测了GhWRKY4a在生物胁迫、非生物胁迫及外源植物激素的作用下的表达特性。越来越多的研究证明WRKY家族参与植物的非生物胁迫应答反应,为了探究GhWRKY4a是否参与了非生物胁迫应答,我们对棉花进行了干旱(PEG),高盐(NaCl)处理。由图7-B可以看出,干旱处理后,GhWRKY4a的表达量从2 h开始增加,8 h达到最大值。而NaCl处理后,该基因的表达没有明显的变化(图7-A)。
为了探讨GhWRKY4a在棉花应对生物胁迫中的作用,我们给棉花幼苗接种了棉立枯(R.solani)和青枯劳尔氏菌(R.solanacearum)。结果如图7-G所示,在接种棉立枯后,GhWRKY4a表达明显受到抑制,接种第二天开始基因表达量明显提高但都低于对照组。在接种青枯劳尔氏菌后,GhWRKY4a的表达量同样显著下降(图7-H)。因此,我们推测GhWRKY4a可能参与病原信号转导途径。
植物激素以信号分子的形式参与到植物复杂的信号途径中,SA、JA、ET和H2O2等作为重要的信号分子在调解下游防卫基因和植物应对生物和非生物胁迫的应答反应中发挥着不可或缺的作用[19-20]。为了研究GhWRKY4a在信号转导中的作用,我们检测了该基因在SA,ET,MeJA和H2O2诱导条件下的表达特性。由图7可以看出,SA,ET,MeJA和H2O2均能显著抑制该基因的表达。根据这些结果推断GhWRKY4a可能参与复杂的信号传导途径,并在激素介导的植物的抗病反应中起重要作用。
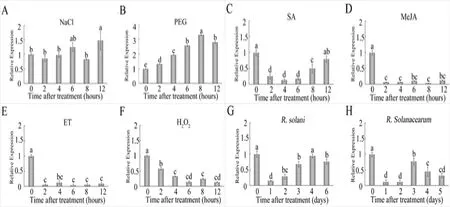
图6 GhWRKY4a在不同处理条件的表达模式分析Fig.6 Expression patterns analysis of GhWRKY4a under different treated conditions
3 讨论
随着基因分子生物学研究的不断深入,越来越多的WRKY家族转录因子被克隆。WRKY转录因子作为植物应对外界生物与非生物胁迫中重要的响应蛋白已经引起人们越来越多的关注。WRKY基因家族除了在植物抗逆信号转导方面发挥着重要作用以外,在调控植物生长发育方面也具有非常重要的作用,包括叶片的衰老、种子形成、休眠、萌发、果实的成熟、根毛发育、胚胎形成等过程。目前WRKY转录因子在植物体内尤其是在模式植物水稻和拟南芥中的生物学功能得到了广泛的研究和阐明,但是关于棉花WRKY基因的结构和功能研究非常少。棉花是一种重要的经济作物,其产量常常受到各种复杂环境的影响,为探究棉花WRKY转录因子的功能,我们以棉花为研究对象,分离了一个IIb亚族WRKY基因,命名为GhWRKY4a,并对其表达特性及生物学功能进行了初步探讨。
蛋白序列分析及聚类分析发现转录因子GhWRKY4a具有典型的WRKY结构域,是WRKY基因Ⅱ类b族的成员之一。亚细胞定位进一步证明了GhWRKY4a定位于细胞核内,这就意味着GhWRKY4a与其他的WRKY转录因子一样是在细胞核中发挥作用的。这与转录因子主要在细胞核中行使其功能的特征一致。
为了深入了解GhWRKY4a的功能,我们克隆了这个基因的部分启动子序列并对该序列进行了预测分析,发现该启动子序列中除了含有启动子的核心序列TATA-box,CAAT-box,还发现了信号分子应答元件、光应答元件、非生物胁迫应答元件、胚乳发育相关的元件等。对启动子序列的分析将有助于更进一步的了解基因的功能。GhWRKY4a基因在转录水平的表达特性分析进一步表明,该基因的表达受到多种生物和非生物胁迫的影响。推测GhWRKY4a可能参与复杂的信号传导途径,并在植物的抗逆反应中起重要作用。
在抗病应答过程中,植物激活体内一系列的信号途径,这些信号途径中许多抗病相关基因能够被激活表达。SA、JA、ET是抗病反应中关键的信号分子。SA介导的信号途径一般与活体营养型病菌激发的抗病反应相关;而JA/ET介导的信号途径一般与坏死营养型病菌或者昆虫侵染激发的抗病反应相关[21]。这两种信号途径通过相互拮抗或者协同作用共同影响着植物抗病反应的结果。SA和H2O2是植物防卫反应中两种非常重要的信号分子,植物本身系统获得性抗性(System acquired resistance,SAR)就是SA介导的。H2O2作为第二信使能够自由穿越细胞膜直接行使胞间信号转导功能,在植物的防卫反应中起重要作用。另外,当植物受到环境胁迫时,体内活性氧(ROS)会迅速增加,从而激活相关基因的表达,H2O2是ROS的组分之一。对GhWRKY4a在多种信号分子胁迫下的表达特性进行了分析,结果表明,GhWRKY4a的表达可以被SA、MeJA、ET和H2O2所抑制。由此推测GhWRKY4a可能参与SA信号途径及JA/ET介导的抗病信号途径。
综上所述,GhWRKY4a应答于多种信号分子、非生物胁迫和病原菌胁迫,由此我们推测,该基因可能参与棉花的抗病反应,本研究为进一步探明该基因在棉花防卫反应中的作用奠定了基础。
[1]Maruyama K,Sakuma Y,Kasuga M,et al.Identification of cold-inducible downstream genes of the Arabidopsis DREB1A/CBF3 transcriptional factor using two microarray systems[J].The plant journal,2000,38:982-33
[2]Zhang H,Li W,Chen J,et al.Transcriptional activator TSRF1 reversely regulates pathogen resistance and osmotic stress tolerance in tobacco[J].Plant molecular biology,2007,63:63-71
[3]Gong W,Shen YP,Ma LG,et a1.Genome-wide ORFeome cloning and cnalysis of Arabidopsis transcription factor genes[J].Plant physiology,2004,135:773-782
[4]Ishiguro S,Nakamura K.Characterization of a cDNA encoding a novel DNA-binding protein,SPF1,that recognizes SP8 sequences in the 5'upstream regions of genes coding for sporamin and beta-amylase from sweet potato[J]. Molecular&general genetics:MGG,1994,244(6):563-71
[5]Wu KL,Guo ZJ,Wang HH,et al.The WRKY family of transcription factors in rice and Arabidopsis and their origins[J].DNARes,2005,12(1):9-26
[6]Dou L,Zhang X,Pang C,et al.Genome-wide analysis of the WRKY gene family in cotton[J].Molecular genetics and genomics:MGG,2014,289(6):1103-21
[7]Rushton PJ,Somssich IE,Ringler P,et al.WRKY transcription factors[J].Trends in plant science,2010,15(5):247-58
[8]PandeySP,SomssichIE.TheroleofWRKYtranscriptionfactorsinplantimmunity[J].Plantphysiology,2009,150(4):1648-55
[9]EulgemT,RushtonPJ,RobatzekS,etal.TheWRKYsuperfamilyofplanttranscriptionfactors[J].Trendsinplantscience,2000,5(5):199-206
[10]Dang F,Wang Y,She J,et al.Overexpression of CaWRKY27,a subgroup IIe WRKY transcription factor of Capsicum annuum, positivelyregulatestobaccoresistancetoRalstoniasolanacearuminfection[J].Physiologiaplantarum,2014,150(3):397-411
[11]Chen C,Chen Z.Isolation and characterization of two pathogen and salicylic acid-induced genes encoding WRKY DNA-binding proteins from tobacco[J].Plant molecular biology,2000,42:387-396
[12]Yoda H,Ogawa M,Yamaguchi Y,et al.Identification of early-responsive genes associated with the hypersensitive response to tobacco mosaic virus and characterization of a WRKY-type transcription factor in tobacco plants[J]. Molecular genetics and genomics,2002,267:154-161
[13]Takemoto D,Yoshioka H,Doke N,et al.Disease stressinducible genes of tobacco:expression profile of elicitorresponsive genes isolated by subtractive hybridization[J].Physiol plant,2003,118:545-553
[14]Dong J,Chen C,Chen Z.Expression profiles of the Arabidopsis WRKY gene super family during plant defense response[J].Plant mol biol.,2003,51:21-37
[15]Rizhsky L,Liang H,Mittler R.The combined effect of drought stress and heat shock on gene expression in tobacco[J]. Plant physiol,2002,130:1143-1151
[16]Robatzek S,Somssich IE.A new member of the Arabidops is WRKY transcription factor family,AtWRKY6,is associated with both senescenceand defense-related processes[J].Plant J,2001,28:123-133
[17]Sanchez-Ballesta MT,Lluch Y,Gosalbes MJ,et a1.A survey of genes differentially expressed during Long-term heat-induced chilling tolerance in citrus fruit[J].Planta,2003,218:65-70
[18]Porebski S,Bailey LG,Baum BR.Modification of a CTAB DNA extraction protocol for plants containing high polysaccharide and polyphenol components[J].Plant mol biol Rep,1997,15:8-15
[19]Rushton DL,Tripathi P,Rabara RC,et al.WRKY transcription factors:key components in abscisic acid signaling[J]. Plant biotechnol journal,2011,10:2-11
[20]Chen LG,Song Y,Li S,et al.The role of WRKY transcription factors in plant abiotic stresses[J].Biochim.biophys, 2012,1819:120-128
[21]Robert-SeilaniantzA,NavarroL,BariR,et al.Pathologicalhormoneimbalances[J].CurrOpinPlantBiol,2007,10:372-379
IsolationandExpressionAnalysisofGhWRKY4afromGossypiumhirsutum
WANG Cun-xing1,WANG Chen2,ZHAO Guang-dong2
1.Jining Senior Vocational School,Jining 272100,China
2.College of Life Science/Shandong Agricultural University,Taian 271018,China
WRKY transcription factors are a kind of transcription factors mainly existing in plants.It plays an important role in regulating plant senescence,growth,development and responses to various abiotic and biotic stresses.In this study,we isolated and characterized GhWRKY4a from cotton(Gossypium hirsutum)through the in silico cloning and RT-PCR.Sequence analysis revealed that the GhWRKY4a contained a complete open reading frame(ORF)of 1539 bp,which encoded 512 amino acids.The predicted protein contains a WRKY domain and a C2H2-type zinc finger motif,which belongs to typicalⅡb family.Subcellular localization analysis revealed that GhWRKY4a protein localized to the nucleus.In addition,various putative cis-acting elements involved in abiotic and biotic stress responses,light responses and development were predicted by the database search programs PlantCare.We analyzed the expression pattern at the level of transcription of GhWRKY4a by quantitative real-time PCR.The result showed that the expression of GhWRKY4a was influenced by various abiotic and biotic stresses.According to the results, we deduced that GhWRKY4a is regulated by an intricate network of signaling cascades and may play an important role in cotton defense responses.
Cotton;gene cloning;GhWRKY4a;expression analysis
S642.4
A
1000-2324(2015)05-0658-08
2014-04-11
2014-05-02
王存兴(1959-),男,学士,高级讲师,主要从事植物生物学教学与研究.E-mail:wangcx7818@sina.com
