巨尾桉胞质EuCuZnSOD基因的克隆与原核表达
2015-02-21赵艳玲周利建
赵艳玲, 周利建
(华侨大学 化工学院, 福建 厦门 361021)
巨尾桉胞质EuCuZnSOD基因的克隆与原核表达
赵艳玲, 周利建
(华侨大学 化工学院, 福建 厦门 361021)
通过克隆巨尾桉的细胞质EuCuZnSOD基因,构建原核表达载体pET-CuZnSOD,并研究该基因的功能.测序结果表明:基因序列长度为459 bp;152个编码氨基酸,蛋白相对分子质量为15.2 ku.在28 ℃条件下,1 mmol·L-1异丙基硫代半乳糖苷(IPTG)诱导4 h,转化菌株的超氧化物歧化酶(SOD),总酶活比对照组平均高19.9%.结果表明:克隆获得的巨尾桉细胞质EuCuZnSOD的重组基因表达产物具有SOD酶活性,GenBank注册号为JX138573.
巨尾桉;EuCuZnSOD基因; 铜锌超氧化物歧化酶; 克隆; 原核表达.
桉树在我国造纸木浆生产上具有重要地位,但是低温限制了桉树的种植范围,盲目北移推广种植遭受重大经济损失.过去的桉树抗寒性研究主要集中在优树选育、抗寒锻炼和抗寒生理生化机制等,随着现代生物技术的发展,通过基因工程手段定向增加树木抗寒能力已成为可能.超氧化物歧化酶(superoxide dismutase,SOD)是体内氧自由基清除反应的第1个酶类,催化超氧负离子转变成O2和H2O2.植物细胞主要含有3 种类型的SOD:CuZnSOD,MnSOD和FeSOD[1].CuZnSOD(简称CSD)是3 种歧化酶中质量分数最丰富的一种,是活性氧清除酶系统中最重要的酶,分布于植物的叶绿体、细胞质、质外体、过氧化物酶体和细胞核[2],与植物的非生物胁迫如旱[3]、盐碱[4]、重金属[5]、低温[6],以及生物侵袭[7-8]等多种氧化应激反应密切相关.在桉树抗寒性与保护酶的关系方面,国内主要研究SOD活性,SOD活性是桉树本身遗传因子所决定的,可作为筛选桉树抗寒性的一个生理指标.研究发现:造成巨尾桉幼苗低温伤害的主要原因是体内活性氧代谢的失调[9].尾巨桉幼苗在低温胁迫下SOD的活性先升高,后降低,随低温胁迫时间的延长酶活性下降[10],桉树的不同种类应对低温逆境时,其SOD的活性变化差异明显[11],低温胁迫处理后,耐寒的邓恩桉比尾叶桉的SOD活性高[12].桉树个体内的SOD活性随时间不断变化,耐寒能力强的桉树,SOD低温反应较敏感[13].综上所述:SOD的活性越高,表明桉树对低温胁迫的抵抗能力越强.但是,桉树的CuZnSOD基因至今未有成功克隆,GenBank中只注册成功一段长390 bp的mRNA部分序列.本文成功克隆了巨尾桉的EuCuZnSOD基因,通过该基因的原核表达确定了EuCuZnSOD基因的功能,为进一步探讨桉树的抗寒性机理提供了物质基础.
1 材料与方法
1.1 材料
1.1.1 菌株与植物材料 pET-32a(+),E.coliJM109,BL21(DE3),巨尾桉植株为本实验室保存;pMD18-T Vector购自大连Takara有限公司.
1.1.2 试剂 PrimeScript Ⅱ 1st Strand cDNA Synthesis Kit,聚合酶链式反应(PCR)体系等均购自大连Takara公司;其他试剂购自上海生工公司;引物由厦门精聚公司合成.
1.2 实验方法
1.2.1 巨尾桉EuCuZnSOD的克隆 用Trizol法提取巨尾桉总RNA(),根据Takara公司的反转录试剂盒说明书反转录总RNA,通过生物信息技术分析植物CuZnSOD基因的保守区域,设计引物 FSOD: 5′ATGGTGAA- GGCCGTTGCCGTCC 3′,RSOD:5′TTAGCCTTGCAGACCAATAATAC 3′,应用降落PCR 扩增目的基因,反应程序为:94 ℃变性2 min;然后94 ℃,30 s,65~56 ℃退火45 s (每个循环降低1 ℃),72 ℃延伸60 s,共10个循环;之后,94 ℃,30 s,55 ℃,45 s,72 ℃,60 s,共20个循环;最后72℃延伸5 min.玻璃奶回收试剂盒(美国Promega公司)回收目的片段与pMD18-T Vector连接.重组载体转化JM109感受态,筛选阳性质粒.通过Sac I/BamH I双酶切验证阳性克隆子,命名为pMD-CSD,送上海生工生物工程股份有限公司双向测序,将测序结果提交至NCBI.
1.2.2 原核表达载体pET-CuZnSOD的构建 将pMD-CSD和pET-32a(+)质粒用BamH I和Sac I双酶切后,回收目的片段,并连接,转化BL21感受态,筛选阳性克隆菌株,Sac I/BamH I双酶切验证,命名为pET-CuZnSOD.
1.2.3EuCuZnSOD蛋白原核表达 将含有pET-CuZnSOD的BL21菌株、含有pET-32a(+)的BL21菌株及空菌株BL21,分别接种于5 mL LB培养基中(50 μg·mL-1Amp),37 ℃振荡培养过夜;以1∶50量各接种两瓶共6瓶50 mL LB培养基中( 50 μg·mL-1Amp),37 ℃振荡培养至D(600)为0.4,添加1 mmol·L-1的异丙基硫代半乳糖苷(IPTG)诱导,不加IPTG为空白对照组,37 ℃诱导4 h后取1 mL菌液离心,收集菌体,加100 μL的蛋白上样缓冲液,沸水5 min,吸取10 μL上样,质量分数为15% SDS-PAGE电泳分析,经考马斯亮蓝R250染色,脱色分析.
1.2.4 IPTG对EuCuZnSOD蛋白原核表达的影响 同节1.2.3,挑单菌落,37 ℃振荡培养,转接5瓶,培养至D(600)为0.4,分别添加IPTG至终浓度为0,0.5,1.0,1.5,2.0 mmol·L-1,培养5 h后分别取1 mL菌液,同节1.2.3方法处理,对质量分数为12%的SDS-PAGE电泳分析.
1.2.5 诱导时间对EuCuZnSOD蛋白原核表达的影响 同节1.2.3,挑单菌落,37 ℃和28℃条件下分别振荡培养,转接培养至D(600)为0.4,添加IPTG 1 mmol·L-1,分别培养0,1,2,3,4,5,6 h,每隔1 h取1 mL菌液离心,对质量分数为2% 的SDS-PAGE电泳分析.
1.2.6 NBT法检测SOD蛋白酶活性 同上,挑单菌落摇菌,添加IPTG 1 mmol·L-1,培养至3 h,不含载体的空白菌株平行处理做对照组.超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑(NBT)法,已知活性单位以抑制NBT光化还原的50%为一个酶活性单位表示,SOD活性为
z(SOD)=(AC,K-AE)×16 067V/(1/2×AC,K×W×Vt) .
上式中:z为总活性(nKat);AC,K为对照组管的吸光度;AE为样品管的吸光度;V为样品总体积(mL);Vt为测定时样品用量(mL);W为样品鲜质量(g).
2 结果与分析
2.1 巨尾桉EuCuZnSOD的克隆
用Trizol试剂提取总RNA,反转录成cDNA后,经PCR扩增,获得一条大约500 bp的条带,如图1所示.图1中:M为蛋白Marker.PCR产物与pMD-18T连接,命名为pMD-CSD,SacI/BamHI双酶切验证具有一条500 bp左右的条带,表明连接成功,如图2所示.图2中:M为蛋白Marker.经上海生工生物工程股份有限公司双向测序后,基因序列长度为459 bp,编码152个氨基酸,蛋白相对分子质量为15.2 ku,等电点为6.42.经生物信息学分析(数据未列出),克隆得到的巨尾桉EuCuZnSOD为胞质CuZnSOD,是非跨膜性亲水性稳定非分泌蛋白,无规则卷曲和β-折叠是其蛋白质二级结构的主要元件.
与之前在GenBank中注册成功的一段长为390 bp的mRNA部分序列比对,两片段的相似性是79%,在NCBI中Blast发现:与树棉的细胞质CuZnSOD的相似性最高是90%,申请GenBank注册,基因注册号为JX138573.
2.2 原核表达载体pET-CuZnSOD的构建
采用外源基因原核表达法研究该克隆基因片段的功能.琼脂糖凝胶回收的双酶切EuCuZnSOD片段与pET-32a(+)连接,命名为pET-CuZnSOD,SacI/BamHI双酶切筛选阳性克隆.结果表明:在459 bp处有目的条带,如图3所示.图3中:M为蛋白Marker.由图3可知:EuCuZnSOD原核表达载体构建成功.
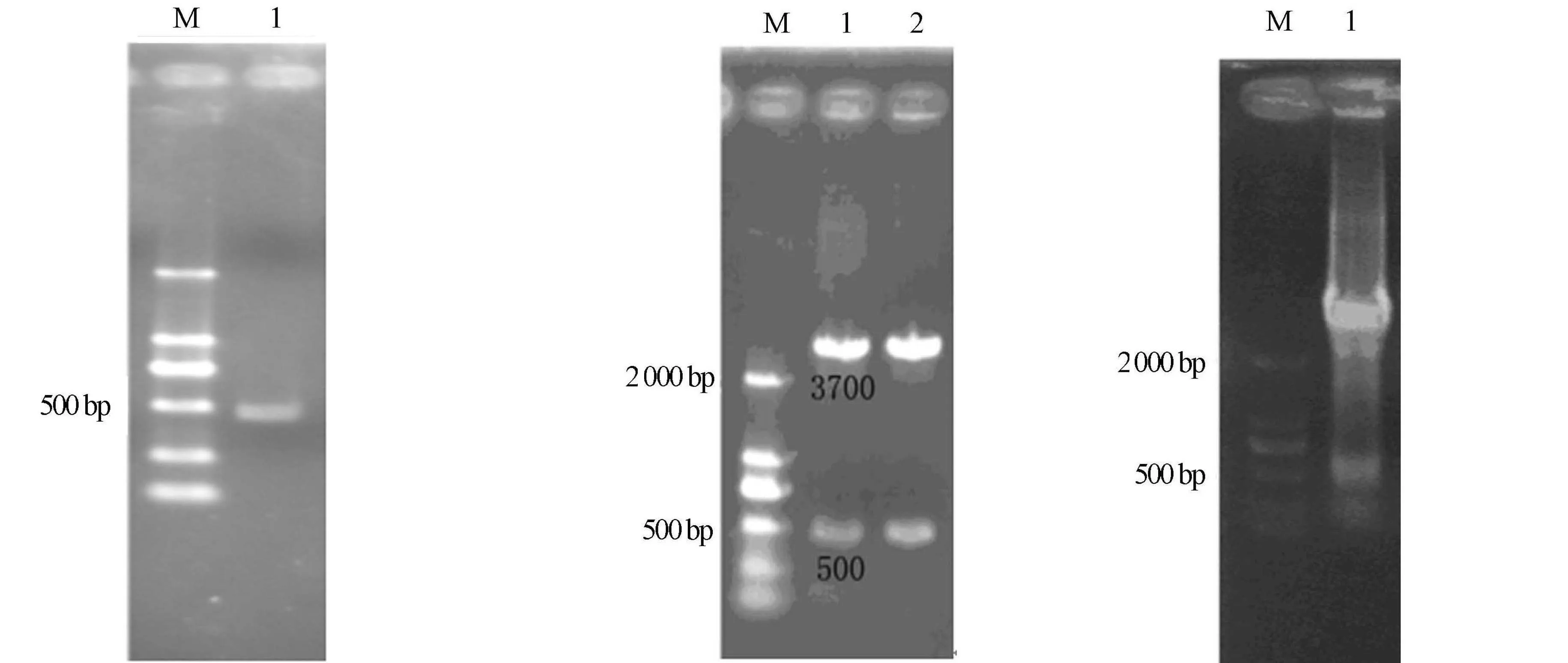
图1 巨尾桉EuCuZnSOD cDNA序列扩增 图2 pMD-CSD SacI/BamHI双酶切电泳图 图3 原核表达载体pET-CuZnSODSac I/BamH I双酶切电泳图
2.3 EuCuZnSOD重组蛋白的表达分析
以含有pET-CuZnSOD的BL21菌株、空菌株和含有质粒pET32a(+)的菌株研究目的蛋白的表达.pET-32a(+)载体的N端部分相对分子质量大约为20 ku,巨尾桉EuCuZnSOD基因完整的阅读框架为459 bp,编码152个氨基酸,理论上可表达为15.2 ku的蛋白,加上表达系统的融合蛋白部分,预期表达产物大约35 ku.实验结果表明:经过1 mmol·L-1的IPTG诱导后,SDS-PAGE图谱显示在蛋白相对分子质量29.0 ku以上有一条明显的蛋白差异带,如图4所示.图4中:M为蛋白Marker;1为未诱导的空菌株;2为诱导的空菌株;3为未诱导的含pET-32a(+)的菌株;4为诱导的含pET-32a(+)的转化菌株;5为未诱导的含pET-CuZnSOD的转化菌株;6为诱导的含pET-CuZnSOD的转化菌株,箭头所示为表达的融合蛋白条带位置.由图4可知:目标蛋白可以在大肠杆菌中表达.
2.4 不同IPTG浓度诱导对重组蛋白EuCuZnSOD表达的影响
通过研究IPTG 0.5~2.0 mmol·L-14个浓度梯度对重组蛋白诱导表达的影响,筛选最佳的IPTG诱导浓度.诱导4 h的EuCuZnSOD蛋白表达量,如图5所示.图5中:M为蛋白Marker;1~5分别为0,0.5,1.0,1.5,2.0 mmol·L-1诱导4 h的蛋白表达;箭头所示为表达的融合蛋白条带.由图5可知:所有浓度的IPTG均诱导出目的蛋白条带,重组蛋白表达量无明显变化,说明0.5~2.0mmol·L-1的IPTG浓度对目的蛋白的表达没有影响.
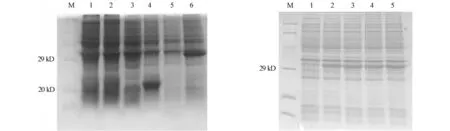
图4 pET-CuZnSOD在E.coli BL21表达的SDS-PAGE电泳图 图5 不同IPTG浓度对重组蛋白EuCuZnSOD表达的影响
2.5 不同培养时间对重组蛋白EuCuZnSOD表达的影响
通过检测重组菌在不同时间表达EuCuZnSOD蛋白量确定最佳诱导时间.37 ℃和28 ℃条件下重组菌在1 h既有蛋白表达,如图6所示.图6中:M为蛋白Marker;1~7分别为0,1,2,3,4,5,6 h诱导的表达蛋白;箭头所示为表达的融合蛋白条带.由图6可知:重组蛋白的37 ℃条件下的最佳诱导时间为3 h,28 ℃条件下在4 h重组蛋白的表达量达到最高水平.
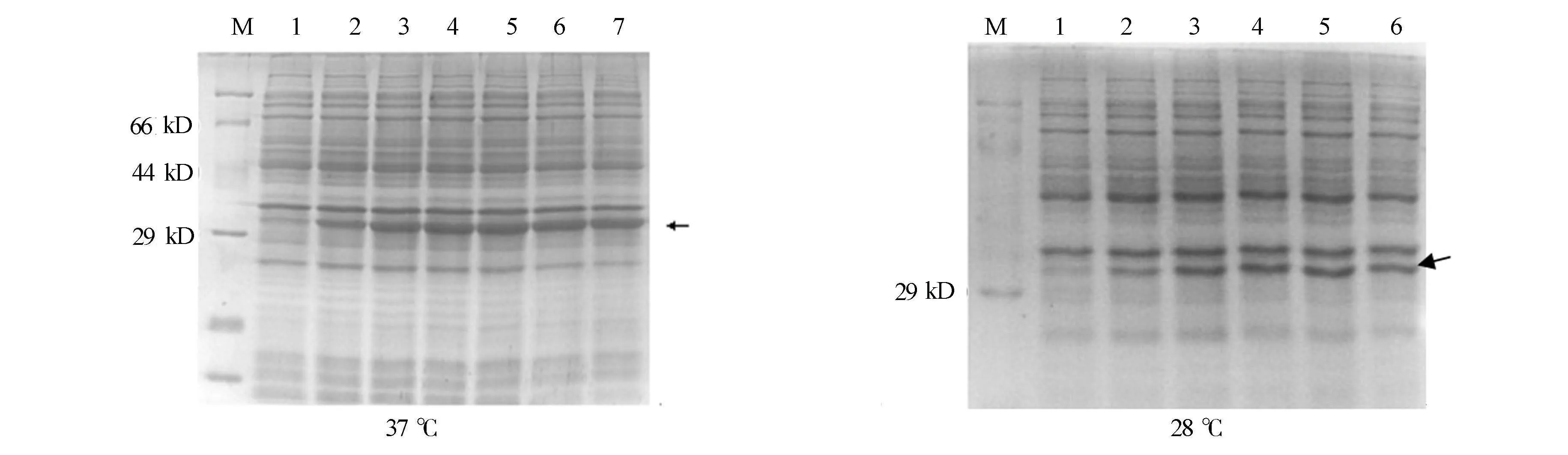
(a) 37 ℃ (b) 28 ℃
2.6 巨尾桉EuCuZnSOD酶活检测
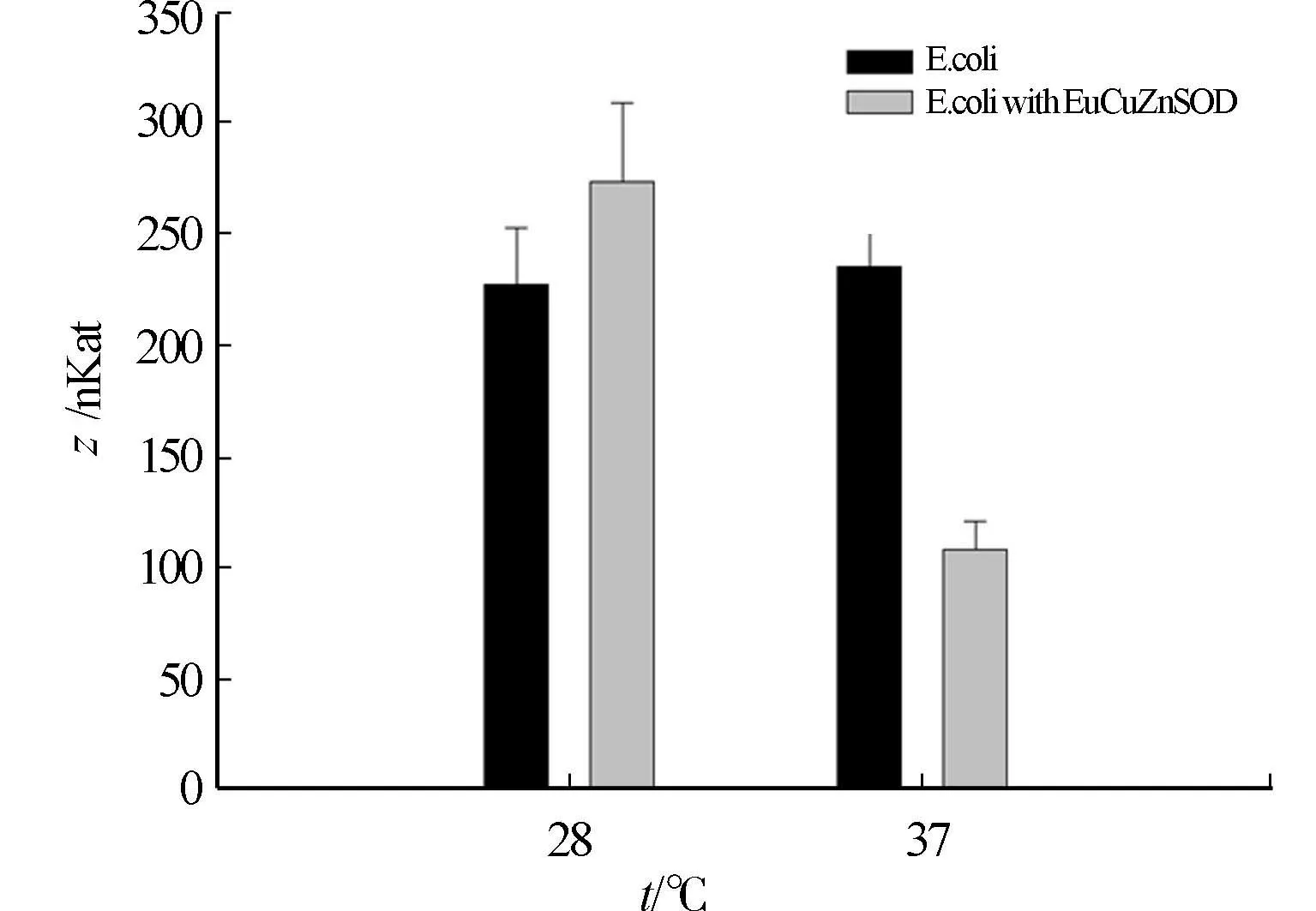
图7 SOD酶活性
因为大肠杆菌具有CuZnSOD酶,酶活性的测定方法是相同的,所以研究采用测定转化菌株总SOD酶活性的变化,验证诱导表达的巨尾桉EuCuZnSOD蛋白是否具有生物学功能.37 ℃培养条件下,转化菌株的SOD总酶活反而比对照组低,可能是表达蛋白在此温度下形成包涵体所致,而包涵体中的蛋白无酶活性,可能也影响了菌株本身的SOD酶活性.培养温度的选择是影响外源基因在大肠杆菌中表达的重要因素之一,外源蛋白大部分以活性存在的诱导温度是25~37 ℃,降低诱导温度,减慢细胞的生长速度,酶蛋白具有足够的时间进行正确的折叠[14-18].实验结果表明:在28 ℃培养条件下,转化菌株的SOD总酶活比对照组平均高19.9%.说明在该温度条件下获得的外源表达产物存在可溶性蛋白,具有一定的酶活性.
3 结束语
成功克隆了巨尾桉的EuCuZnSOD基因,通过原核表达技术证明该基因具有生物学功能,但是该基因在巨尾桉中的时空表达特点以及在不同的胁迫环境下的表达模式需要进一步的研究.通过基因工程手段获得过量表达EuCuZnSOD的桉树植株,可能会提高桉树的抗寒能力以及综合抵抗各种逆境的能力,今后的研究目标和内容是培育出适应范围更广的桉树,为桉树定向培育研究提供物质基础和技术支持.
[1] ABREU I A,CABELLI D E.Superoxide dismutases: A review of the metal associated mechanistic variations[J].Biochimicaet Biophysica Acta,2010,1804(2):263-274.
[2] MAHANTY S,KAUL T,PANDEY P,et al.Biochemical and molecular analyses of copper-zinc superoxide dismutase from a C4 plantPennisetumglaucumreveals an adaptive role in response to oxidative stress[J].Gene,2012,505(2):309-317.
[3] PRASHANTH S R,SADHASIVAM V,PARIDA A.Overexpression of cytosolic copper/zinc superoxide dismutase from a mangrove plantAvicenniamarinainindicarice var Pusa Basmati-1 confers abiotic stress tolerance[J].Transgenic Res,2008,17(2):281-291.
[4] LEE Y P,KIM S H,BANG J W,et al.Enhanced tolerance to oxidative stress in transgenic tobacco plants expressing three antioxidant enzymes in chloroplasts [J].Plant Cell Rep,2007,26(5):591-598.
[5] RODRíGUEZ-Serrano M,ROMERO-PUERTAS M C,PAZMINO D M,et al.Cellular response of pea plants to cadmium toxicity: Cross talk between reactive oxygen species, nitric oxide,and calcium [J].Plant Physiol,2009,150(1):229-243.
[6] HERNáNDEZ-NISTAL J,DOPICO B,LABRADOR E.Cold and salt stress regulates the expression and activity of a chickpea cytosolic Cu/Zn superoxide dismutase[J].Plant Science,2002,163(3):507-514.
[7] FAIZE M,BURGOS L,FAIZE L,et al.Modulation of tobacco bacterial disease resistance using cytosolic ascorbate peroxidase and Cu, Zn-superoxide dismutase[J].Plant Pathology,2012,61(5):858-866.
[8] 邢朝斌,龙月红,李宝财,等.刺五加CuZnSOD的克隆及内生真菌对其表达的影响[J].东北林业大学学报,2013,41(1):82-85.
[9] 吕成群,黄宝灵.低温胁迫对巨尾桉幼苗膜脂过氧化及保护酶的影响[J].广西植物,2004,24(1):64-68.
[10] 刘奕清,李会合,陈泽雄.尾巨桉幼苗对低温胁迫的生理生化反应[J].福建林业科技,2007,34(4):24-26.
[11] 刘友全,刘加林,潘天玲.赤桉在湖南的抗寒与生长适应性[J].中南林学院学报,2000,20(3):86-89.
[12] 刘建.两种桉树对低温胁迫的响应机制研究[D].南京:南京林业大学,2008:28-35.
[13] 朱宁华,李志辉,李芳东.桉树耐寒性与超氧化物歧化酶关系研究[J].中南林学院学报,2000,20(3):63-66.
[14] LIANG Rubing,LIU Xipeng,LIU Jianhua,et al.A T7-expression system under temperature control could create temperature-sensitive phenotype of tar-get gene in Escherichia coli [J].J Microbiol Methods,2007,68(3):497-506.
[15] AKKAPEDDI A S,SHIN D I,STANEK M T,et al.cDNA and derived amino acid sequence of the chloroplastic Copper/Zinc-superoxide dismutase fromAspen(Populustremuloides)[J].Plant Physiol,1994,106(3):1231-1232.
[16] 王芳,董乐,戴聪杰,等.杨梅Cu/Zn 超氧化物歧化酶基因(MrSOD1)cDNA 的克隆及表达分析[J].中国农学通报,2010,26(22):27-33.
[17] 吴军帅,李培环,李鼎立,等.桃果实铜锌超氧化物歧化酶基因PpCuZnSOD的克隆与分析[J].核农学报,2013,27(4):408-417.
[18] 董乐.杨梅铜锌超氧化物歧化酶基因MrCu_Zn_SOD1的原核表达及活性鉴定[J].基因组学与应用生物学,2012,31(4):349-354.
(责任编辑: 陈志贤 英文审校: 刘源岗)
Cloning and Expression of the Cytosolic Copper/Zinc Superoxide Dismutase Gene inEucalyptusgrandis×E.ophylla
ZHAO Yanling, Zhou Lijian
(College of Chemical Engineering, Huaqiao University, Xiamen 361021, China)
Copper Zinc superoxide dismutases are avital antioxidant enzymes that catalyze the disproportionation of superoxide anion to oxygen (O2) and hydrogen peroxide (H2O2) to guard cells against superoxide toxicity. The cytosolicCuZnSODgene was cloned fromEucalyptusgrandis×E.ophylla(GenBank Accession Number: JX138573).The cDNA nucleotide sequence analysis revealed that an open reading frame contains 459 bp nucleotide coding for 152 residues (15.2 ku). The full-length gene is amplified to construct expression vetorpET-CuZnSOD. The Escherichia coli is induced by 1 mmol·L-1IPTG in 28 ℃ for 4 hours and enzyme activity assay result shows that enzyme activity has increased 19.9% than the control in 28 ℃
eucalyptus grandis; copper/Zinc-superoxide dismutases; clone; prokaryotic expression
1000-5013(2015)06-0693-05
10.11830/ISSN.1000-5013.2015.06.0693
2015-01-05
赵艳玲(1978-),女,助理研究员,博士,主要从事植物分子生物学的研究.E-mail:zhaoyl@hqu.edu.cn.
国家自然科学基金资助项目(31300497)
Q 943.2
A
