RNA干扰作用于HIV-1vpr基因的筛选实验研究
2015-02-21龚国忠郑煜煌周华英
张 权,周 泉,何 艳,龚国忠,郑煜煌,周华英,黄 娜
RNA干扰作用于HIV-1vpr基因的筛选实验研究
张 权,周 泉,何 艳,龚国忠,郑煜煌,周华英,黄 娜
目的 筛选鉴定针对HlV-1vpr基因的小干扰RNA(siRNA)片段。方法 根据siRNA设计要求合成siRNA56、siRNA160和siRNA185寡核苷酸片段,分别转染至含HIV-1vpr质粒的HEK 293T细胞,并进行总RNA提取,采用Real-time PCR和Western blotting分别从核酸和蛋白水平对HIV-1vpr基因表达水平进行验证。结果 siRNAs成功转染含HIV-1vpr质粒的HEK 293T细胞,降低了HIV-1vpr基因的表达水平,其中在RNA水平siRNA160组干扰抑制作用最强,抑制率为89%;在蛋白水平siRNA56组干扰抑制作用最强,抑制率为96%。结论 3个基因片段的siRNA均可以下调HIV-1vpr的表达水平,但存在差异性,为探索HIV/AIDS基因治疗的可行性和高效性提供了可靠的实验依据。
RNA干扰;HIV-1;HIV-1vpr基因;HEK293T细胞
张权,周泉,何艳,等.RNA干扰作用于HIV-1vpr基因的筛选实验研究[J].中国全科医学,2015,18(14):1671-1674.[www.chinagp.net]
Zhang Q,Zhou Q,He Y,et al.Screen and identify RNA interference on HIV-1vpr gene[J].Chinese General Practice,2015,18(14):1671-1674.
目前HIV感染者/AIDS患者的主要治疗手段仍是高效抗反转录病毒疗法 (HAART),即通过不同的药物联合抑制HIV感染者体内的病毒载量,改善免疫重建,减少和延缓机会性感染的发生[1],但HAART不能完全清除病毒,且存在治疗费用高、需终身联合服药、毒副作用大及产生耐药突变等缺点[2-3],所以研究者在不断开发新的治疗手段。RNA干扰(RNA interference,RNAi)技术即是近年来在基因治疗领域中的新进展,在抗肿瘤、抗病毒等方面有较好的应用前景。
HIV-1vpr基因属于HIV基因组的4个辅助基因之一,编码一个96氨基酸、14 kDa分子量的碱性vpr辅助蛋白,有促进病毒整合前复合物(PIC)的核运输[4]、调节促进宿主基因转录[5]、反式激活HIV长末端重复序列(LTR)及某些异质启动子[6]、诱导宿主细胞G2/M期的停滞[7]、致感染细胞的凋亡[8]、抑制细胞内pre-mRNA的剪接[9]等多项功能,参与了HIV病毒的多个致病环节和免疫损伤过程。本研究拟针对HIV-1vpr基因设计相关的小RNA分子并进行筛选鉴定,以确定最佳RNAi片段而进行后期研究。
1 材料与方法
1.1 材料 PRNAT-U6.1/Neo-HIV-1vpr质粒由中南大学湘雅二医院感染科研究室制备并保存;HEK293T细胞来自长沙艾佳生物技术有限公司;HIV-1vpr多克隆抗体购自Santa公司;羊抗兔二抗、羊抗鼠二抗均购自Jackson公司;SYBR Green qRCR Mix试剂盒购自TOYOBO公司;Bradford蛋白浓度测定试剂盒、超敏化学发光显色试剂盒购自江苏碧云天生物科技研究所。
1.2 方法
1.2.1 HIV-1vpr及β-actin引物合成 采用Primer 5.0软件设计,并由长沙艾佳生物技术有限公司合成,HIV-1vpr上游引物序列为5′-AAGACCAAGGGCCACAGA-3′,下游引物为5′-CTTCCACTCCTGCCCAAGTA-3′,β-actin上游引物为5′-AGGGGCCGGACTCGTCATACT-3′,下游引物为5′-GGCGGCACCACCATGTACCCT-3′。
1.2.2 小干扰RNA(siRNA)的制备 根据HIV-1vpr序列,遵循siRNA靶序列选择要求选定分别对应HIV-1vpr基因不同位点的3段序列,由Invitrogen公司采用化学合成法合成相应的寡核苷酸片段,其中siRNA56序列为5′-CACUAGAGCUUCUAGAGGAGCUUAA-3′,siRNA160:5′-AUAAACAGCAGUUGUUGCAGAGUUC-3′,siRNA185:5′-UGGGCAGGAGUGGAAGCCAUAAUAA-3′。
1.2.3 siRNAs转染HEK293T细胞 复苏培养HEK293T细胞,以PRNAT-U6.1/Neo-HIV-1vpr质粒转染并培养至对数生长期,以仅含质粒的单纯HEK293T细胞组为对照组,将siRNA56、siRNA160、siRNA185 分别制成siRNA-lipo2000混悬液,室温静置20 min,分别加至含质粒HEK293T细胞的24孔培养板中混合,设为3个实验组,37 ℃、5%CO2的细胞培养箱培养4 h后更换培养液继续培养48 h,荧光显微镜下观察并进行细胞收集,然后分别进行Real-time PCR和Western blotting检测。
1.2.4 细胞总RNA的抽提及Real-time PCR 所收集细胞采用Trizol试剂抽提总RNA,取1 μl进行琼脂糖电泳检测。并以cDNA为模板进行Real-time PCR扩增,扩增引物各1 μl(10 μmol/L),共30 μl反应体系。扩增条件:95 ℃,3 min;95 ℃,10 s;58 ℃,30 s共35个循环,每次在延伸阶段读取荧光值。以仅含质粒的单纯HEK293T细胞组cDNA进行10倍梯度稀释,绘制标准曲线。
1.2.5 Western blotting检测 收集转染细胞裂解样品,Bradford 法测定蛋白质样品浓度,灌制SDS-PAGE凝胶,上样,100 V电泳,至溴酚兰刚跑出玻璃板即终止电泳转胶至PVDF膜,封闭孵育2 h后加入稀释的HIV-1vpr多克隆抗体(1∶500)孵育过夜,倾去一抗后加入稀释的羊抗兔二抗(1∶6 000)孵育1 h,进行X线胶片显影。最后通过膜再生进行内参抗体β-actin孵育和显色并扫描,采用IPP 6.0图像分析软件进行灰度分析。
2 结果
2.1 总RNA样本提取 电泳图显示电泳条带清晰,大小一致(见图1),说明siRNA转染细胞成功。
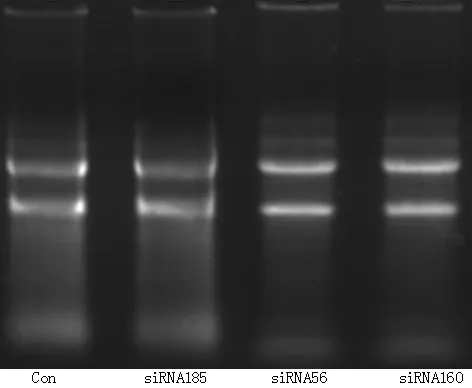
图1 4个样本总RNA提取电泳图
2.2 siRNA对HIV-1vpr的体外干扰作用
2.2.1 Real-time PCR结果 利用Real-time PCR检测各组siRNA干扰效率,对照组cDNA进行10倍梯度稀释,绘制相对标准曲线,采用相对定量的方法对各组进行β-actin基因的内均一化处理,分析siRNA各组中HIV-1vpr基因的相对转录水平。结果显示,与对照组比较,siRNA56组、siRNA160组和siRNA185组HIV-1vpr基因的mRNA水平均明显降低(对照组的2-△△Ct值为1.01,siRNA56组、siRNA160组、siRNA185组分别为0.68、0.11、0.59),其中siRNA56组下降32%,siRNA160组下降89%,siRNA185组下降41%,提示siRNA能有效地下调HIV-1vpr基因的转录水平(见图2)。

图2 Real-time PCR检测siRNA转染后HIV-1vpr基因转录水平
Figure 2 Transcription level of siRNAs transfect HIV-1vpr gene detected by Real-time PCR
2.2.2 Western blotting结果 对照组在转染48 h后可见HIV-1vpr蛋白呈较高水平表达,siRNA56组、siRNA160组和siRNA185组均仅见很弱的蛋白表达条带,根据灰度分析发现siRNA56组HIV-1vpr蛋白表达水平抑制率为96%,siRNA160组、siRNA185组抑制率分别为37%和52%(见图3~4)。
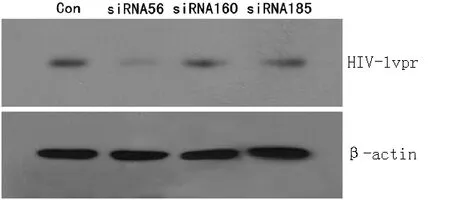
图3 Western blotting检测siRNAs转染后干扰效果

图4 Western blotting检测siRNA转染后HIV-1vpr基因表达水平
Figure 4 Expression levels of siRNAs transfect HIV-1vpr gene detected by Western blotting
3 讨论
3.1 RNAi靶点的选择 RNAi是近年发展起来的可用于抗肿瘤、抗病毒治疗的新技术,而且已有研究证实此技术可以有效应用于HIV的抗病毒治疗,并取得了实质性进展。RNA干扰技术在HIV感染者/AIDS患者治疗方面的研究最初是以HIV-1病毒中编码下列蛋白的基因作为RNAi的靶点:结构蛋白Gag、Env和Pol酶,调控蛋白Tat和Rev,以及2个附属蛋白Nef和Vif[10-12]。研究发现沉默HIV-1的某个基因可以抑制病毒的复制,但不同的基因结果有一定差异。目前针对HIV-1vpr基因的RNA干扰报道较少。由于vpr辅助基因在HIV-1的传播、致病能力和发病机制等诸多方面扮演着重要角色,研究HIV-1vpr的作用可能会进一步揭示AIDS的发病机制,从而为防治AIDS提供新的策略[13]。本研究选择此目的基因作为RNAi的靶点,筛选针对HIV-1vpr基因的有效siRNA片段对HIV-1vpr基因的转录及转录后水平进行沉默,并分别在核酸和蛋白水平进行了验证。
3.2 结果分析 本研究结果显示,与对照组比较,siRNA56组、siRNA160组和siRNA185组HIV-1vpr基因的mRNA水平均明显降低,其中siRNA160组抑制率最高,对靶基因mRNA的降解作用最明显;而在HIV-1vpr蛋白水平siRNA56组干扰抑制效果最强,达96%。本研究mRNA水平与蛋白表达水平不一致,可能是由于mRNA与蛋白在细胞中的表达差异有关,部分转录出来的mRNA可能不参与蛋白翻译或某些蛋白表达量达到一定程度后出现饱和而关闭表达,而蛋白产生和降解的速度比较恒定,短期内两者的变化可能不一致;另一方面,细胞内信号转导是一个网络系统,蛋白表达可能受到其他旁路通道的影响,或存在转录后调控。依此推论,mRNA水平的下调与蛋白水平的下调并非完全呈正相关的关系,其作用机制有待进一步研究。
3.3 展望 本研究通过RNAi技术,应用化学合成的siRNAs寡片段转染HEK293T细胞,研究vpr基因特异性siRNA的基因沉默作用,实现高效导入靶细胞及稳定表达siRNA的目的,筛选可有效抑制vpr基因表达的siRNA序列。目前由于siRNA的分子极性、细胞毒性及t1/2短等因素,在体内的研究受限,为此人们陆续开发了核酸适配子嵌合体、阳离子钛依赖的scFvCD7-9R抗体复合物等来高效介导siRNA转运至胞内从而导致基因沉默[14-15]。但近年来的报道无论针对免疫逃逸、转染效率还是抑制效率,均认为沉默多个病毒基因或联合沉默病毒和宿主基因、相关的多个位点较单纯采用某一个靶点更好,且有进一步研究证实构建多个表达盒的方法较多个表达载体法、含数个dsRNA单元的单个转录法效率更高[16-17]。siRNA对HIV-1vpr基因在体外细胞中的表达有明显抑制效应,这对于阻断HIV侵入宿主细胞及其相互作用有重要启示,为HIV/AIDS抗病毒治疗和预防研究提供理论基础,同时证实了RNAi具备高效、稳定、简单、特异等优势和潜力,有望成为一种具有良好抗HIV-1疗效的新方法。
[1]van Sighem AI,van de Wiel MA,Ghani AC,et al.Motality and progression to AIDS after starting highly active antiretroviral therapy[J].AIDS,2003,15(17):2227-2236.
[2]Gebo KA,Fleishman JA,Conviser R,et al.Contemporary costs of HIV healthcare in the HAART era[J].AIDS,2010,24(17):2705-2715.
[3]Richman DD,Margolis DM,Delaney M,et al.The challenge of finding a cure for HIV infection[J].Science,2009,323(5919):1304-1307.
[4]Takeda E,Murakami T,Matsuda G,et al.Nuclear exportion receptor CAS rugulates the NPI-1-mediated nuclear import of HIV-1 Vpr[J].PloS One,2011,6(11):e27815.
[5]Poon B,Chen IS.Human immunodeficiency virus type 1(HIV-1) Vpr enhances expression from unintegrated HIV-1 DNA[J].J Virol,2003,77(7):3962-3972.
[6]Deshmane SL,Amini S,Sen S,et al.Regulation of the HIV-1 promoter by HIF-1α and Vpr proteins[J].Virol J,2011(8):477.
[7]Hrimech M,Yao XJ,Bachand F,et al.Human immunodeficiency virus type 1(HIV-1) Vpr functions as an immediate-early protein during HIV-1 infection[J].J Virol,1999,73(5):4101-4109.
[8]Stewart SA,Poon B,Jowett JB,et al.Human immunodeficiency virus type 1 Vpr induces apoptosis following cell cycle arrest[J].J Virol,1997,71(7):5579-5592.
[9]Hashizume C,Kuramiteu M,Zhang X,et al.Human immunodeficiency virus type 1 Vpr interacts with spliceosomal protein SAP145 to mediate cellular pre-mRNA splicing inhibition[J].Microbes Infect,2007,9(4):490-497.
[10]Nekhai S,Jerebtsova M.Therapies for HIV with RNAi[J].Curr Opin Mol Ther,2006,8(1):52-61.
[11]Delgado R,Regueiro BJ.The future of HIV infection:gene therapy and RNA interference[J].Enferm infecc Microbiol Clin,2005,23(suppl 2):68-83.
[12]Lee NS,Dohjima T,Bauer G,et al.Expression of small interfering RNAs targeted against HIV-1 rev transcripts in human cells[J].Nat Biotechnol,2002,20(5):500-505.
[13]Zheng YH,Zhang CY,He Y,et al.Effects of different mutated sites in vpr gene of HIV on apoptosis of host cells:experiment with HeLa cells[J].Natl Med J China,2009,89(9):614-619.(in Chinese) 郑煜煌,张春迎,何艳,等.不同变异位点的HIV-1vpr重组真核表达载体对转染细胞凋亡作用的观察[J].中华医学杂志,2009,89(9):614-619.
[14]Zhou J,Rossi JJ.Therapeutic potential of aptamer-siRNA conjugates for treatment of HIV-1[J].Bio Drugs,2012,26(6):393-400.
[15]Kim SS,Subramanya S,Peer D,et al.Antibody-mediated delivery of siRNAs for anti-HIV therapy[J].Methods Mol Biol,2011,721:339-353.
[16]Applegate TL,Birkett DJ,McIntyre GJ,et al.In silico modeling indicates the development of HIV-1 resistance to multiple shRNA gene therapy differs to standard antiretroviral therapy[J].Retrovirology,2010,7:83.
[17]Zhou J,Rossi JJ.Current progress in the development of RNAi-based therapeutics for HIV-1[J].Gene Therapy,2011,18(12):1134-1138.
(本文编辑:赵跃翠)
Screen and Identify RNA Interference on HIV-1vpr Gene
ZHANGQuan,ZHOUQuan,HEYan,etal.
DepartmentofInfectiousDiseases,theSecondXiangyaHospital,CentralSouthUniversity,Changsha410011,China
Objective To screen and identify fragments of siRNA on HIV-1vpr gene.Methods This study designed and synthesized siRNA56,siRNA160 and siRNA185 oligonucleotide fragments according to siRNA design requirements,transfected them into HEK293T cells containing plasmids of HIV-1vpr genes,extracted total RNA and verified HIV-1vpr from levels of nucleic acid and protein by Real-time PCR and Western blotting.Results The siRNA successfully transfected HEK 293T cells containing HIV-1vpr plasmids and reduced the expression of HIV-1vpr genes.The inhibition rate of siRNA160 group was the highest in RNA level (89%) and that of siRNA56 group was the highest in protein level (96%).Conclusion The siRNAs of three gene fragments,which can decrease the expression HIV-1vpr,provide a reliable and efficient experimental basis for exploration of HIV/AIDs gene treatment.
RNA interference;HIV-1;HIV-1vpr gene;HEK293T cell
湖南省科学技术厅科技计划项目(2014SK3097)
410011湖南省长沙市,中南大学湘雅二医院感染科
R 394.114
A
10.3969/j.issn.1007-9572.2015.14.017
2014-11-25;
2015-01-20)
