副猪嗜血杆菌病细菌分离及PCR检测方法的建立与应用
2015-02-20郭蕊
郭蕊
(河北省昌黎县动物疫病预防控制中心,河北昌黎066600)
副猪嗜血杆菌病细菌分离及PCR检测方法的建立与应用
郭蕊
(河北省昌黎县动物疫病预防控制中心,河北昌黎066600)
本病又称为革拉斯病(Glsser Disease),是由副猪嗜血杆菌引起的猪的又一种新的细菌性传染病,以多发性浆膜炎和关节炎为特征,主要表现为发热、咳嗽、呼吸困难、消瘦、跛行、共济失调和被毛粗乱、胸膜炎、肺炎、心包炎、腹膜炎、关节炎和脑膜炎等。也可引起母猪流产、公猪慢性跛行。该病目前呈世界性分布,在我国的发病也呈上升的趋势,造成的经济损失日益严重,但猪副嗜血杆菌病与猪链球菌病、猪传染性胸膜肺炎(嗜血杆菌)等可引起呼吸系统的疾病不易区分,且混感率较高,为该病的诊断带来一定的困难。
副猪嗜血杆菌为革兰氏染色阴性,有荚膜,具有多种不同的形态。该菌生长时严格需要烟酰胺腺嘌呤二核苷酸(NAD或V因子)。流行菌株在TSA平板的菌落呈针尖大小、灰白色、透明。本菌至少有15种血清型,另有大量分离株血清型不可定型,目前在我国的主要流行菌株是4、5、14和15型等,且不同地区不同分离菌株致病力差异较大。14~120日龄的猪均易感,但通常见于5~8周龄的猪发病。发病率 10%~15%,严重时死亡率可达50%~60%。
因此为了保证诊断的准确性,在最短的时间内对猪群进行处理,继而降低经济损失,我们采取细菌分离与PCR结合的方法来对其进行研究。
1 材料
1.1 实验动物
某发病猪场的病猪及送检病、死猪。
1.2 临床症状
发热、食欲不振、厌食、反应迟钝、呼吸困难、咳嗽、疼痛(尖叫)、关节肿胀、跛行、颤抖、共济失调、可视黏膜发绀、侧卧,消瘦和被毛凌乱,随之可能死亡。急性感染后可能留下后遗症,即母猪流产、公猪慢性跛行。肉眼病变主要是全身性浆液性、化脓性、纤维素性炎症,包括心、肺、肝等内脏器官、腹膜、心包膜、胸膜、及其关节表面(图3~6)等,尤其是腕关节和跗关节,出现浆液性和化脓性纤维蛋白渗出物。诊断本病时应注意与链球菌、胸膜肺炎放线杆菌、支原体多发性浆膜炎和关节炎等相区别,本病确诊有赖于细菌学以及分子生物学检查。
2 细菌学检测
2.1 主要试剂与仪器
牛血清、TSA、辅酶I(烟酞胺腺嘌呤二核苷酸NAD)、培养基、培养箱、电子秤、摇床、高速冷冻离心机等。
TSA固体培养基:准确称取胰蛋白大豆琼脂(TSA)40克,加入940毫升蒸馏水,充分摇匀后加热至充分溶解,高压蒸汽灭菌15分钟,加入50毫升过滤除菌的牛血清、10毫升过滤除菌的0.01%NAD,充分摇匀后倒平皿。
2.2 实验方法
无菌采集胸膜、胸腹腔积水、心包积液、关节液等病料,分别接种于自制的TSA固体培养基平板,置于5%~10%CO2中培养,37℃恒温箱培养24~48小时后,检查其在培养基上的生长表现、菌落特征等培养特性,结果显示菌株在TSA平板的菌落呈针尖大小、灰白色、透明(图1),然后纯培养与鉴定。
对培育菌株进行革兰氏染色以及培养后接种于脉酶、氧化酶、接触酶、硝酸盐还原、葡萄糖、蔗糖、果糖、半乳糖、核糖和麦芽糖等微型生化鉴定管等进行生化指标的测定,37℃培养,24~48小时后观察现象。革兰氏染色阴性,多种不同形态的小杆菌(图2)。
将培育菌株划线接种于鲜血琼脂平皿,用纸片法将20种药物进行药敏试验,37℃胚培养24~36小时,观察结果显示:本菌对红霉素、氨基甙类、壮观霉素和林可霉素有抗药性。
3 PCR检测
3.1 主要试剂与仪器
电泳缓冲液TAE、PBS、DNA marker、EB、各种型号移液器及滴头、氯仿以及其他分析纯等。
PCR仪、电泳仪、电子天平、超净工作台、水浴锅、高速低温离心机、高压灭菌锅等。
3.2 实验步骤
将被检菌液12000转/分钟离心5分钟,弃上清液,用无菌水悬浮,涡旋后于沸水中水浴10分钟后,再放置-20℃冻结,然后12000转/分钟离心5分钟,取上清液作为DNA模板。根据副猪嗜血杆菌序列设计引物,由上海生某公司合成。
采用50微升反应体系:上下游引物1.5微升,2.5毫摩尔 dNTPs 4.0微升,Exbuffer 5.0微升,ExTaq酶0.5微升,模板DNA 8.0微升、灭菌双蒸水30微升。反应循环参数:94℃预变性5分钟,94℃变性30秒,58℃退火30秒,72℃延伸40秒,共30循环;最后72℃延伸10分钟,4℃保存。反应结束后用1%琼脂糖凝胶电泳鉴定扩增片段的大小。
1%琼脂糖凝胶的配制:称取3克琼脂糖,加入300毫升lxTAE溶液,微波炉加热至完全溶解。稍微冷却,加入溴化乙锭(EB至终浓度为5微克/毫升),趁热倒入制胶槽,高度约0.5厘米,自然凝固后,小心拔出梳子,将平板放入电泳槽中,加样孔一端朝向阴极。电泳槽内倒入足够的lxTAE溶液,使之正好没过制好的琼脂面。
加样:PCR产物15微升与3微升6x加样缓冲液混合均匀,用微量进样器吸取混合液,Tip头伸入液面以下,对准加样孔,缓慢推出使样品垂直落入加样孔内。电泳:盖上电泳槽电泳40~50分钟,然后在凝胶成像仪中观察结果。
3.3 实验结果
PCR产物经琼脂糖凝胶电泳,获得约822碱基对的特异性片段,与预期结果相符。经序列测定,其序列与目的基因序列一致。

M:DNA Marker;1:目的基因的扩增产物
4 结论
4.1 近年来,该菌在我国猪群普遍存在(感染率呈明显的上升趋势),且临床症状又与链球菌、胸膜肺炎放线杆菌等疾病极其相似不易区分,因此必须要通过细菌分离及PCR检测的方法进行确诊,避免因误诊造成不必要的损失。
4.2 副猪嗜血杆菌抗药性日渐增强也已成为不可忽视的问题,疾病发生的早期,治疗或保健性预防用药效果明显,但一定要选择敏感的抗菌素药物。大多数副猪嗜血杆菌对头孢类抗生素、氟苯尼考、替米考星及喹诺酮类高度敏感,但对一些氨基甙类、壮观霉素和林可霉素有抵抗力,所以说,对猪场副猪嗜血杆菌进行定期的敏感性药物监测,有利于减少经济损失,保证猪群健康。
4.3 副猪嗜血杆菌疫苗是预防该病的最为有效的方法之一,但不同血清型菌株之间的交叉保护率相对较低,因此,疫苗的使用具有一定的区域性和局限性,一定要有血清型的针对性才能取得良好的防疫效果。从当地分离的菌株制备灭活苗,可有效控制副猪嗜血杆菌病的发生。同时做好猪瘟、伪狂犬病、蓝耳病、口蹄疫等预防免疫工作,有利于减少本病的发生。
4.4 同时加强对猪群饲养管理。保证勤打扫,常通风,实行严格的定期消毒制度,特别是冬季一定要做好保温与通风的协调,尽量减少应激。减少或消除其他呼吸道病原,如提前断奶,减少猪群流动,杜绝猪生产各阶段的混养状况等,并在疫病多发季节,在饲料中添加增强体质的药物如:黄芪多糖、电解多维、VC、VE以增强机体抵抗力,减少应激,都可有效增强猪体自身免疫力减少本病的发生。

图1 副猪嗜血杆菌菌落形态

图2 副猪嗜血杆菌形态

图3 心包积液,心脏周围出现纤维素性炎症
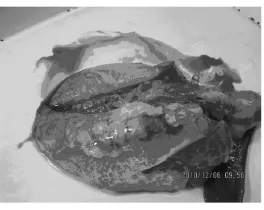
图4 肺脏包膜

图5 肺脏黏连

图6 腹腔出现化浓性炎症
