肝脏特异多器官功能衰竭评分预测乙型肝炎肝硬化急性失代偿患者短期死亡的对比研究*
2015-02-20曾菠,陈柳莹,张楠楠等
肝脏特异多器官功能衰竭评分预测乙型肝炎肝硬化急性失代偿患者短期死亡的对比研究*
曾菠#陈柳莹张楠楠李淑婷杨淑殷尹珊李海&
上海交通大学医学院附属仁济医院消化内科上海市消化疾病研究所(200001)

*基金项目:国家自然科学基金面上项目(30770962、30971333、81170421)
#Email: jiazezengbo@126.com
背景:近年,欧洲提出了非乙型肝炎肝硬化伴急性失代偿(AD)基础上慢加急肝功能衰竭的诊断标准,如慢性肝功能衰竭协会-器官功能衰竭评分(CLIF-C OFs)。目的:评估CLIF-C OFs对乙型肝炎肝硬化伴AD患者短期死亡的预测效能。方法:2005年1月-2010年12月上海仁济医院住院乙型肝炎相关慢性肝病伴AD患者890例纳入研究,264例90 d内接受肝移植术者中95.1%病理诊断为肝硬化。以Kaplan-Meier生存曲线按器官衰竭数量分组分析28 d和90 d累积生存率,以Logistic回归模型分析28 d死亡的影响因素,以ROC曲线比较CLIF-C OFs与终末期肝病模型评分(MELDs)、终末期肝病模型-钠评分(MELD-Nas)、肝功能分级评分(CTPs)对短期死亡的预测效能。结果:乙型肝炎肝硬化伴AD患者28 d和90 d累积生存率与器官衰竭数量密切相关(P<0.001)。血清总胆红素、血清肌酐、肝性脑病和白细胞是患者28 d死亡的独立危险因素。CLIF-C OFs预测28 d死亡的ROC曲线下面积为0.813±0.021,最佳临界值为8,相应敏感性、特异性、阳性预测值、阳性似然比分别为84.3%、64.9%、31.9%和2.4,预测效能与MELDs和MELD-Nas相似。结论:CLIF-C OFs能较好地预测乙型肝炎肝硬化伴AD患者的短期死亡,可应用于临床实践。
关键词乙型肝炎,慢性;肝硬化;急性失代偿;多器官功能衰竭;死亡率
肝硬化伴急性恶化患者表现为多器官功能衰竭,需重症监护治疗且死亡率高,美国每例患者平均需支出116 200美元[1-2]。研究证实肝硬化患者出现器官功能衰竭预示预后不良[3-5]。目前肝硬化失代偿患者的预后模型主要有两大类:①反映肝脏疾病本身严重程度的评分系统,如肝功能分级评分(Child-Turcotte-Pugh, CTPs)、终末期肝 病模型评分(Model of End-stage Liver Disease, MELDs)、终末期肝病模型-钠评分(MELD-Sodium score,MELD-Nas);②反映多器官功能衰竭的评分系统,如急性生理、年龄和慢性健康评估系统Ⅲ(the Acute Physiology, Age and Chronic Health Evaluation Ⅲ, APACHEⅢ)、序贯性器官功能衰竭评估(Sequential Organ Failure Assess-ment, SOFA)。近年,欧洲肝病研究学会-慢性肝功能衰竭联盟对非乙型肝炎肝硬化伴急性失代偿(acute decompensation, AD)患者进行前瞻性、多中心研究,提出了肝脏特异多器官功能衰竭评分,即慢性肝功能衰竭-序贯性器官功能衰竭评分(Chronic Liver Failure-Sequential Organ Failure Assessment score, CLIF-SOFAs)及其简化版本慢性肝功能衰竭协会-器官功能衰竭评分(Chronic Liver Failure-Consortium Organ Failure score, CLIF-C OFs),用于诊断非乙型肝炎肝硬化伴AD基础上发生的慢加急肝功能衰竭(acute-on-chronic liver failure, ACLF)[6-7]。本研究通过比较CLIF-C OFs与其他肝病预后模型,评估CLIF-C OFs对乙型肝炎肝硬化伴AD患者短期死亡的预测效能,以明确CLIF-C OFs能否作为这类患者新的短期预后指标。
对象与方法
一、研究对象
2005年1月1日至2010年12月31日上海交通大学医学院附属仁济医院住院乙型肝炎相关慢性肝病伴AD患者890例纳入研究。纳入标准:①HBsAg持续阳性>6个月,明确为乙型肝炎相关慢性肝病;②入院前1个月有AD,表现为腹水、肝性脑病、食管胃底静脉曲张破裂出血、感染(包括肺部感染、泌尿系统感染、自发性细菌性腹膜炎、菌血症或脓毒血症、皮肤或软组织感染等)。排除标准:①年龄<15周岁或≥80周岁;②妊娠期女性;③恶性肿瘤;④存在严重的其他器官/系统慢性疾病。810例(91.0%)患者经CT、MRI或结合临床症状、体征、实验室检查证实有门静脉高压表现,诊断为肝硬化,264例(29.7%)患者于入院后90 d内接受肝移植术,其中251例(95.1%)病理诊断为肝硬化。研究方案经医院医学伦理委员会核准,符合世界医学协会赫尔辛基宣言。
二、资料收集
通过查阅病史或查询医院电子数据库,收集入组患者以下临床资料:性别、年龄、慢性肝病病因、既往失代偿史、入院原因、抗病毒用药史等;实验室检查数据包括HBV 5项血清标记物和HBV-DNA载量。采集时间点为入院时、住院第28天或出院前或肝移植术前。通过查阅病史或电话随访获得28 d、90 d、6个月和1年生存情况。死亡率以无移植死亡率表示,即将接受肝移植术的患者视为失访。
三、CLIF-C OFs定义
CLIF-C OFs是在CLIF-SOFAs基础上的简化,以便于临床应用[7]。六大器官/系统功能衰竭的诊断标准包括:①肝脏:血清总胆红素(serum total bilirubin, TB)≥205 μmol/L(12 mg/dL);②肾脏:血清肌酐(serum creatinine, Cr)≥177 μmol/L(2 mg/dL )或肾脏替代治疗;③神经系统:肝性脑病Ⅲ~Ⅳ级;④凝血系统:国际标准化比(inter-national normalized ratio, INR)≥2.5;⑤呼吸系统:氧合指数≤200 mm Hg或脉搏氧分压/吸入氧浓度≤214 mm Hg;⑥循环系统:使用血管收缩剂以维持血压。
四、统计学分析
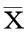
结果
一、入院时特征
890例入组乙型肝炎相关慢性肝病伴AD患者中男683例(76.7%),女207例(23.3%),平均年龄(50.0±11.2)岁,仅83例(9.3%)患者合并酒精性肝病、血吸虫病性肝病或其他嗜肝病毒感染,490例(55.1%)患者既往有失代偿史。入院原因主要为腹水(506例,56.9%),其次为食管胃底静脉曲张破裂出血、肝性脑病和感染。入院前6个月内仅209例(23.5%)患者服用核苷类抗病毒药物,259例(29.1%)患者HBeAg阳性,仅157例(17.6%)患者HBV得到抑制(HBV-DNA≤500拷贝/mL) 。
二、28 d和90 d累积生存率
本组患者28 d、90 d、6个月和1年死亡率分别为16.5%、19.9%、21.0%和22.9%。图1显示,无器官衰竭、1个、2个和≥3个器官衰竭患者的28 d累积生存率分别为98.1%、87.0%、51.2%和39.5%,90 d累积生存率分别为94.5%、76.3%、40.0%和30.7%。四组间28 d和90 d累积生存率两两比较差异均有统计学意义(P均<0.001),表明累积生存率与器官衰竭数量密切相关。
OF:器官衰竭(organ failure)
三、28 d死亡影响因素
采用入院时临床数据比较28 d死亡和存活患者的临床特征(单因素分析),死亡组六大器官/系统功能衰竭率均显著高于存活组,最常见的衰竭器官/系统为肝脏(70.1%),其后依次为凝血系统(52.4%)、肾脏(29.3%)、神经系统(15.6%)、循环系统(8.8%)和呼吸系统(5.4%);死亡组血小板(platelet, PLT)、TB、ALT、AST、Cr、INR、白细胞亦显著高于存活组,血钠则显著低于存活组。性别、年龄、失代偿史、腹水、平均动脉压对28 d死亡无明显影响,两组间入院前6个月内接受核苷类抗病毒药物治疗率和HBV-DNA载量差异亦无统计学意义(表1)。
将单因素分析显示差异有统计学意义的变量纳入多因素Logistic回归模型,结果显示TB(OR: 1.047, 95% CI: 1.033~1.061,P=0.001)、Cr(OR: 1.621, 95% CI: 1.278~2.056,P<0.001)、肝性脑病(OR: 1.307, 95% CI: 1.069~1.597,P=0.009)、白细胞(OR: 1.070, 95% CI: 1.023~1.119,P=0.003)为乙型肝炎相关慢性肝病伴AD患者28 d死亡的独立危险因素(表2)。
四、CLIF-C OFs预测短期死亡的效能
28 d死亡组CLIF-C OFs、MELDs、MELD-Nas和CTPs评分均高于存活组,差异有统计学意义(表1)。图2为各预后模型预测28 d死亡的ROC曲线,CLIF-C OFs、MELDs、MELD-Nas、CTPs的AUROC分别为0.813±0.021、0.809±0.021、0.812±0.020和0.750±0.024,CLIF-C OFs与MELDs(P=0.711)、CLIF-C OFs与MELD-Nas(P=0.938)、MELDs与MELD-Nas(P=0.638)相比差异均无统计学意义;CTPs的AUROC最小,与CLIF-C OFs(P=0.000 2)、MELDs (P<0.000 1)、MELD-Nas(P<0.000 1)相比差异均有统计学意义。
根据ROC曲线选取最佳临界值预测28 d死亡,各预后模型的最佳临界值和相应敏感性、特异性、阳性预测值、阴性预测值、阳性似然比、阴性似然比见表3。4个预后模型中,CLIF-C OFs敏感性最高但特异性较低,各项ROC参数与MELD-Nas相似;MELDs的阳性似然比最高;CTPs的总体预测效能弱于其他3个预后模型。
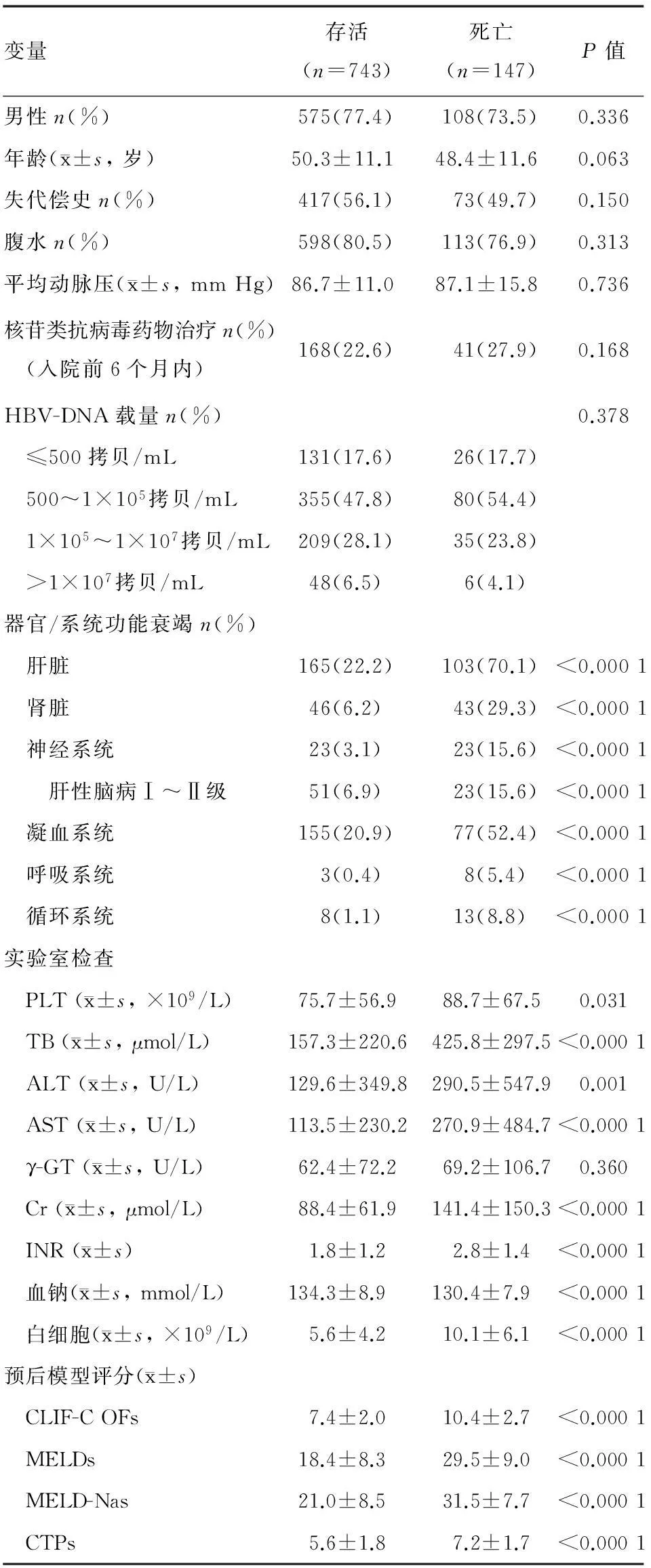
表1 28 d死亡影响因素的单因素分析
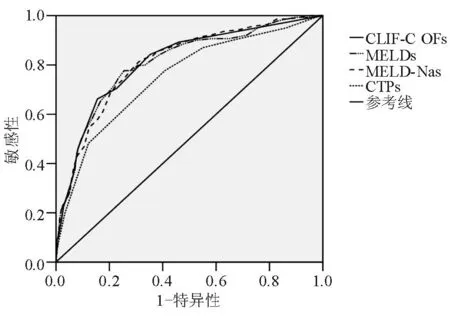
图2 各预后模型预测28 d死亡的ROC曲线
各预后模型预测90 d死亡的效能与28 d相似(图3、表3),CLIF-C OFs、MELDs、MELD-Nas、CTPs的AUROC分别为0.799±0.018、0.785±0.018、0.796±0.017和0.726±0.021,CLIF-C OFs与MELDs(P=0.114)、CLIF-C OFs与MELD-Nas(P=0.725)、MELDs 与MELD-Nas(P=0.075)相比差异均无统计学意义;CTPs的AUROC最小,与CLIF-C OFs、MELDs、MELD-Nas相比差异均有统计学意义(P均<0.000 1)。
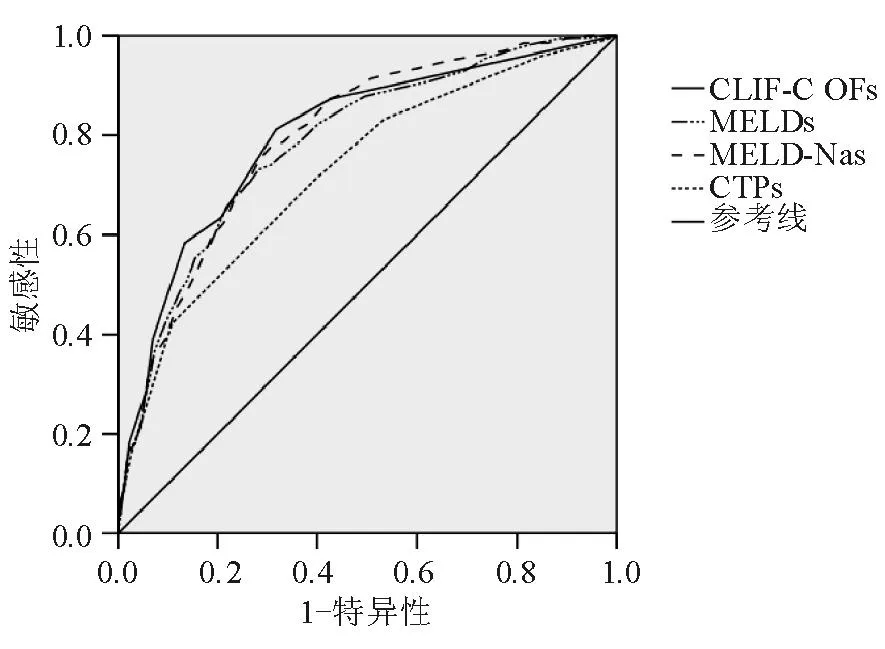
图3 各预后模型预测90 d死亡的ROC曲线
讨论
本研究初步探讨了乙型肝炎相关慢性肝病伴AD患者短期死亡的影响因素以及CLIF-C OFs对短期死亡的预测效能。鉴于本组近30%的患者接受肝移植术,术后病理显示肝硬化率高达95%,因此认为本组人群可作为乙型肝炎肝硬化伴AD人群进行研究。
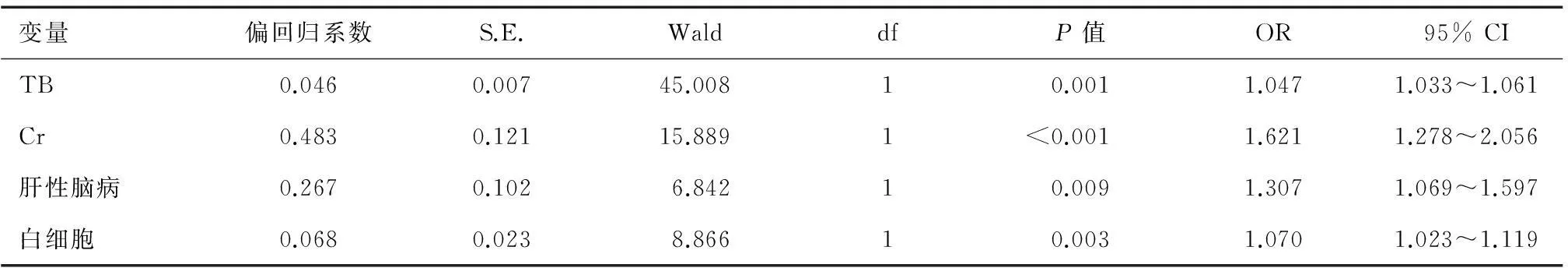
表2 28 d死亡影响因素的Logistic回归分析
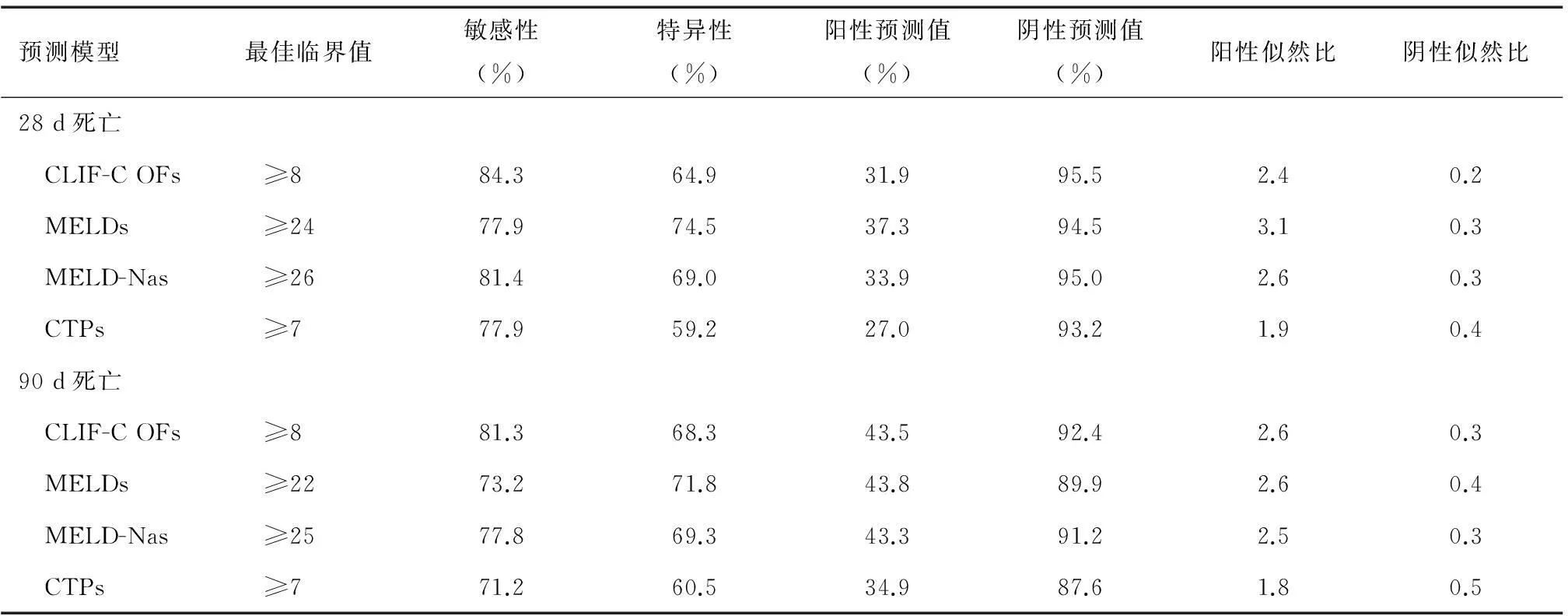
表3 各预后模型预测28 d和90 d死亡的最佳临界值和相应ROC参数
本组患者的28 d和90 d死亡率分别为16.5%和19.9%,6个月和1年死亡率分别为21.0%和22.9%,可见患者死亡主要发生于90 d内,其后不再随时间延长而明显增加。累积生存率分析显示患者死亡率随器官衰竭数量的增多而明显增高,与欧洲前瞻性、多中心研究结果一致[6]。因此可根据CLIF-C OFs中的六大器官/系统功能衰竭数量,将乙型肝炎肝硬化伴AD人群区分为不同预后群体。由于CLIF-C OFs与CLIF-SOFAs相比更为简易,便于临床应用,故本研究采用CLIF-C OFs预测患者预后。新近有印度研究小组根据器官衰竭数量评分(0~6分)对ACLF患者的入院死亡率进行预测,发现该模型预测效能良好[9]。因此,根据器官/系统功能衰竭数量建立的CLIF-C OFs可能更适用于乙型肝炎肝硬化伴AD患者。
进一步分析本组患者28 d死亡的影响因素,发现死亡组六大器官/系统功能衰竭率均显著高于存活组,其中最常见的是肝功能衰竭,而欧洲最常见的是肾功能衰竭[6,10],此种差异可能与不同研究入组患者的病因不同有关。本组患者90.7%为单纯HBV感染,分析显示28 d死亡组与存活组间HBV-DNA载量差异并无统计学意义。有报道显示,只有长期服用核苷类抗病毒药物抑制HBV复制,才能显著降低相应并发症发生率[11]。而本组患者服用核苷类抗病毒药物的比率较低,仅为23.5%,仅少数患者(17.6%)HBV得到抑制,因此患者的临床进展和死亡可能更多取决于器官衰竭数量。然而死亡组ALT、AST均显著高于存活组,表明死亡组肝损伤更 为严重。HBV复制可造成肝损伤,但两组间HBV-DNA载量差异并无统计学意义。鉴于HBV可能在造成肝损伤后又恢复至原来的水平,因此尚不能排除HBV对患者肝脏造成的影响。多因素Logistic回归分析显示,肝脏、肾脏、神经系统功能衰竭指标TB、Cr、肝性脑病以及炎症指标白细胞为28 d死亡的独立危险因素。既往研究表明肝硬化患者出现器官功能衰竭预示预后不良[3-5],而细菌感染在肝硬化患者中很常见,是肝功能衰竭进展、出现并发症甚至死亡的重要原因之一[12-13],与本研究多因素分析结果一致。有研究[14]显示,对于合并感染的肝硬化失代偿患者,≥2个器官衰竭预示预后不良。
本研究中,28 d死亡组CLIF-C OFs、MELDs、MELD-Nas和CTPs评分均显著高于存活组。CLIF-C OFs预测28 d死亡的AUROC与MELDs、MELD-Nas相比差异无统计学意义,但三者均显著优于CTPs。CANONIC研究小组指出,CLIF-SOFAs预测28 d死亡的准确性与MELDs相似,但优于CTPs[6];新近一项分析重症监护室肝硬化患者6个月死亡率的研究[15]表明,CLIF-SOFAs的准确性优于CTPs;印度一项针对肝硬化伴AD患者的研究[16]结果同样与本研究相似。根据ROC曲线,CLIF-C OFs预测28 d死亡的最佳临界值为8,敏感性(84.3%)高于MELD-Nas、MELDs和CTPs,但特异性(64.9%)和阳性似然比(2.4)仅高于CTPs。各预后模型阳性预测值均较低,该指标主要受患病率影响,本组患者28 d死亡率较低,为16.5%,阳性预测值偏低可能与此有关。不受患病率影响的阳性似然比在CLIF-C OFs、MELDs、MELD-Nas分别为2.4、3.1和2.6,均优于CTPs(1.9)。各预后模型预测90 d死亡的效能与28 d相似。因此,CLIF-C OFs、MELDs和MELD-Nas预测乙型肝炎肝硬化伴AD患者短期死亡的效能优于CTPs。
综上所述,本研究表明基于非乙型肝炎肝硬化的CLIF-C OFs能较好地预测乙型肝炎肝硬化伴AD患者的短期死亡,可应用于临床实践,从而及时鉴别高死亡风险患者,积极治疗以改善预后。
参考文献
1 Olson JC, Wendon JA, Kramer DJ, et al. Intensive care of the patient with cirrhosis[J]. Hepatology, 2011, 54 (5): 1864-1872.
2 Jalan R, Gines P, Olson JC, et al. Acute-on chronic liver failure[J]. J Hepatol, 2012, 57 (6): 1336-1348.
3 Arabi Y, Ahmed QA, Haddad S, et al. Outcome predictors of cirrhosis patients admitted to the intensive care unit[J]. Eur J Gastroenterol Hepatol, 2004, 16 (3): 333-339.
4 O’Brien AJ, Welch CA, Singer M, et al. Prevalence and outcome of cirrhosis patients admitted to UK intensive care: a comparison against dialysis-dependent chronic renal failure patients[J]. Intensive Care Med, 2012, 38 (6): 991-1000.
5 Levesque E, Saliba F, Ichai P, et al. Outcome of patients with cirrhosis requiring mechanical ventilation in ICU[J]. J Hepatol, 2014, 60 (3): 570-578.
6 Moreau R, Jalan R, Gines P, et al; CANONIC Study Investigators of the EASL-CLIF Consortium. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis[J]. Gastroenterology, 2013, 144 (7): 1426-1437.
7 Jalan R, Saliba F, Pavesi M, et al. Development and validation of a prognostic score to predict mortality in patients with acute-on-chronic liver failure[J]. J Hepatol, 2014, 61 (5): 1038-1047.
8 DeLong ER, DeLong DM, Clarke-Pearson DL. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach[J]. Biometrics, 1988, 44 (3): 837-845.
9 Agrawal S, Duseja A, Gupta T, et al. Simple organ failure count versus CANONIC grading system for predicting mortality in acute-on-chronic liver failure[J]. J Gastroenterol Hepatol, 2015, 30 (3): 575-581.
10McPhail MJ, Shawcross DL, Abeles RD, et al. Increased Survival for Patients With Cirrhosis and Organ Failure in Liver Intensive Care and Validation of the Chronic Liver Failure-Sequential Organ Failure Scoring System[J]. Clin Gastroenterol Hepatol, 2014, pii: S1542-3565(14)01347-0. [Epub ahead of print]
11Niro GA, Ippolito AM, Fontana R, et al. Long-term outcome of hepatitis B virus-related Chronic Hepatitis under protracted nucleos(t)ide analogues[J]. J Viral Hepat, 2013, 20 (7): 502-509.
12Jalan R, Fernandez J, Wiest R, et al. Bacterial infections in cirrhosis: a position statement based on the EASL Special Conference 2013[J]. J Hepatol, 2014, 60 (6): 1310-1324.
13Bajaj JS, O’Leary JG, Reddy KR, et al. Second infections independently increase mortality in hospitalized patients with cirrhosis: the North American consortium for the study of end-stage liver disease (NACSELD) experience[J]. Hepatology, 2012, 56 (6): 2328-2335.
14Bajaj JS, O’Leary JG, Reddy KR, et al. Survival in infection-related acute-on-chronic liver failure is defined by extrahepatic organ failures[J]. Hepatology, 2014, 60 (1): 250-256.
15Pan HC, Jenq CC, Tsai MH, et al. Scoring systems for 6-month mortality in critically ill cirrhotic patients: a prospective analysis of chronic liver failure - sequential organ failure assessment score (CLIF-SOFA)[J]. Aliment Pharmacol Ther, 2014, 40 (9): 1056-1065.
16Dhiman RK, Agrawal S, Gupta T, et al. Chronic Liver Failure-Sequential Organ Failure Assessment is better than the Asia-Pacific Association for the Study of Liver criteria for defining acute-on-chronic liver failure and predicting outcome[J]. World J Gastroenterol, 2014, 20 (40): 14934-14941.
(2015-01-15收稿;2015-01-23修回)
·论著·
Comparative Study on Liver Specific Multiple Organ Failure Score in Predicting Short-term Mortality for HBV-related Cirrhosis Patients with Acute DecompensationZENGBo,CHENLiuying,ZHANGNannan,LIShuting,YANGShuyin,YINShan,LIHai.DivisionofGastroenterologyandHepatology,RenJiHospital,SchoolofMedicine,ShanghaiJiaoTongUniversity;ShanghaiInstituteofDigestiveDisease,Shanghai(200001)
Correspondence to: LI Hai, Email: haili_17@126.com
Background: Recently the European consortium proposed a diagnostic criteria for acute-on-chronic liver failure in patients with acute decompensation (AD) of non-HBV-related cirrhosis, i.e., Chronic Liver Failure-Consortium Organ Failure score (CLIF-C OFs). Aims: To assess the performance of CLIF-C OFs in predicting short-term mortality for HBV-related cirrhosis patients with AD. Methods: A total of 890 hospitalized HBV-related chronic liver disease patients with AD from Jan. 2005 to Dec. 2010 in Shanghai Ren Ji Hospital were enrolled. Of them, 264 patients received liver transplantation within 90 days and 95.1% were pathologically diagnosed as cirrhosis. Kaplan-Meier survival curve was used to analyze the 28-day and 90-day cumulative survival rates in patients stratified by amount of organ failure. Logistic regression model was applied to analyze the factors associated with 28-day mortality. ROC curve was used to compare the performance of CLIF-C OFs in predicting short-term mortality with Model of End-stage Liver Disease (MELDs), MELD-Sodium score (MELD-Nas), and Child-Turcotte-Pugh (CTPs). Results: Cumulative survival rates of 28-day and 90-day for HBV-related cirrhosis patients with AD were closely related with the amount of organ failure (P<0.001). Serum total bilirubin, serum creatinine, hepatic encephalopathy and white blood cell were independent risk factors for 28-day mortality. Area under ROC curve of CLIF-C OFs for predicting 28-day mortality was 0.813±0.021 and the optimal cut-off value was 8, with the sensitivity, specificity, positive predictive value, and positive likelihood ratio being 84.3%, 64.9%, 31.9% and 2.4, respectively. The predictive performance of CLIF-C OFs was similar to MELDs and MELD-Nas. Conclusions: CLIF-C OFs is a good predictor of short-term mortality for HBV-related cirrhosis patients with AD, and is worthy of being used in clinical practice.
Key wordsHepatitis B, Chronic;Liver Cirrhosis;Acute Decompensation;Multiple Organ Failure;Mortality
通信作者&本文,Email: haili17@126.com
DOI:10.3969/j.issn.1008-7125.2015.05.002
