大鼠局灶性脑缺血后神经营养因子表达的自然变化
2015-02-19苗常青鹏侯李晓青
刘 鹏 王 瑾 苗常青 刘 玥 唐 鹏侯 辰 张 欣 种 莉 李晓青 李 锐
710068 西安,陕西省人民医院老年神经内科[刘 鹏 刘 玥 唐 鹏 侯 辰 张 欣 种 莉 李晓青 李 锐(通信作者)];西安交通大学医学院第一附属医院神经内科(王 瑾 苗常青)
大鼠局灶性脑缺血后神经营养因子表达的自然变化
刘鹏王瑾苗常青刘玥唐鹏侯辰张欣种莉李晓青李锐
710068西安,陕西省人民医院老年神经内科[刘鹏刘玥唐鹏侯辰张欣种莉李晓青李锐(通信作者)];西安交通大学医学院第一附属医院神经内科(王瑾苗常青)
缺血性脑血管病严重危害人类健康,具有较高发病率,较高致残率,较高复发率的特点[1]。近年来,关于缺血性脑损害过程的研究表明,神经营养因子对于促进缺血灶周围和对侧正常脑组织的神经突起新生和新突触形成及神经功能重塑等具有明显促进作用[2]。故在缺血性脑血管病发生时,神经营养因子对缺血半暗带的保护显得尤为重要。大量的基础和临床研究都尝试找到一种有效的外源性神经营养因子,那么脑缺血本身会不会刺激大脑产生神经营养因子而产生自身保护呢?本研究通过复制大鼠大脑中动脉闭塞模型,观察局灶性脑缺血后大鼠神经行为、梗死体积、组织形态及缺血半暗带神经生长因子(nerve growth factor,NGF)、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)的表达水平变化,明确有无这种自身保护机制的存在。
1材料与方法
1.1实验动物与分组
健康雄性SD大鼠24 只,5~7 月龄,体重250~310 g,由西安交通大学医学院实验动物中心提供,随机分为2组,每组12只:Ⅰ组(假手术组);Ⅱ组(脑缺血组)。自由进食,食标准颗粒饲料,饮自来水。
1.2动物模型制作及神经功能评分标准
参照改良的Longa等右侧颈内动脉尼龙线线栓法[3]行左侧颈内动脉尼龙线线栓法制作动物模型。栓线不予拔出,不制备再灌注模型。假手术组仅不行血管内栓线,余同模型组。造模成功标准:大鼠麻醉清醒后参考Bederson等的方法[4]进行评分(采用双盲法,即由有相关专业知识的人员在不知大鼠分组的情况下观察),即0分为无神经系统症状;1分为不能完全伸展对侧前爪;2分为爬行时转圈;3分为向对侧倾倒;4分为不能自行行走,意识丧失。以1~3分为造模成功入选标准。并于处死大鼠前再次根据此标准观察并记录神经功能评分。
1.3试剂
兔抗大鼠NGF、兔抗大鼠BDNF、即用型SABC试剂盒、DAB显色试剂盒、正常山羊血清均由武汉博士德公司提供。
1.4分组处理
各组在术后48 h断头取脑。每只大鼠处死前行神经功能评分,然后每组取其中6只用于做氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)染色,其余6只做脑组织切片HE染色和免疫组织化学染色。
1.5TTC染色、梗死体积计算
麻醉后断头处死,取出鼠脑,置于-20 ℃冰箱冻存5 min;取出后放入特制鼠脑槽中,去除嗅球、小脑和低位脑干,其余部分从额极向后作冠状位切片,片厚2 mm,共5~6片,每隔2 mm切一片;脑片迅速置于2 %TTC溶液中,避光,37 ℃温孵30 min后取出脑片,按顺序排列,用数码相机照相并输入计算机,利用图象处理软件AutoCAD分别计算出各个脑片缺血侧的总体积和梗死区域的体积,再求出梗死区域占大脑半球总体积的百分比作为梗死体积。
1.6脑组织切片的制作
麻醉后用0.9 %氯化钠溶液和多聚甲醛进行心脏灌注固定,断头取脑。在左侧大脑半球距嗅球尖端7~11 mm之间冠状位切取约5 mm厚脑组织块,固定、脱水、包埋成腊块,连续切片,片厚5 μm。每只大鼠连续取3张切片, 1张用于HE染色, 2张用于免疫组化染色。
1.7脑组织病理学及NGF、BDNF免疫组化染色
取各组鼠脑切片行常规HE染色及NGF/BDNF免疫组化染色。假手术组应用图像信号采集与分析系统,光镜下随机计数左侧大脑皮质5个不重叠视野(×400倍)下NGF、BDNF阳性神经元数并求均数,其余各组分别随机计数缺血侧梗死灶边缘区5个不重叠视野(×400倍)下NGF、BDNF阳性神经元数并求均数。同时观察各组脑组织病理学变化。
1.8统计学处理
2结果
2.1各组大鼠神经功能评分
Ⅰ组(假手术组)大鼠行为无异常。Ⅱ组(脑缺血组)大鼠表现出不同程度的运动功能障碍,提鼠尾可见其右前肢收紧贴胸壁,右侧肢体肌力下降,爬行时偏向右侧打圈,甚至向右侧倾倒(表1)。
2.2各组大鼠脑梗死体积的比较见表2,图1。
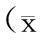
表2 各组大鼠脑梗死体积比较±s)
2.3各组大鼠脑组织形态学变化
Ⅰ组(假手术组):细胞层次清晰,排列紧密,细胞结构、形态正常,神经细胞胞浆、核染色均匀,核仁清楚,核膜完整,间质内未见出血、坏死及水肿;Ⅱ组(脑缺血组):左侧大脑缺血范围内可见皮质及纹状体有片状坏死,少量神经元残存,细胞排列松散,形态不规则,神经细胞与细胞周围间质分离,细胞深染固缩,胞浆尼氏体消失,胞核固缩,核仁消失(图2)。

图1 各组大鼠脑片TTC染色 Ⅰ组(假手术组)经TTC染色后脑片全红;Ⅱ组(脑缺血组)大鼠左侧额顶叶皮质及纹状体可见不同程度的白色梗死灶
2.4各组大鼠大脑皮层缺血半暗带NGF、BDNF表达水平变化。
NGF和BDNF免疫阳性细胞在大鼠脑内有较广泛的分布。NGF阳性反应物主要位于胞浆和突起内,均质致密点状。BDNF阳性反应物亦主要位于胞浆和突起内,在个别细胞内阳性反应物也可位于胞核内。NGF和BDNF阳性反应物均呈棕黄色颗粒。Ⅰ组(假手术组)大脑皮层NGF和BDNF分布如常(图3~4)。
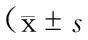
表3 各组大鼠脑NGF、BDNF阳性神经元数的比较
注:与Ⅰ组比较,*P<0.05
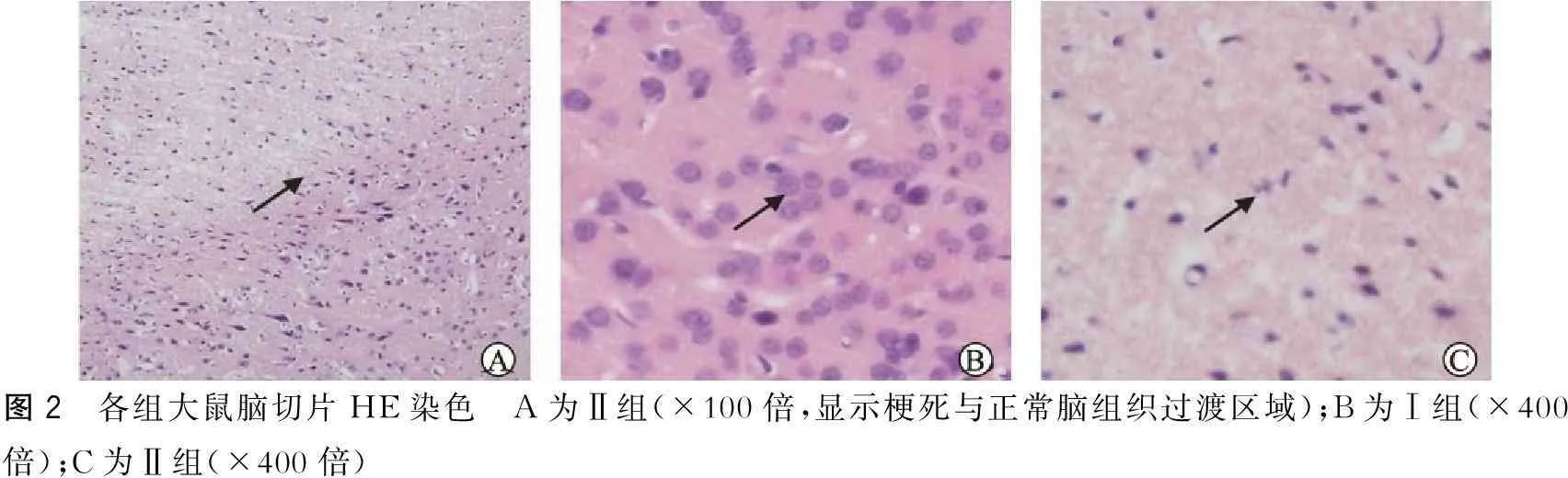
图2 各组大鼠脑切片HE染色 A为Ⅱ组(×100倍,显示梗死与正常脑组织过渡区域);B为Ⅰ组(×400倍);C为Ⅱ组(×400倍)
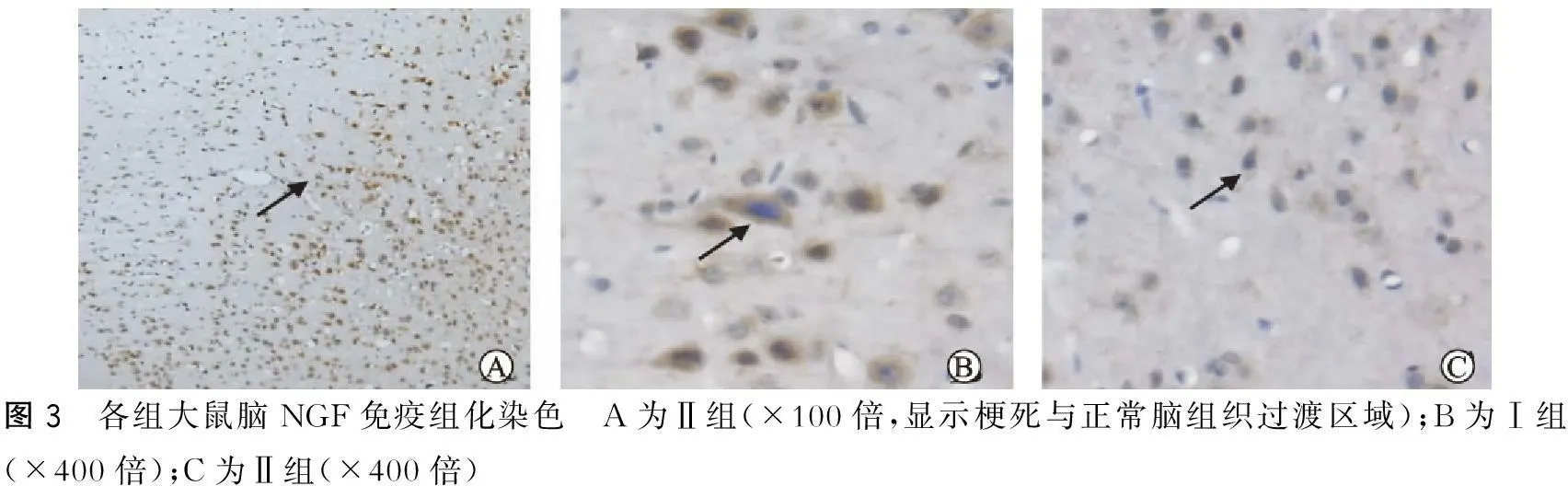
图3 各组大鼠脑NGF免疫组化染色 A为Ⅱ组(×100倍,显示梗死与正常脑组织过渡区域);B为Ⅰ组(×400倍);C为Ⅱ组(×400倍)

图4 各组大鼠脑BDNF免疫组化染色 A为Ⅱ组(×100倍,显示梗死与正常脑组织过渡区域);B为Ⅰ组(×400倍);C为Ⅱ组(×400倍)
Ⅱ组(脑缺血组)大鼠皮层缺血半暗带NGF和BDNF阳性神经元数高于Ⅰ组(假手术组)(P<0.05)(表3)。
3讨论
脑缺血性后脑组织可以启动内源性保护机制,以降低脑缺血对脑组织的损害,挽留更多的脑功能[5]。本研究发现,单纯脑缺血本身可上调缺血半暗带神经营养因子的表达水平,提示在缺血缺氧情况下脑组织的内源性保护机制可能与其可上调脑内神经营养因子的表达有关。
神经营养因子是调节神经系统发育、成熟和维持神经功能的蛋白质,可以促进缺血灶周围和对侧正常脑组织的神经突起新生和新突触形成,对神经再塑具有明显作用。研究表明,脑缺血后脑内多种神经营养因子如NGF、碱性成纤维细胞生长因子(bFGF)和BDNF等因子及其受体表达上调对受损神经组织发挥营养、支持、保护和再生等多种效应[6]。
研究发现,在脑缺血时脑组织内NGF、BDNF的表达均有所增加,这可能是缺血性脑损伤的一种内源性保护机制[7]。本实验结果提示,脑缺血组与假手术组比较,大脑皮层缺血半暗带NGF、BDNF阳性神经元数显著增加,有显著的统计学差异(P<0.05), 这提示脑缺血本身可以上调脑神经元对NGF、BDNF的表达水平。
总之,本实验结果证实了脑缺血可以上调脑内神经元对NGF、BDNF的表达水平,从而参与脑缺血的内源性保护机制,但其具体机制仍不清楚。另外,本研究仅观察了48 h脑缺血且为单纯缺血,无再灌注过程,关于延长干预时间后有无更明显的脑保护作用以及在缺血再灌注过程中有无其他改变,均有待于进一步研究。
参考文献
1中华医学会神经病学分会脑血管病学组急性缺血性脑卒中诊治指南撰写组.中国急性缺血性脑卒中诊治指南2010.中华神经科杂志,2010,43(2):146-153.
2Yang JP,Liu HJ,Yang H,et al.Therapeutic time window for the neuroprotective effects of NGF when administered after focal cerebral ischemia. Neurol Sci, 2011,32(3):433-441.
3Longa EZ,Weinstein PR,Carison S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats. Stroke, 1989, 20(1): 84-91.
4Bederson JB,Pitts LH,Tsuji M, et al. Rat middle cerebral artery occlusion: evaluation of the model and development of a neurologic examination. Stroke,1986, 17(3):472-476.
5Solev IN,Balabanyan VY,Volchek IA,et al.Involvement of BDNF and NGF in the mechanism of neuroprotective effect of human recombinant erythropoietin nanoforms. Bull Exp Biol Med, 2013,155(2):242-244.
6Autry AE, Monteggia LM.Brain-derived neurotrophic factor and neuropsychiatric disorders. Pharmacol Rev,2012,64(2): 238-258.
7刘明,刘洋,张易,等.梓醇上调NGF、BDNF及mRNA表达伴随缺血性脑卒中大鼠神经功能恢复.中华中医药杂志, 2011,26(5):977-981.
(2014-12-24收稿)
【摘要】目的观察大鼠局灶性脑缺血后大鼠神经行为、梗死体积、组织形态及缺血半暗带神经生长因子(NGF)、脑源性神经营养因子(BDNF)的表达水平变化。方法将健康雄性SD大鼠24只随机分为2组,Ⅰ组(假手术组);Ⅱ组(脑缺血组)。用线栓法建立动物模型,不给予再灌注,各组在术后48h断头取脑,处死前行神经功能评分,用氯化三苯基四氮唑(TTC)染色计算脑梗死体积,用HE染色观察组织学形态,用免疫组织化学染色观察NGF、BDNF的表达水平。结果Ⅰ组在神经功能评分、梗死体积、组织形态及大脑皮层相应部位NGF、BDNF阳性细胞数均正常。与Ⅰ组比较,Ⅱ组的神经功能评分和梗死体积均严重受损;光镜下Ⅱ组缺血性病理改变较重,与Ⅰ组比较,Ⅱ组缺血半暗带NGF、BDNF阳性神经元数增加(P<0.05)。结论脑缺血本身可上调缺血半暗带NGF、BDNF的表达水平。
【关键词】脑缺血神经生长因子脑源性神经营养因子
【DOI】10.3969/j.issn.1007-0478.2015.04.005
Expression of neurotropic factors after focal cerebral ischemia injury in rats.LiuPeng,WangJin,MiaoChangqing,etal.DepartmentofGeriatricNeurology,theShanxiProvincialPeople’sHospital,Xian710068
【Abstract】ObjectiveTo observe the expression of neurotropic factors on a rat model of focal middle cerebral artery occlusion (MCAO).MethodsTwenty-four male Sprague-Dawley rats were randomly divided into two groups, groupⅠ(Sham operated rats) and groupⅡ(MCAO ischemia). The neuroethology assessment was evaluated at 48h before the rats were executed and given reperfusion. The volume of cerebral infarction and the pathologic changes were observed by TTC staining and HE staining. The expression of NGF and BDNF was tested by immunohistochemistry.ResultsUnder optical microscope, group Ⅱhad more degree of cerebral ischemic injury in pathomorphology. The numbers of NGF and BDNF immunopositive neurons in ischemic penumbra of groupⅡ were higher than those in cerebral cortex of groupⅠ (P <0.05).ConclusionsBrain ischemia injury can increase the expression NGF and BDNF in the brain ischemic penumbra, bur its mechanism is not clear.
【Key words】Cerebral ischemia injuryNerve growth factorBrain-derived neurotrophic factor
【中图分类号】R743
【文献标识码】A
【文章编号】1007-0478(2015)04-0211-04
基金项目:陕西省自然科学基础研究计划项目(2013JM4020)
