当归含药血清对Aβ25-35诱导PC12细胞凋亡的保护作用研究
2015-02-18谢守嫔李海龙吴红彦
谢守嫔 ,罗 佳 ,李海龙 ,吴红彦 △
1兰州市第一人民医院,甘肃 兰州 730050;2兰州市中医医院;3甘肃中医药大学;4甘肃省中药新产品创制工程实验室
当归是已广泛使用的药物,当归及其提取物在实验研究中也体现出对Aβ诱导的神经毒性有保护作用,但对Aβ诱导的神经细胞凋亡却未见报道。因而,本实验拟以Aβ25-35诱导PC12细胞复制阿尔茨海默病细胞模型为对象,采用具有养血、活血、调肝的当归含药血清以不同浓度加以干预,从细胞活力、细胞膜的损伤和细胞凋亡的变化入手,探索其药理机制,为进一步筛选当归有效组份提供实验依据。
1 材料与方法
1.1 实验动物及细胞 SPF级Wistar大鼠40只,雌雄各半,体质量(300±20)g,由甘肃中医学院科研实验动物中心提供,动物质量合格证编号:SCXK(甘)2004-0006-0000994,实验设施使用许可证编号:SYXK(甘)2004-0006-0000308。动物分笼饲养,食固体饲料,饲料由甘肃中医药大学科研实验动物中心提供,食水自由,室温20~25℃,相对湿度45%~52%。PC12细胞(中分化)购于中国科学院上海细胞库。
1.2 实验药品与试剂 中药材当归:购于甘肃兰州老字号“复兴厚”药材公司;DMEM:Sigma公司,批号:NVL0337。细胞培养液:将DMEM培养基中加入10%胎牛血清和1%双抗,0.22μm滤器过滤除菌,PH 7.2~7.4,4℃保存。磷酸盐缓冲液(PBS):购于gibico公司,批号:20101025;用双蒸水定容至1 000 mL,0.22μm滤器过滤除菌,PH为 7.2~7.4,4℃保存。Hanks:Solarbio,批号:H1025。胎牛血清:杭州四季青公司,批号:100528;56℃灭活30分钟,无菌分装,-20℃保存,使用前经4℃、室温、37℃缓慢溶解备用。胰蛋白酶:购于鹏程公司,批号:0458;用PBS液配制成浓度为0.25%溶液,0.22μm滤器过滤除菌,4℃保存。四氮唑蓝(MTT):购于鹏程生物工程公司,批号:0793;用pH为7.4的PBS溶解,用时配成终浓度5 mg/mL的溶液,4℃避光保存。二甲基亚砜(DMSO):购于鹏程公司。LDH试剂盒:购于南京建成生物工程研究所,批号:20101025。Aβ25-35:sigma公司,批号:108k4794。Anncxin V/PI试剂盒:杭州联科生物公司,批号:JK100929。
1.3 Aβ配制方法 将1mg Aβ25-35溶解于BPS液中,配制成浓度为1mmol/L母液。储存于-30℃冰箱中备用。使用时将其稀释至100μmol/L,并置于37℃,5%CO2培养箱中3~7天以增强其毒性。
1.4 细胞培养 PC12细胞株完全培养液为DMEM+10%(体积比)胎牛血清+青链霉素,5%CO2、37℃培养箱中培养。每3~4天传代1次。倒置显微镜观察细胞生长情况。
1.5 实验分组 正常组:只加细胞悬液,不加任何处理因素;模型组:取20μmol/L终浓度的A β25-3530μL处理细胞24小时;空白血清组:用空白血清组加入空白血清30μL预处理24小时后加入20μmol/L终浓度Aβ25-3530μL共同孵育24小时;药物组:当归10倍(当归高剂量组),5倍(当归中剂量组),正常剂量(当归小剂量组)3组含药血清30μL预处理24小时后加入20μmol/L终浓度Aβ25-3530μL共同孵育24小时。
1.6 MTT法测细胞活力 取对数生长期PC12细胞,消化、离心后用完全培养液重悬,浓度为1×104μmol/mL,接种于96孔板,每孔加细胞培养液100μL,细胞贴壁后,吸取旧的培养液,每组设4个平行样本,按上述分组处理后,各孔吸去上清液20μL,加浓度为 0.5mg/mLMTT 20μL,继续培养4小时,然后每孔加200μL二甲基亚枫,震荡8分钟,使紫色结晶充分溶解,空白孔调零,酶联免疫检测仪上测每孔吸光度即OD值(检测波长570 nm)。
1.7 LDH测定 取对数生长期PC12细胞,经胰酶消化后,吹打成单细胞悬液,将细胞按照以1×105/孔的密度接种于96孔板,每孔加细胞培养液90μL,每组设8个平行样本,根据实验分组处理后,按LDH试剂盒说明进行标本的测定。用酶标仪在450 nm波长下测定吸光度(OD值)。LDN活性 =(ODu-ODc)/(ODs-ODb)×Cs×N×1000式中:ODu为测定管吸光度值、ODc空白管吸光度值、ODs为标准管吸光度值、ODb为对照管吸光度值、Cs为标准浓度(2mmol/L)、N为样品测试前稀释倍数。
1.8 流式细胞仪检测细胞凋亡 1)取对数生长期PC12细胞(1×105/孔),接种于6孔板,实验分组如前处理;2)处理后经胰酶消化、吹打成单细胞悬液,移入离心管中;3)将离心管于1 000 r/min离心5 min,弃上清,PBS漂洗1次后,重复离心洗涤一次;4)依据试剂盒说明进行操作,将细胞重悬于500μL binding buf fer中,再分别加入5μL的AnnexinV-FITC溶液和10μLP1染液,避光于室温放置5分钟;5)转至流式检测管,上机检测,实验同法重复3次。
1.9 统计学方法 数据采用SPSS 13.0统计软件进行处理,计量资料采用(χ±s)表示,采用单因素方差分析(F检验),P<0.05为有统计学意义。
2 结果
2.1 培养细胞形态学观察 正常组PC12细胞生长速度快,贴壁良好,大多伸出长的轴突,容易成簇生长。在模型组中细胞明显损伤,数量显著减少,可见PC12细胞肿胀、圆缩,突起回缩,贴壁功能下降,有脱壁漂浮现象。
2.2 MTT检测结果 MTT法测定各实验组的OD值显示,模型组所测的OD值为(0.64±0.40),空白血清组(0.78±0.14),2组没有差异;空白组的OD值为 (1.35±0.27),与模型组比较有显著性差(P<0.01),显示造模成功;当归小、中、大3个剂量组OD值均比模型升高,其中高剂量组与小剂量组比较差异有统计学意义(P<0.05),结果见表1。
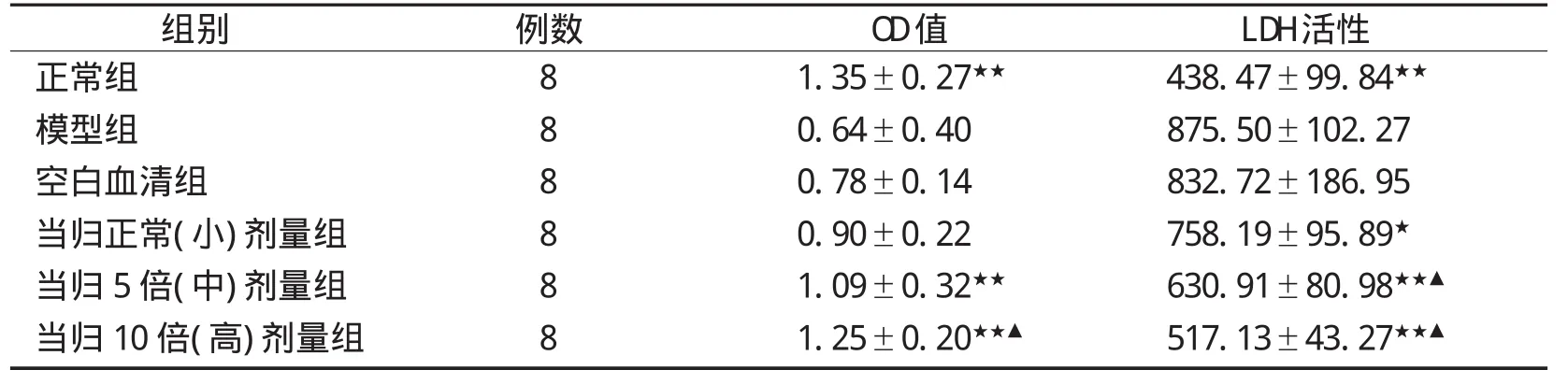
表1 当归大鼠含药血清对Aβ25-35损伤PC12细胞的OD值和LDH活性的影响(χ±s)
2.3 LDH检测结果 测定各实验组LDH的OD值显示,模型组所测的OD值为(875.5±102.27),空白血清组(832.72±186.5),2组没有差异;空白组的OD值为(438.47±99.84),与模型组比较有显著性差异(P<0.05),显示造模成功;当归小、中、大3个剂量组OD值均比模型升高,其中高剂量组与小剂量组比较有明显差异,有统计学意义(P<0.05),中剂量组与小剂量组比较差异有统计学意义(P<0.05),结果见表1。
2.4 细胞凋亡检测结果 与模型组比较,空白组有显著性差异,有统计学意义(P<0.05),显示造模成功;当归小、中、大3个剂量组细胞活力均比模型升高,各当归组与模型组比较差异均有统计学意义(P<0.05)。与当归小剂量组与大剂量组比较,差异有统计学意义(P<0.05)。见表2和附图1-6。
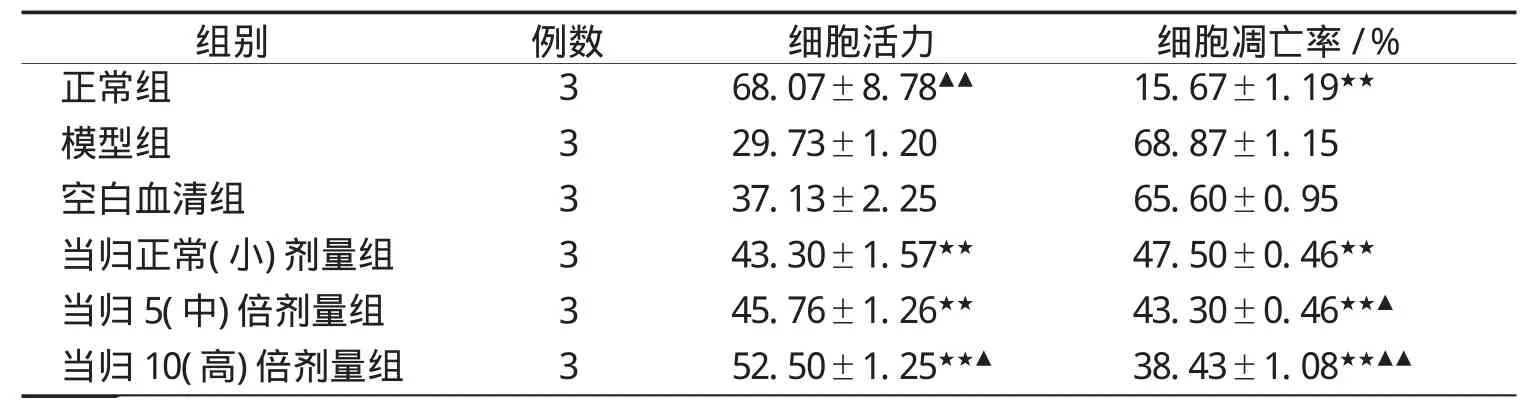
表2 当归大鼠含药血清对Aβ25-35损伤PC12细胞活力和凋亡率的影响(χ±s)
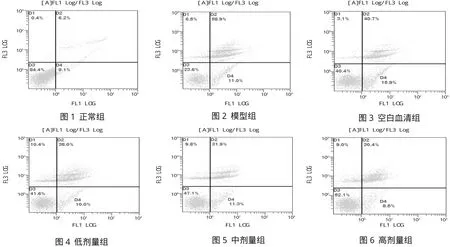
图1 -6 当归大鼠含药血清对Aβ25-35诱导PC12细胞凋亡的影响
3 讨论
当归性味甘、辛、苦而温,入肝、心、脾经。《本草》云:“当归,治一切气,补一切血,破恶血,养心血。”《景岳全书·本草正》载:“当归,其味甘而重,故专能补血;其气轻而辛,故又能行血。补中有动,行中有补,诚血中之气药,亦血中之圣药也。”可见当归既可益阴血而补肝体,养血安神,又可舒肝气而助肝用,调气机而畅情志,气血同调,心肝并治,对老年性痴呆精神与行为失常的防治具有很好的理论针对性。
本实验结果表明,在Aβ25-35诱导的作用下,PC12细胞发生显著的凋亡,当归各含药血清能升高PC12细胞的活力,降低 LDH释放,对Aβ25-35诱导的PC12细胞凋亡有明显的保护作用。有报道,采用大剂量当归治疗脑中风后遗症,其不仅能改善后遗症,且能明显改善中风患者出现的记忆力减退等认知功能障碍,并未见明显副作用[1]。现代药理研究表明,当归可清除体内氧自由基,抗脂质过氧化物反应,具有明显的抗衰老功能[2-11];当归能降低血管性认知障碍大鼠脑组织中AChE含量,升高其血中SS含量,体现出对中枢胆碱能神经递质活性和数量的调节作用[12];当归提取物可剂量依赖性地减弱Aβ1-42诱导的神经毒性和tau蛋白磷酸化,同时,它能增加Akt的丝氨酸磷酸化水平,并下调GSK-3β活性,说明当归提取物保护神经细胞的作用与PI3K/Akt/GSK-3β信号通路有关[13];当归根的乙醇提取物对Aβ诱导的神经毒性有保护作用,并能升高线粒体跨膜电位Del taPsim[14]。关于当归抗凋亡的保护作用,仍有待进一步深入研究。
[1] 李妍怡,刘志军,杨瑞龙,等.补脑膏治疗血管性痴呆70例[J].中医研究,2010,23(1):41-43.
[2] 戚晓利,徐秀芳,魏晓东.当归对D-半乳糖衰老模型小鼠抗氧化系统的研究[J].黑龙江医学科学,2003,26(1):2-3.
[3] 袁新初,张端莲.当归注射液对更年期大鼠超氧化物歧化酶和脂质过氧化物的影响[J].中草药,2001,32(9):822-823.
[4] 刘力昌,李妍怡,张可兰.补脑膏对血管性认知障碍大鼠认知障碍的改善作用及其机制的研究[J].中医研究,2006,19(1):19-21.
[5] Li L,Li W,Jung SW,et al.Protective ef fects of decursin and decursinol angelate a gainst amyloid β-protein-induced oxidative stress in the PC12 cel l line:the role of Nr f2 and antioxidant enzymes[J].Biosci Biotechnol Biochem,2011,75(3):434-442.
[6] 邓红娟,郭延生,曲亚玲,等.生当归、酒当归和油当归体外清除自由基活性研究[J].中草药,2009,40(5):784-787.
[7] 刁鹏飞,郭延生,刘宝剑,等.当归水提液和醇提液体外抗脂质过氧化和红细胞溶血作用[J].天然产物研究与开发,2009,21(4):679-683.
[8] 邓红娟,郭延生,刁鹏飞,等.当归水提液和醇提液体外清除自由基的研究[J].甘肃农业大学学报,2009,44(4):58-61.
[9] 郭延生,华永丽,邓红娟,等.当归不同炮制品清除自由基谱效关系研究[J].中成药,2010,32(12):2107-2111.
[10]华永丽,郭延生,邓红娟,等.当归不同药用部位水提液体外清除自由基作用研究[J].时珍国医国药,2010,21(7):1582-1584.
[11]魏彦明,郭延生,曲亚玲,等.当归及其炮制品水提物体外抗脂质过氧化作用[J].天然产物研究与开发,2010,22(5):878-882.
[12] Park SJ,Jung HJ,Son MS,et al.Neuroprotective effects of INM-176 against l ipopolysaccharide-induced neuronal injury[J].Pharmacol Biochem Behav,2012,101(3):427-433.
[13] Zhang Z,Zhao R,Qi J,et al.Inhibition of glycogen synthase kinase-3βby Angel ica sinensis ext ract decreasesβ-amyloid-induced neurotoxicity and tau phosphorylation in cul tured cortical neurons[J].J Neurosci Res,2011,89(3):437-447.
[14]Huang SH,Lin CM,Chiang BH.Protective ef fects of Angelica sinensis extract on amyloid beta-peptide-induced neurotoxicity[J].Phytomedicine,2008,15(9):710-721.
