9种中药口服制剂微生物限度与控制菌检查法的建立及方法学验证
2015-02-18张小华王婷婷徐玉娥
张小华,王婷婷,徐玉娥
甘肃省中医院,甘肃 兰州 730050
细菌、霉菌和酵母菌计数是检测非规定灭菌制剂及原、辅料受微生物污染程度的方法。也是用于评价生产企业的药用原料、辅料、设备、器具、工艺流程、环境和操作者的卫生状况的重要手段和依据。由于某些供试品具有抗菌活性,在建立测定方法或原测定法的检验条件发生改变时,可能影响检验结果的准确性,必须对供试品的抑菌活性及测定方法的可靠性进行验证。而验证的目的是确认所采用的方法是否适合于供试品的微生物限度检查。
本研究按照2010年版《中国药典》(一部)微生物限度检查法的规定,根据中药制剂抑菌作用强度不同,采用常规法,培养基稀释法进行9个品种医院制剂的细菌、霉菌及酵母菌计数方法验证及控制菌检查方法的验证,以建立适合该品种的微生物限度检查方法。
1 材料
1.1 仪器 LDZX-50FBS立式压力蒸汽灭菌器(上海申安医疗器械厂);SPX-智能型生化培养箱(宁波江南仪器厂);MJX-智能型霉菌培养箱(宁波江南仪器厂);METTLER AE240电子分析天平(赛多利斯公司)。
1.2 验证用菌株 枯草芽孢杆菌CMCC(B)63501、大肠埃希菌CMCC(B)44102、金黄色葡萄球菌CMCC(B)26003、白色念珠菌CMCC(F)98001、黑曲霉CMCC(F)98003,均由中国药品生物制品检定所提供。
1.3 培养基 PH7.0氯化钠-蛋白胨缓冲液(批号:100328)、营养琼脂培养基(批号:1003292)、玫瑰红钠琼脂培养基(批号:100409)、胆盐乳糖培养基(批号:100429)、改良马丁琼脂培养基(批号:0912282)、曙红亚甲蓝琼脂培养基(批号:090303)、营养肉汤培养基(批号:100319),均由中国药品生物制品检定所提供。
1.4 样品 健胃清肠合剂(批号:20130724,20130725,20130726)、复方萱草颗粒(批号:20130722,20130731,20130808)、通窍鼻渊丸(批号:20130401,20130415,20130425)、健胃消食合剂(批号:20130621,20130708,20130807)、健 胃 止 泻 合 剂 (批 号 :20130808,20130822,20131012)、健胃止血合剂(批号:20130514,20130717,20131202)、姜石肠炎康颗粒(批号:20130727,20130814,20130829)、清热解毒合剂(批号:20130418,20130611,20130727)、痛风平颗粒(批号:20130725,20130806,20130827)以上制剂均由甘肃省中医院药学部制剂室提供。
2 方法与结果[1-7]
2.1 菌液制备 接种大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的新鲜培养物至营养肉汤培养基中,经30~35℃培养18~24小时。取上述肉汤培养物1mL,加9mL 0.9%无菌氯化钠溶液,10倍逐级稀释至菌数约为50~100 cfu/mL,做菌液组计数备用。接种白色念珠菌的新鲜培养物至改良马丁培养基中25℃培养24~48小时后,用9mL 0.9%无菌氯化钠溶液,10倍逐级稀释至菌数约为50~100 cfu/mL,做菌液组计数备用。取经25℃培养7天的黑曲霉斜面培养物,加3~5mL 0.9%无菌氯化钠溶液洗下霉菌孢子,吸取霉菌孢子液1mL加9mL 0.9%无菌氯化钠溶液,10倍逐级稀释为菌数约为50~100 cfu/mL,做菌液组计数备用。
2.2 供试液制备 液体样品各取10mL,固体样品各取10 g,加入pH7.0的氯化钠-蛋白胨缓冲液100 mL中,45℃水浴振摇,使样品完全分散均匀,作为1∶10供试液;通窍鼻渊丸取10 g,加入pH 7.0的氯化钠-蛋白胨缓冲液100mL中,乳钵研匀,45℃水浴振摇,使样品完全分散均匀,作为1∶10供试液。
2.3 细菌、霉菌及酵母菌计数方法选择实验及有效性验证实验
2.3.1 常规法 依法进行下列3组实验,实验组:分别取1mL 1∶10的供试液及50~100 cfu/mL的阳性菌液,同时加入平皿中,立即倾注20 mL 45℃左右的琼脂培养基,每株阳性菌平行制备2个平皿,待凝固后,置规定温度培养24~72小时观察,按平皿法测定其菌数;菌液组:测定所加的阳性菌数;供试品对照组:取与实验组同一供试液测定供试品本底菌数。
2.3.2 培养基稀释法 取1 mL 1∶10的供试液,分别采用加0.5mL/皿、0.2mL/皿供试液及50~100 cfu实验菌的方法,分别加入2~10个平皿中,同常规法进行其他操作。
2.3.3 计算回收率 回收率(%)=[(实验组菌数-供试品组菌数)/菌液组菌数]×100%,《中国药典》2010年版规定对各阳性菌株的回收率均不得低于70%。
2.3.4 细菌、霉菌及酵母菌计数方法选择实验 细菌、霉菌及酵母菌计数方法选择实验结果见表1—3。
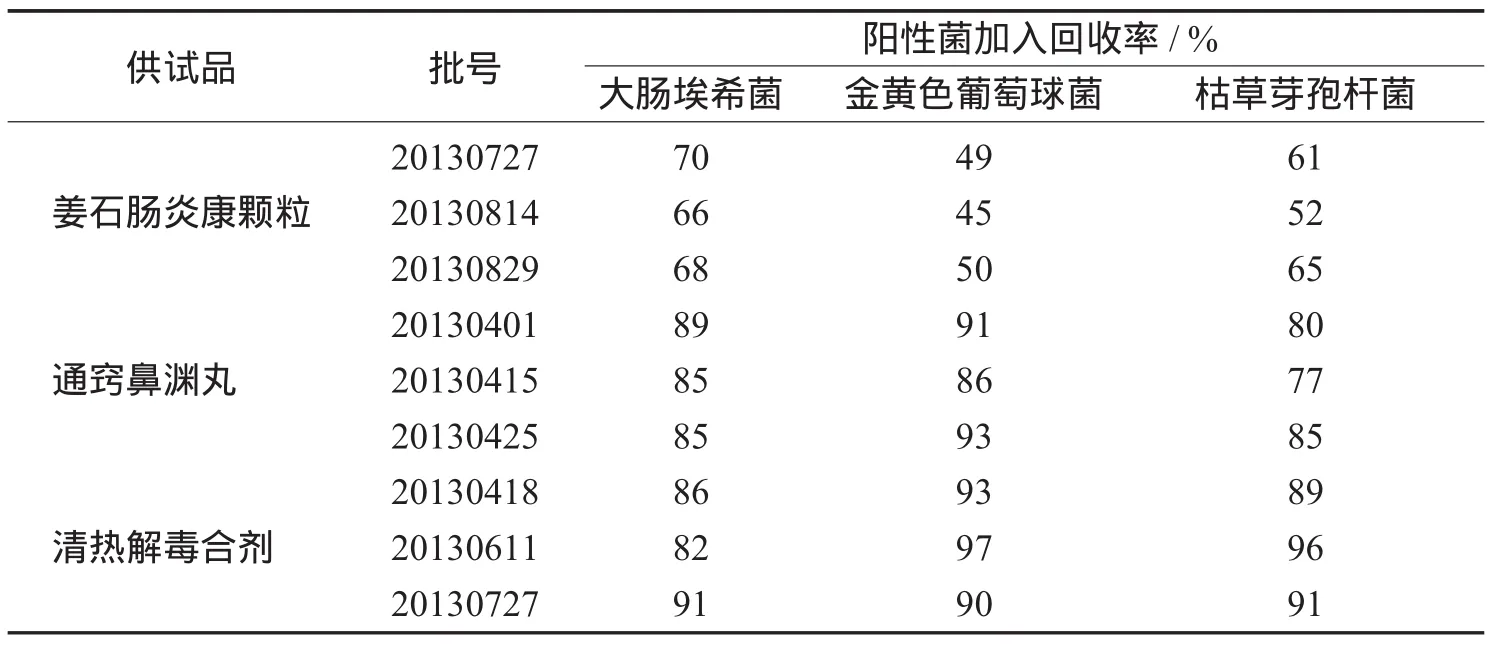
表1 培养基稀释度(0.5 mL/皿)法对各实验菌株的回收率均值
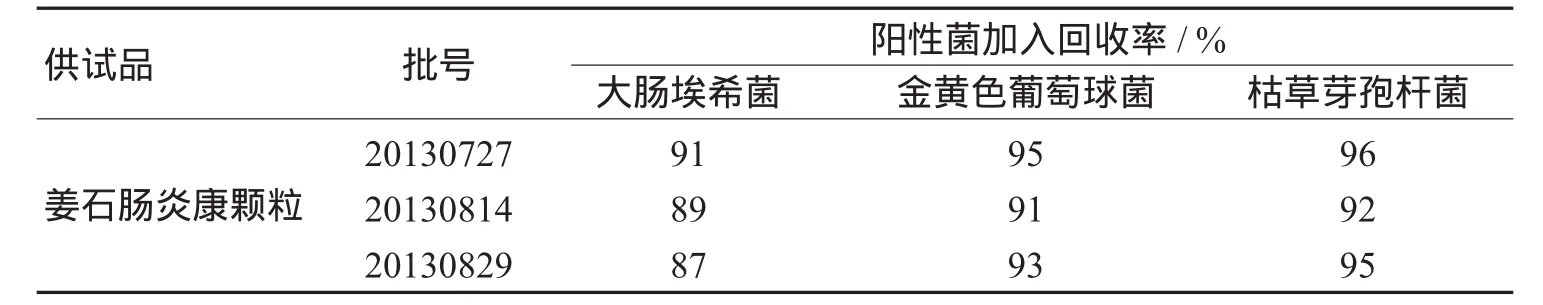
表2 培养基稀释度(0.2mL/皿)法对各实验菌株的回收率均值
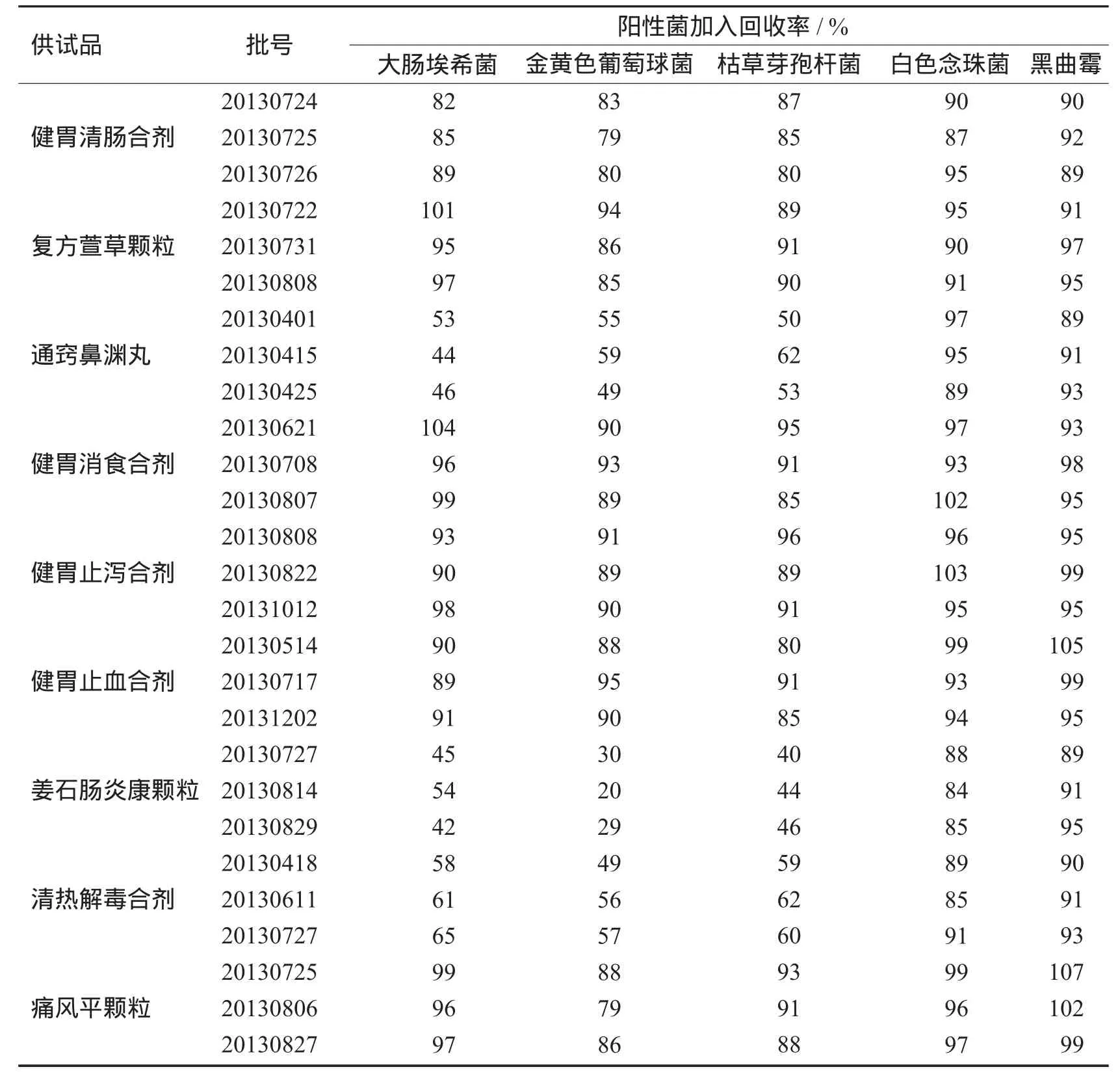
表3 常规法测定9种中药制剂对各实验菌株的回收率均值
由表1结果可见,金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌用培养基稀释法0.5mL/皿时,通窍鼻渊丸、清热解毒合剂各阳性菌的回收率均>70%,说明供试品稀释至0.5mL/皿时,其抑菌活性可忽略不计,供试品中各类污染的细菌均能顺利检出;姜石肠炎康颗粒在用培养基稀释法0.2mL/皿实验时,阳性菌的回收率均>70%,细菌可用培养基稀释法(0.2mL/皿)进行实验,霉菌及酵母菌均可用常规法进行实验。
由表2结果可见,健胃清肠合剂、复方萱草颗粒、健胃消食合剂、健胃止泻合剂、健胃止血合剂、痛风平颗粒6个品种用常规方法实验,对阳性菌大肠埃希菌、金黄色葡萄球菌、枯草芽胞杆菌、白色念珠菌、黑曲霉无抑菌作用,回收率均大于70%;通窍鼻渊丸、清热解毒合剂、姜石肠炎康颗粒的大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌回收率低于70%,表明其具有一定的抑制大肠埃希菌、金黄色葡萄球菌、枯草芽孢杆菌的作用,检验时应消除其抑菌活性后进行实验。
2.4 控制菌大肠埃希菌及大肠菌群检查方法有效性验证[8]
2.4.1 大肠埃希菌 取1∶10供试液10mL及10~100 cfu大肠埃希菌加至100mL胆盐乳糖培养基中,培养18~24小时后,按《中国药典》2010年版控制菌检验方法检查。同法操作,加10~100 cfu金黄色葡萄球菌作阴性对照。
2.4.2 大肠菌群 取 1∶10、1∶100、1∶1000供试液各1.0mL及10~100 cfu大肠埃希菌加至10mL胆盐乳糖发酵培养基中,培养18~24小时后,按《中国药典》2010年版控制菌检验方法检查。同法操作,加10~100 cfu金黄色葡萄球菌作阴性对照。
结果表明,健胃清肠合剂等9个品种实验组都检出大肠埃希菌、阴性菌对照组都未检出金黄色葡萄球菌,表明控制菌检查方法学验证实验成立,即取1∶10供试液10mL或1mL按常规法进行控制菌检查可行,在此条件下样品溶液对控制菌大肠埃希菌无抑制作用。
3 讨论
药品污染微生物不仅危及患者用药安全,而且也直接影响药品的有效性。微生物限度检验中,确认供试品在该检验量、该检验条件下无抑菌活性或其抑菌活性已被充分消除,才能保证检验结果真实反应制剂的微生物污染情况[9]。
中药制剂成方药味通常较多,抑菌活性强度不同,实验过程中,对具有较强抑菌活性的制剂进行检验时,首选简便有效的培养基稀释法,抑菌作用强的制剂还可选择离心沉淀法、薄膜过滤法等。通过实验发现,健胃清肠合剂、复方萱草颗粒、健胃消食合剂、健胃止泻合剂、健胃止血合剂、痛风平颗粒6个品种基本无抑菌活性,细菌、霉菌及酵母菌的检验均可采用常规法。姜石肠炎康颗粒、通窍鼻渊丸、清热解毒合剂3个品种具有不同程度的抑菌活性,但可通过稀释法消除抑菌作用。
由于控制菌检查为一次性报告实验结果,故应注意方法的有效性确认,以提高检验结果的可靠性。口服给药制剂中,不含药材原粉的制剂需要检查大肠埃希菌,含药材原粉的制剂除检查大肠埃希菌外,还要进行大肠菌群的检查。对9个品种的口服中药制剂控制菌检查方法有效性验证结果表明,健胃清肠合剂等9个品种中药制剂均可使用常规法进行控制菌检查。
[1] 国家药典委员会.中华人民共和国药典[M].北京:化学工业出版社,2010:附录79-86.
[2] 中国药品生物制品检定所.中国药品中国药品检验标准操作规范[M].北京:中国医药科技出版社,2010:351-369.
[3] 莫小林,伍小燕,韦振源,等.10种中药制剂微生物限度检查方法学的验证[J].中国实验方剂学杂志,2012,18(13):56-59.
[4] 韦曦,邱双成,王翠荣.29种医院制剂微生物限度检查方法验证[J].中国药房,2008,19(1):52-54.
[5] 张小华,何晓英,刘效栓,等.安坤种子丸微生物限度检测法的建立及方法学验证.西部中医药,2013,26(11):19-21.
[6] 霍昕,黄晓琦,刘建华,等.哮喘片微生物限度检查法的建立及方法学验证[J].中国实验方剂学杂志,2012,18(15):121-124.
[7] 闵红,唐娜,尹良君.2种中药制剂微生物限度与控制菌方法验证[J].西北药学杂志,2013,28(3):301-303.
[8] 朱会琴,李凯,王建宁,等.几种中成药的微生物限度检查方法的探讨[J].中成药,2007,29(12):附 4-附 7.
[9] 谢爱丽.锌硼散微生物限度检查方法的验证[J].海峡药学,2013,25(10):70-72.
