靶向沉默巨噬细胞中Mcl-1基因shRNA表达质粒的构建与鉴定
2015-02-18王新敏王飞雨张雨晴曹旭东吴江东张万江
王 婵,王新敏,王飞雨,张雨晴,曹旭东,吴江东,吴 芳,张万江,章 乐
(石河子大学医学院:1.病原生物学与免疫学教研室;2.病理生理学教研室;3.第一附属医院泌尿外科;4.石河子大学新疆地方与民族高发病教育部重点实验室,新疆石河子 832002)
髓系细胞白血病-1(myeloid cell leukemia-1,Mcl-1)基因是Bcl-2家族中的抗凋亡蛋白,位于人染色体lq21,是利用佛波酯诱导从人髓系白血病ML-1细胞系向单核巨噬细胞分化时发现的早期诱导基因[1]。研究表明,Mcl-1L蛋白作为 Mcl-1基因的编码产物对多种细胞的生存与生长至关重要,并且证明是凋亡调控分子家族的一个重要成员,在结核分枝杆菌毒力株抑制巨噬细胞凋亡机制中具有特别的作用[2]。另有研究证明,当结核分枝杆菌长期生存于巨噬细胞当中时,受到感染的巨噬细胞Mcl-1基因就会高表达。同时,巨噬细胞的凋亡率下降[3]。所以,通过抑制Mcl-1L蛋白表达来促使感染宿主巨噬细胞凋亡成为治疗肺结核疾病的可能。
为了进一步明确巨噬细胞与结核分枝杆菌相互作用过程中下调Mcl-1水平在治疗结核中的作用,本研究预先使用Western blot和半定量RT-PCR检测不同巨噬细胞中Mcl-1的表达,筛选出合适的细胞株作为实验用细胞,为进一步研究该基因在结核中的作用提供实验依据;再通过构建靶向小鼠Mcl-1短发夹RNA(short hairpin RNA,shRNA)真核表达质粒,转染上述筛选的实验用细胞Raw264.7,通过实时荧光定量PCR和Western blot检测mcl-1mRNA和蛋白表达情况,观察真核表达质粒对小鼠Raw264.7细胞中Mcl-1表达的抑制作用,筛选抑制效率较高的质粒表达载体,为后续研究Mcl-1基因对不同毒力结核分枝杆菌感染宿主巨噬细胞Raw264.7凋亡的调控作用奠定基础。
1 材料与方法
1.1 材料 小鼠Raw264.7巨噬细胞株购自中国科学院典型培养物保藏委员会细胞库;人THP-1巨噬细胞株由石河子大学基础医学院王远志教授惠赠;胎牛血清(FBS)购自美国Thermo公司;DMEM、1640、青链霉素和PBS缓冲液购自美国Hyclone公司;LipofectamineTM2000、SuperRT cDNA Kit及 TRIzol Reagent购自美国Invitrogen公司;QuantiFast SYBR Green PCR Kit购自 Qiagen公司;PVDF膜、ECL化学发光试剂盒购自美国Millipore公司;兔抗Mcl-1多克隆抗体购自Santa Cruz Biotechnology;鼠来源β-actin mAb、HRP标记羊抗兔IgG及HRP标记羊抗兔IgG均购自北京中杉。
1.2 方法
1.2.1 细胞的培养 小鼠巨噬细胞Raw264.7、人THP-1经诱导活化后分别置于DMEM和1640培养液中培养。胰蛋白酶消化Raw264.7并收集细胞,对THP-1直接离心并收集细胞。显微镜下计数并调整细胞浓度为6.0×106/mL,将计数后的细胞种在6孔细胞培养板,加入相对应的培养基置于37℃、50mL/L CO2细胞培养箱中培养。
1.2.2 RT-PCR检测两种巨噬细胞mRNA表达水平 细胞总RNA提取配平后按照Trizol说明书操作,将细胞总RNA逆转录获取cDNA,然后进行PCR扩 增 反 应。小 鼠 Mcl-1 引 物,Forward:5′-TATTTCTTTCGGTGCCTTTGTG-3′,Reversa:5′-AGTCCCGTTTCGTCCTTACA-3′,扩增片段大小为113bp。以β-actin为小鼠内参,引物Forward:5′-AATTCCATCATGAAGTGTGA-3′,Reversa:5′-ACTCCTGCTTGCTGATCCAC-3′,扩增片段大小为248bp。人 Mcl-1引物,Forward:5′-GCTGATTGTTCTGCTCCCTCTA-3′,Reversa:5′-CGTGAAAGATGAAAGGTCTGTG-3′,扩增片段大小为170bp。以GAPDH为人内参,引物为Forward:5′-AGAAG-GCTGGGGCTCATTTG3′,Reversa:5′-AGGGGCCATCCACAGTCTTC-3′,扩增片段大小为258bp。PCR扩增条件:94℃3min,94℃30s,(57℃、54℃、59℃、61℃)30s、72℃1min、共30个循环,72℃延伸5min。反应结束后,取5μL PCR产物用20g/L琼脂糖凝胶进行电泳分析,在凝胶成像系统Image Lab中分别测出小鼠和人目的条带吸光度值,结果以小鼠 Mcl-1/β-actin、人 Mcl-1/GAPDH 的吸光度比值来反映Mcl-1mRNA表达水平,进行半定量分析。
1.2.3 Western blot检测两种巨噬细胞及转染后Mcl-1蛋白的表达 以β-actin为内参,分别收集小鼠Raw264.7、人THP-1及转染小鼠Raw264.7巨噬细胞24、48h后各组蛋白,用细胞裂解液抽提细胞总蛋白。核酸蛋白测定仪模式调至A280,测定总蛋白的浓度。将等量的蛋白质样品点于SDS-PAGE凝胶小孔进行电泳分离,电转移至PVDF膜上,恒压23V;将转好的PVDF膜用1×TBST洗涤3次后,将膜浸入封闭液(1×TBST+0.05g/mL脱脂奶粉)中室温水平摇床缓慢孵育2h,然后(1∶1 000兔抗鼠 Mcl-1多抗,1∶1 000鼠抗β-actin单抗),4℃过夜,取出膜用1×TBST洗膜5min×4次,加入羊抗鼠、羊抗兔IgG/HRP二抗(1∶20 000)室温孵育2h,再用1×TBST洗膜5min×4次后,ECL法显色,用凝胶图像处理系统Image Lab分析目的条带灰度值。计算目的基因蛋白与β-actin灰度值的比值,进行统计学分析。
1.2.4 靶向Mcl-1表达质粒的构建 用Ambion公司“siRNA Target Finder”软件设计3个针对 NM_008562靶向小鼠Mcl-1基因cDNA序列的短发夹RNA(shRNA),并应用在线软件BLAST检索数据库排除其他基因的同源性序列,其携带绿色荧光蛋白(GFP)的Mcl-1shRNA表达质粒由上海吉凯基因公司构建并合成,并经测序证实(表1)。

表1 Mcl-1shRNA构建框架序列Tab.1 shRNA Mcl-1frame sequence
1.2.5 细胞瞬时转染 当RAW264.7细胞传至第3代时进行转染实验。转染前用不含抗生素的完全培养基培养细胞,细胞按每孔3.5×105的密度接种于6孔板内,置于37℃、50mL/L CO2的培养箱中培养,当细胞融合度达85%时转染为宜。转染前1~2h换液,弃掉培养基,加入2mL新鲜完全培养基;取一无菌EP管,加入250μL OPTI-MEM培养基,加入质粒DNA(每孔4μg),轻柔混匀制成混合物A备用;将10μL LipofeetamineTM2000加入到250μL不含血清的OPTI-MEM培养基中,轻柔混匀制成混合物B备用。室温孵育5min后将两个EP管液体加到一起,用指腹轻拍混匀。室温下静置20min后,将混合液加入到接种细胞的孔中,轻轻摇匀。置于37℃、50 mL/L CO2培养箱;4~6h后换成完全培养基。24、48h后荧光显微镜下拍照,观察细胞转染情况。
1.2.6 实时定量PCR检测转染后 Mcl-1mRNA的表达 用Trizol分别提取转染后24、48h细胞总RNA,逆转录得到cDNA后应用荧光实时定量PCR盒检测 Mcl-1mRNA表达。Mcl-1引物上游5′-TATTTCTTTCGGTGCCTTTGTG-3′,下游5′-AGT-CCCGTTTCGTCCTTACA-3′,产物113bp;内参βactin引物上游5′-AATTCCATCATGAAGTGTGA-3′,下游5′-ACTCCTGCTTGCTGATCCAC-3′,产物248bp。PCR反应程序:94℃30s,54℃30s,72℃1min,共40个循环。PCR结果采用2-△△ct分析法计算。
1.2.7 统计学方法 数据以均数±标准差描述,利用SPSS 16.0软件处理数据,实验所得数据资料进行单因素方差分析(ANOVA)比较各组间差异,P<0.05为差异有统计学意义。
2 结 果
2.1 RT-PCR检测两种巨噬细胞Mcl-1基因的mRNA含量 人目的基因Mcl-1条带亮度低于作为对照的小鼠目的基因Mcl-1条带亮度,通过分析,Mcl-1在小鼠巨噬细胞中的相对表达量(Mcl-1/β-actin)较人巨噬细胞Mcl-1相对表达量高(P<0.05,图1)。
2.2 Western blot检测两种巨噬细胞Mcl-1蛋白的表达 Western blot检测结果显示,两种细胞β-actin条带亮度相似,但通过分析Mcl-1蛋白在Raw264.7细胞表达量高于人巨噬细胞株(图2)。

图1 RT-PCR检测Mcl-1基因mRNA表达Fig.1 The expression of Mcl-1mRNA detected by RT-PCR

图2 Western blot检测巨噬细胞Mcl-1的表达Fig.2 Mcl-1expression in different macrophages detected by Western blot
2.3 荧光显微镜观察Mcl-1shRNA转染情况 倒置荧光显微镜下观察转染成功的细胞内会出现GFP标记的绿色荧光,可反映转染效率。在24、48h观察转染真核表达质粒Mcl-1shRNA1-3均有荧光表达,且转染质粒Mcl-1shRNA3在24、48h的荧光表达量均高于其他两组,表明质粒3的转染效率最高(图3)。
2.4 细胞瞬时转染Mcl-1mRNA表达 真核表达质粒转染Raw264.7细胞24、48h后,转染 Mcl-1shRNA1组、Mcl-1shRNA2组、Mcl-1shRNA3组在24h细胞的 Mcl-1mRNA表达水平分别为0.156±0.034、0.171±0.034、0.143±0.021,均显著低于正常组的0.286±0.023、脂质体组0.273±0.161和空质粒组的0.248±0.014(P均<0.05,图4A)。在48h细胞的Mcl-1mRNA表达水平分别为0.056±0.035、0.071±0.034、0.032±0.015,均显著低于正常组的0.235±0.028、脂质体组的0.212±0.067和空质粒组的0.170±0.033(P 均<0.05,图4B)。各重组质粒转染组之间相比无统计学差异(P>0.05)。但是,以Mcl-1shRNA3的沉默效果最佳。质粒Mcl-1shRNA3在24h和48h对Raw264.7细胞中Mcl-1mRNA的抑制率分别为50%和86.3%。

图3 真核表达质粒Mcl-1shRNA3转染24、48h后Raw264.7细胞的转染效率Fig.3 Transfection efficiency of Raw264.7cells 24hand 48hafter transfection of eukaryotic expression plasmid Mcl-1shRNA3(×200)
2.5 Western blot检测结果 转染24、48h后,各组细胞β-actin蛋白杂交条带亮度相似,但Mcl-1条带亮度有明显差异(图5A、图5B)。各转染质粒组的Mcl-1蛋白条带亮度明显低于正常组、脂质体组和空质粒组,其中质粒Mcl-1shRNA3转染组在24h和48h蛋白条带亮度都很弱,特别是在48h最弱。48h Mcl-1/β-actin吸光度比值:质粒 Mcl-1shRNA1-3分别为0.454±0.084、0.456±0.105、0.379±0.063;正常组、脂质体组和空质粒组分别为0.747±0.145、0.711±0.946和0.708±0.245,3个组相比无统计学差异(P>0.05)。各重组质粒与正常组、脂质体组和空质粒组相比均存在统计学差异(P<0.05)。表明3个重组质粒均可不同程度下调Mcl-1蛋白水平,尤以质粒Mcl-1shRNA3产生的效应最强,质粒Mcl-1shRNA3在24h和48h对Raw264.7细胞中Mcl-1蛋白的抑制率分别为26.2%和49.3%(表2)。
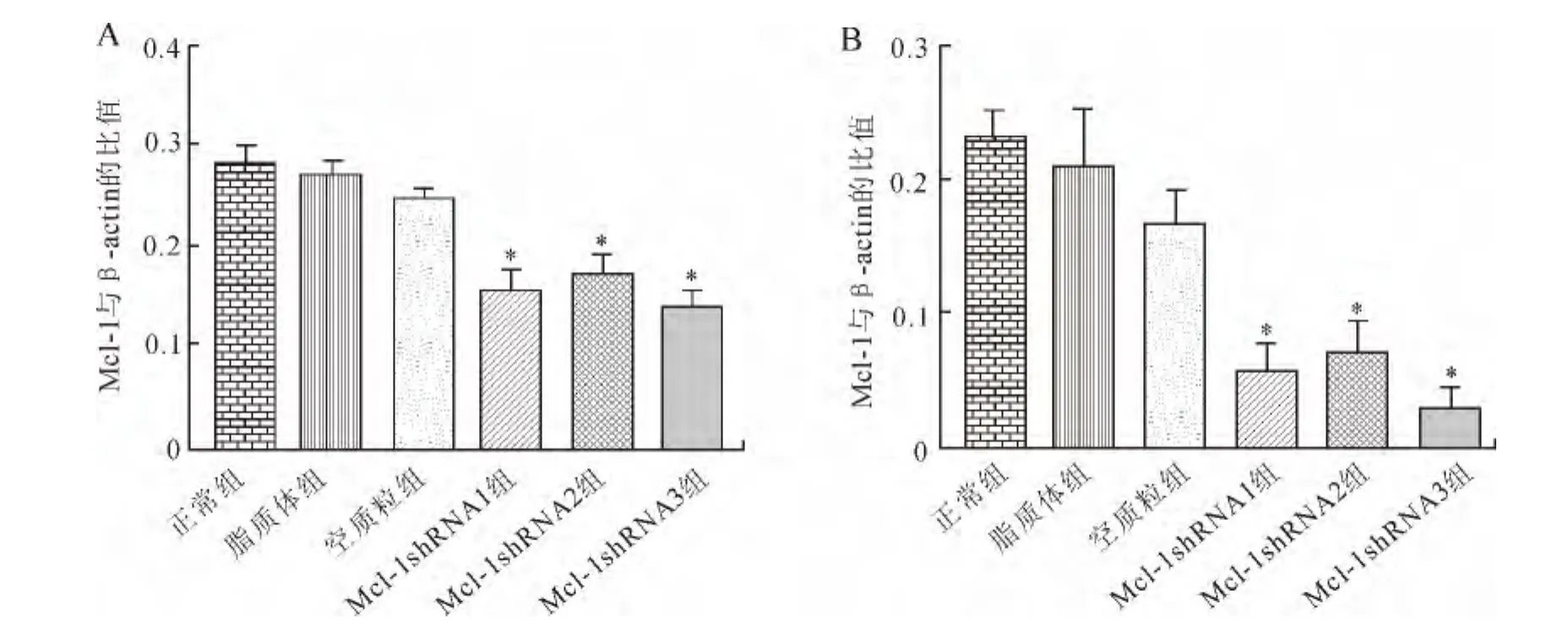
图4 真核表达质粒转染24、48h后Raw264.7细胞内Mcl-1mRNA的表达Fig.4 Mcl-1mRNA expression in Raw264.7cells 24hand 48hafter eukaryotic expression plasmid transfection
表2 转染24、48h后各实验组中Mcl-1蛋白的表达水平Tab.2 The level of Mcl-1protein expression at 24hand 48hafter transfection in the experimental groups(n=3,±s)

表2 转染24、48h后各实验组中Mcl-1蛋白的表达水平Tab.2 The level of Mcl-1protein expression at 24hand 48hafter transfection in the experimental groups(n=3,±s)
与正常组、脂质体组和阴性对照组相比,*P<0.05。
时间(h) 正常组 脂质体组 阴性对照组 Mcl-1shRNA1组 Mcl-1shRNA2组 Mcl-1shRNA3组24 0.905±0.056 0.850±0.028 0.823±0.039 0.698±0.048* 0.709±0.093* 0.668±0.074*48 0.747±0.145 0.711±0.946 0.708±0.245 0.454±0.084* 0.456±0.105* 0.379±0.063*
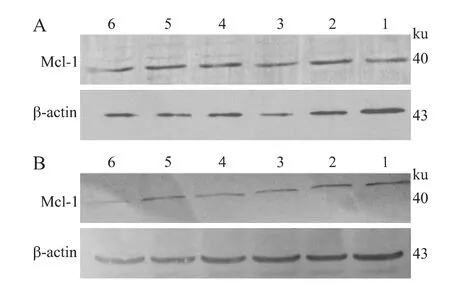
图5 转染24h(A)、48h(B)后Raw264.7细胞内 Mcl-1蛋白的表达情况Fig.5 Mcl-1protein expression in Raw264.7cells at 24h(A)and 48h(B)after transfection
3 讨 论
Mcl-1是 B细胞淋巴瘤基因-2(B cell lymphoma-2,bcl-2)家族成员之一,在结构和功能上与BCL-2相似,主要参与维持细胞线粒体膜稳定,抑制细胞色素C的释放,从而促进细胞的生存,阻止细胞的凋亡[4]。Mcl-1的半衰期较短,对细胞内外环境因素的变化能做出快速反应,被认为是细胞内重要的抗凋亡分子[5]。该蛋白作为一种重要的抗凋亡蛋白,参与了多种细胞系的凋亡、分化和细胞周期的调控,对细胞的生存与生长至关重要[6-7]。但早期研究表明,细菌感染时,巨噬细胞会上调抗凋亡Mcl-1基因的表达,感染消除时促凋亡的Mcl-1S表达上调,抑制凋亡的Mcl-1L表达下调,从而调节巨噬细胞使其凋亡增加,维持正常的细胞功能[8]。另有研究表明,结核分枝杆菌毒力株感染巨噬细胞后,能诱导凋亡抑制因子Mcl-1的表达上调[9]。众所周知,结核病是由结核分枝杆菌(mycobacterium tuberculosis,MTB)感染引起的一种世界性传染病,是单一致病菌感染导致死亡率最高的感染性疾病。MTB入侵后究竟是被清除还是诱导产生耐受与宿主共生,巨噬细胞扮演了重要角色[10-11]。而巨噬细胞作为机体防御系统的第1道屏障。一方面发挥着抵抗结核分枝杆菌的作用,另一方面是结核分枝杆菌体内滞留、造成潜伏感染的主要场所。而结核分枝杆菌是典型的胞内寄生菌,感染巨噬细胞后,结核分枝杆菌能在受感染的宿主细胞中增殖和存活。有研究报道称宿主巨噬细胞的凋亡能够减少分枝杆菌的生存能力,是机体抗结核菌胞内感染中先天性免疫反应中的一部分;另一方面,有若干研究证实了结核分枝杆菌毒力株能够抑制宿主巨噬细胞的凋亡[12]。总之,结核分枝杆菌和宿主巨噬细胞间的相互作用是结核发病机制的关键因素,宿主试图感知细胞内的病原体并诱导感染细胞死亡而病原体则隐藏在宿主细胞内抑制其死亡。因此,Mcl-1在结核分枝杆菌和巨噬细胞相互作用的过程中是否在凋亡中所起到作用是个值得探讨的重要问题。
由于巨噬细胞与结核分枝杆菌的相互作用对结核病的发生、发展、预后起着非常重要的作用。故本研究先进行细胞株的筛选,选取目前国际上常用的单核细胞株Raw264.7和THP-1,利用Western blot和半定量RT-PCR技术检测两种巨噬细胞中Mcl-1的蛋白表达和mRNA水平,结果显示,小鼠Raw264.7巨噬细胞Mcl-1蛋白及基因表达均高于人THP-1巨噬细胞(图1、2)。由此可见,不同的巨噬细胞都可以检测到不同程度的Mcl-1蛋白表达,并且不同的巨噬细胞Mcl-1表达存在差异。Raw264.7细胞是小鼠单核巨噬细胞白血病细胞,属于小鼠腹腔上皮细胞,在炎症反应、免疫反应和吞噬反应中发挥着关键的作用[11],其性质稳定、贴壁易养。目前,关于结核分枝杆菌感染宿主巨噬细胞的研究中,大量实验以小鼠RAW 264.7巨噬细胞作为研究对象[13-14]。故本实验筛选出表达Mcl-1较高的巨噬细胞小鼠Raw264.7作为协助研究结核与Mcl-1之间关系的桥梁,为后续的体外和小鼠体内实验鉴定了基础。
近年来,关于Mcl-1蛋白的研究主要集中在肿瘤的治疗应用中[15-16]。国内外均有研究报道,表明使用靶向Mcl-1基因的shRNA干扰肝癌细胞中的Mcl-1基因表达,既可以使肝癌细胞凋亡率增加,同时对正常的肝细胞无明显影响[17-18]。而RNA干扰现广泛存在于真核生物体中,是通过siRNA(small interference RNA,siRNA)介导的识别靶向切割同源性靶mRNA分子而沉默基因表达,是具有高度的序列专一性的转录后沉默[19]。由于siRNA在细胞内的半衰期短,易被降解,对靶基因的抑制效应短暂,而shRNA表达载体能在体内持续生成siRNA,可对靶基因产生较持久的沉默效应[20]。故本研究利用公司构建的靶向Mcl-1基因的shRNA表达载体来沉默Mcl-1基因,结果表明,所构建的3种shRNA表达载体经脂质体介导转染Raw264.7后,通过实时荧光定量PCR和Western blot检测证实对Mcl-1mRNA和蛋白水平均有显著的抑制作用,在24h和48h均能有效降低Mcl-1的表达水平(图4、5)。但是,本研究所构建的3个真核表达质粒对Mcl-1的干扰效果并不一致,其中以Mcl-1shRNA3抑制Mcl-1mRNA和蛋白表达的作用最为明显,转染Raw264.7细胞24h的抑制率分别达50%和26.2%;48h的抑制率分别达到86.3%和49.3%,均高于空白对照组、脂质体组和空质粒组;同时随着检测时间的延长,构建的真核表达质粒对Mcl-1的抑制率随之增强,并在48h达到高峰。这种针对同一基因的不同靶点而产生不同的干扰效果,提示RNA干扰具有一定的靶点效应[21]。同时,也说明利用RNA干扰进行相关研究前需首先要对干扰序列进行筛选。本研究对靶向Mcl-1 shRNA重组质粒进行了成功的筛选,为下一步研究Mcl-1基因沉默对增加结核分枝杆菌感染宿主巨噬细胞凋亡从而杀灭其中结核分枝杆菌的目的奠定了坚实的实验基础。
[1]CORY S,HUANG DC,ADAMS JM.The Bcl-2 family:roles in cell survival and oncogenesis[J].Oncogene,2003,22(53):8590-8607.
[2]HIDEKO A,HAJIME H,HIDETOSHI S,et al.Suppression of myeloid cell leukemia-1 (Mcl-1)enhances chemotherapy-associated apoptosis in gastric cancer cells[J].Gastric Cancer,2013,16(1):100-110.
[3]SLY LM,HINGLEY-WILSON SM,REINER NE,et al.Survival of Mycobacterium tuberculosis in host macrophages involves resistance to apoptosis dependent upon induction of antiapoptotic Bcl-2 family member Mcl-1[J].J Immunol,2003,170(1):430-437.
[4]SUN FE,FANG H.Progress in research of structure,function and inhibitors of Mcl-1 protein[J].Chin J Pharm,2013,44(3):296-302.
[5]HIDEKO A,HAJIME H,HIDETOSHI S,et al.Suppression of myeloid cell leukemia-1 (Mcl-1)enhances chemotherapy-associated apoptosis in gastric cancer cells[J].Gastric Cancer,2013,16(1):100-110.
[6]SIEGHART W,LOSERT D,STROMMER S,et al.McI-1 overexpression in hepatocellular carcinoma:A potential target for antisense therapy[J].J Hepatol,2006,44(1):151-157.
[7]PETROS AM,SWANN SL,SONG D,et al.Fragment-based discovery of potent inhibitors of the anti-apoptotic MCL-1 protein[J].Bioorgan Med Chem Lett,2014,24(6):1484-1488.
[8]MARTINS TB,PASI BM,LITWIN CM,et al.Heterophile antibody interference in a multiplexed fluorescent microsphere immunoassay for quantitation of cytokines in human serum[J].Clin Diagn Lab Immunol,2004,11(2):325-329.
[9]刘云霞,董伟杰,庹清章,等.结核分枝杆菌Hsp16.3对感染巨噬细胞凋亡的影响[J].石河子大学学报:自然科学版,2013,31(5):598-600.
[10]赵薇,芦晓红,裴秀英.小鼠Ccr2基因真核表达载体的构建及稳定转染细胞株的建立[J].细胞与分子免疫学杂志,2010,26(12):1214-1216.
[11]王婵,章乐.Mcl-1基因与巨噬细胞凋亡相关疾病的研究进展[J].中国人兽共患病学报,2013,29(11):1105-1108.
[12]李微,刘云霞,董伟杰,等.不同毒力结核分枝杆菌感染对巨噬细胞铁蛋白及铁转运蛋白表达的影响[J].细胞与免疫学杂志,2013,29(7):710-713.
[13]YAO N,DONG JT,WU F,et al.Correlation study between Hsp16.3 of Mycobacterium tuberculosis and the apoptosis of infected macrophages[J].J Pathogen Biol,2012,7(008):569-573.
[14]董伟杰,刘丹霞,李微,等.检测不同毒力结核分枝杆菌感染巨噬细胞的凋亡率及其凋亡蛋白caspase-3表达的时相性变化[J].中国免疫学杂志,2013,35(4):407-411.
[15]NIJHAWAN D,FANG M,TRAER E,et al.Elimination of Mcl-1 is required for the initiation of apoptosis following ultra-violet irradiation[J].Genes Dev,2003,17(6):1475-1486.
[16]MICHELS J,JOHNSON PW,PACKHAM G.Mcl-1[J].Int J Biochem Cell Biol,2005,37(2):267-271.
[17]李银鹏.Mcl-1特异性shRNA联合凋亡素治疗肝细胞癌的实验研究[D].华中科技大学,2009.
[18]OPFERMAN JT,IWASA KI,HONG CC,et al.Obligaterole of antiapoptotic Mcl-1 in the survival of hematopoietic stem cells[J].Science,2005,307(5712):1101-1104.
[19]GUNDA V,BUCUR O,VARNAU J,et al.Blocks to thyroid cancer cell apoptosis can be overcome by inhibition of the MAPK and PI3K/AKT pathways[J].Cell Death &Disease,2014,5(3):e1104.
[20]ASHITAL DG,DOUDNA JA.Structural insights into RNA interference[J].Curr Opin Struct Biol,2010,20(1):90-97.
[21]李银鹏,朱惠明,侯晓华.靶向mcl-1基因的shRNA真核表达质粒的构建与筛选[J].世界华人消化杂志,2008,16(26):2490-2495.
