姜黄素对内毒素诱导的血管平滑肌细胞Toll样受体4/NADPH氧化酶/活性氧信号通路及炎症因子释放的影响
2015-02-18翟海杰陶海龙白中乐
翟海杰,孟 哲,陶海龙,白中乐,闫 超,李 凌
(1.郑州大学第一附属医院心内科,河南郑州 450052;2.西安交通大学医学部第一附属医院心内科,陕西西安 710061)
姜黄为姜科草本植物姜黄的干燥根茎,其味辛、苦,性温,入肝脾二经,是一味常用的中药。姜黄素(curcumin,Cur)是姜黄发挥药理作用的重要化学成分[1],且具有药理作用广、毒性低[2]的特点。新近的研究表明,姜黄素通过影响包括转录因子、生长因子及细胞因子在内的多个靶向分子位点,调节细胞的增殖和凋亡[3]。此外,姜黄素也被证实具有抗炎、抗氧化、抗癌和心血管保护作用[4]。近年来,动脉粥样硬化炎症本质的学说已越来越受到瞩目,许多研究成果都支持炎症在动脉粥样硬化的发生发展中起重要作用[5]。Toll样受体(Toll-like receptor,TLR)家族是一类关键的病原模式识别受体,TLR4是其中重要成员之一。TLR4能够通过激活NADPH氧化酶在内的多个信号通路,上调TNF-α、IL-1、单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)等炎症因子的分泌,在调节天然免疫和炎症反应方面起到举足轻重的作用[6]。多种具有心血管活性的细胞表面均被证实有TLR4的表达。譬如,血管平滑肌细胞、巨噬细胞、T细胞和肥大细胞等[7]。本实验旨在观察姜黄素是否能够抑制内毒素(lipopolysaccharide,LPS)诱导的VSMCs炎症反应以及这种抗炎作用是否依赖或部分依赖于TLR4介导的NADPH氧化酶/ROS信号通路,以寻求姜黄素抗炎作用的细胞学机制,为其用于慢性炎症性疾病的临床治疗提供一定的实验依据。
1 材料与方法
1.1 主要试剂 DMEM高糖培养液(美国,Gibco公司);胎牛血清及Real-time PCR试剂盒(北京,Transgen公司);姜黄素(美国,Sigma公司,纯度为99%);使用二甲基亚砜(DMSO)将姜黄素制成高浓度储存液,再根据工作浓度,使用无血清DMEM高糖培养进行稀释;LPS、青霉素、链霉素、噻唑蓝(MTT)、2′,7′-二氯荧光素 二 脂 (2′,7′-Dichlorofluorescin diacetate,DCFHDA)、NADPH氧化酶抑制剂二苯基碘(diphenyleneiodonium,DPI)(美国,Sigma公司);TNF-α和IL-1 ELISA试剂盒(美国,Bio-Source International公司);兔抗鼠TLR4、anti-TLR4抗体及β-actin多克隆抗体(美国,Santa Cruz公司)。
1.2 细胞培养及处理 分离8~10周SD大鼠胸主动脉,仔细剥离血管内膜及外膜,剪碎至1~2mm3大小组织块。如文献所述[7],使用贴壁法培养。将细胞置于含150mL/L胎牛血清的高糖DMEM培养基中,其中含有100u/mL的青霉素和100μg/mL的链霉素,然后放入37℃、50mL/L CO2细胞培养箱中。待细胞融合至80%~90%时,用于以下实验。
1.3 实验分组 将细胞分为6组:A组(对照组)、B组(LPS干预组)、C组(LPS+姜黄素5μmol/L)、D组(LPS+姜黄素10μmol/L)、E组(LPS+姜黄素30 μmol/L)和F组(姜黄素30μmol/L)。以上B~E组中LPS的质量浓度均为500ng/mL。
1.4 MTT比色法测定不同浓度姜黄素的细胞毒性将细胞按5×104个/孔的密度接种于96孔板,按照前述细胞培养条件培养24h,改用2mL/L低血清培养基培养12h后,给予姜黄素 0、5、10、20、40、80 μmol/L浓度干预24h。吸去培养液,每孔加入MTT(5g/L)20μL,37℃孵育4h,弃去上清,每孔加入二甲基亚砜(DMSO)100μL,微微振荡数次后,在全自动酶标仪上于570nm处测定各组吸光度值。
1.5 ELISA测定上清液中TNF-α和IL-1的表达 将各组细胞以5×104个/孔的密度接种于96孔板中,不同浓度姜黄素或抗TLR4抗体、DPI及姜黄素与不同抑制剂联合使用预处理1h,再给予500ng/mL的LPS刺激不同时间后,收集各孔细胞上清液。依据操作说明,使用ELISA试剂盒测定IL-1和TNF-α的分泌。使用自动酶联免疫吸附仪在450nm处读取数值,绘制TNF-α和IL-1的标准曲线,并依据此计算各实验组结果。
1.6 实时定量PCR测定TLR4mRNA、p22phox mRNA的表达 将各组细胞以5×105个/孔的密度接种于6孔板中,加入含血清培养基,待细胞密度达到70%~80%融合时,改用无血清培养基孵育12h,换用不同浓度姜黄素预处理1h,再给予500ng/mL的LPS刺激6h,按照说明书使用Transzol(Transgen公司,北京)提取各组总RNA。使用10g/L琼脂糖凝胶电泳鉴定RNA完整性,分光光度计在260nm处检测RNA的纯度。按照逆转录试剂盒(Transgen公司,北京)操作步骤,将各组mRNA反转录为cDNA。使用PrimerPremier7.0软件设计Real-time PCR引物,由南京金丝瑞公司合成,序列如表1所示。PCR扩增条件:95℃预变性5min,95℃15s,55℃退火15s,72℃延伸30s,共计40个循环。使用Bio-Rad IQ7荧光PCR仪自带分析软件对Realtime PCR结果进行分析。

表1 Real-time PCR引物Tab.1 Primers used for real-time PCR
1.7 Western-blot检测TLR4蛋白及p22phox蛋白的表达 以5×105个/孔的密度将细胞接种于6孔板中,加入含血清培养基,待细胞密度达到80%~90%融合时,改用无血清培养基孵育12h。换用含不同浓度姜黄素无血清培养基孵育1h后,加入LPS(500ng/mL)刺激12h。每孔使用150μL RIPA 裂解液提取蛋白。BCA蛋白定量试剂盒测定各组样品蛋白浓度。加入蛋白上样缓冲液并煮沸后,制作100 g/L SDS-PAGE凝胶进行电泳,半干转膜仪转膜。一抗浓度为:TLR4(1∶200)、p22phox(1∶200)和βactin(1∶2 000)。以β-actin作为内参照。化学发光法检测,图像采集,Quantity one软件进行图像分析。
1.8 血管平滑肌细胞内活性氧物质水平的测定 将各组细胞以5×104个/孔的密度接种于96孔板中,不同浓度姜黄素预处理1h再给与500ng/mL的LPS刺激,30min后严格按照试剂盒说明书步骤用DCFH-DA对细胞内ROS物质进行荧光标记,流式细胞仪检测每组细胞内的荧光强度,激发光波长为488nm,检测波长为540~560nm。
1.9 统计学分析 使用SPSS 17.0软件进行统计学分析。计量数据用均数±标准差(±s)表示,组间比较使用单因素方差分析,多重均数比较使用SNK-q检验 ,P<0.05表示差异有统计学意义。
2 结 果
2.1 不同浓度姜黄素对细胞活性的影响 为了排除姜黄素可能的细胞毒性导致对后续试验的影响,我们使用MTT法测定不同浓度(0~80μmol/L)姜黄素对细胞毒性作用。结果显示,在0~80μmol/L浓度范围内,姜黄素未显示明显的细胞毒性。因此,后续的实验中选取5、10、30μmol/L浓度进行干预(图1)。
2.2 姜黄素对LPS诱导的VSMCs细胞分泌TNF-α和IL-1的影响 给予细胞500ng/mL LPS刺激24h后,TNF-α和IL-1分泌明显升高。给予不同浓度姜黄素预处理1h后,TNF-α和IL-1分泌显著下降,并呈剂量依赖性。仅给予VSMCs姜黄素(30μmol/L)孵育24h,TNF-α和IL-1表达无明显变化(图2)。

图1 不同浓度姜黄素对细胞活性的影响Fig.1 Effects of different concentrations of curcumin on VSMCs activity
2.3 姜黄素对LPS诱导的VSMCs细胞TLR4mRNA和蛋白表达的影响 500ng/mL LPS刺激VSMCs 6h和12h后,TLR4mRNA和蛋白表达均明显升高。使用不同浓度姜黄素预处理1h后,再给予相同浓度LPS刺激6h和9h后,较之单纯LPS刺激组,TLR4 mRNA及蛋白表达显著下降,且各组间具有统计学差异(P<0.05,图3)。仅给予 VSMCs姜黄素(30 μmol/L)孵育24h,不影响 TLR4mRNA和蛋白表达(图3)。
2.4 姜黄素对LPS诱导的VSMCs细胞p22phox mRNA和蛋白表达的影响 500ng/mL LPS刺激VSMCs 6h和12h后,p22phox mRNA 和蛋白表达均明显升高。使用不同浓度姜黄素预处理1h后,再给予相同浓度LPS刺激6h和9h后,较之单纯LPS刺激组,p22phox mRNA及蛋白表达显著下降(P<0.05,图4)。仅给予 VSMCs姜黄素(30μmol/L)孵育24h,不影响p22phox mRNA和蛋白表达(图4)。

图2 姜黄素抑制LPS诱导的VSMCs TNF-α(A)和IL-1(B)的表达Fig.2 Curcumin inhibited the expressions of TNF-α(A)and IL-1(B)in LPS-stimulated VSMCs
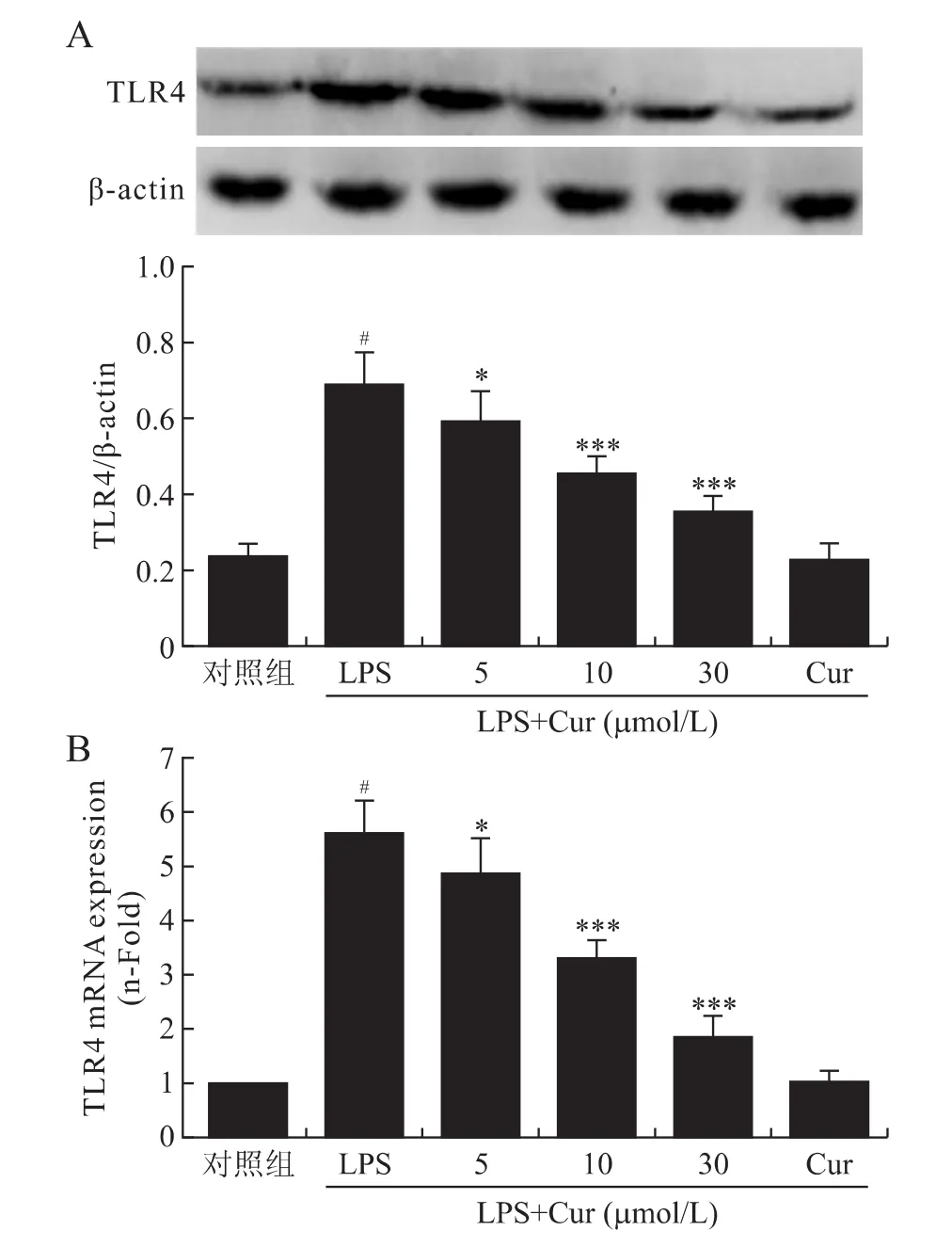
图3 姜黄素抑制LPS诱导的VSMCs TLR4蛋白(A)和mRNA(B)的表达Fig.3 Curcumin inhibited the protein(A)and mRNA (B)expression of TLR4in LPS-stimulated VSMCs
2.5 姜黄素对LPS诱导的VSMCs细胞ROS的影响给予VSMCs无血清培养基孵育12h后,各组细胞内ROS水平无统计学差异(P>0.05)。500ng/mL LPS刺激30min后,ROS水平明显升高(P<0.01);当给予不同浓度姜黄素预处理1h后,能够显著抑制LPS诱导的 ROS水平(P<0.05,图5)。仅给予VSMCs姜黄素(30μmol/L)刺激30min,不影响ROS合成(P<0.05,图5)。

图4 姜黄素抑制LPS诱导的VSMCs p22phox蛋白(A)和mRNA(B)的表达Fig.4 Curcumin inhibited the protein(A)and mRNA (B)expression of p22phox in LPS-stimulated VSMCs
2.6 姜黄素、抗TLR4抗体及DPI对LPS诱导VSMCs炎症因子表达的影响 分别给以VSMCs姜黄素(30μmol/L)、抗TLR4抗体(5μg/mL)、DPI(20 μmol/L)、姜 黄 素 (30μmol/L)+ 抗 TLR4 抗 体(5μg/mL)和姜黄素(30μmol/L)+DPI(20μmol/L)预处理1h后,加入LPS(500ng/mL)培养24h。结果显示,姜黄素、抗TLR4抗体和DPI均可以有效抑制LPS诱导的VSMCs TNF-α和IL-1表达;姜黄素与抗TLR4抗体或DPI联用能够进一步降低TNF-α和IL-1表达(P<0.05,图6)。

图5 姜黄素抑制LPS诱导的VSMCs ROS合成Fig.5 Curcumin inhibited the production of ROS in LPS-stimulated VSMCs
3 讨 论
动脉粥样硬化(atherosclorosis,AS)是一种慢性炎症反应,LIBBY曾强调炎症反应在AS斑块尤其是不稳定斑块破裂中的重要性[8],斑块破裂易导致血栓形成引起心血管急性事件。LPS是格兰阴性菌细胞壁的重要组成成分,它可刺激细胞过度分泌MCP-1、TNF-α、IL-1及IL-6等炎症因子,促进炎症反应的发生与进展[9-10]。Toll样受体家族是一类重要的病原模式识别受体,通过识别自身及非自身分子模式调控天然免疫、抗原提呈和获得性免疫等多个免疫环节[11]。TLR4作为其中重要的一员,也是LPS的关键受体之一,LPS通过与TLR4结合后激活其下游信号通路,促进炎症因子释放,从而扩大炎症反应。EDFELDT等[12]发现,在人类的粥样斑块中存在着TLR4的高表达。在5~40周龄的ApoE-/-小鼠粥样斑块内发现,TLR4的表达随着年龄的增长而升高[13]。同样给予 TLR4基因敲除和非敲除的ApoE-/-小 鼠 12周 高 脂 饮 食,TLR4 基 因 敲 除ApoE-/-小鼠显示出较小的斑块面积和较少的炎性细胞浸润[14]。以上研究表明,TLR4介导的炎症反应参与了粥样斑块的病变过程,TLR4可能成为一个新的粥样病变治疗靶点。已观察到ROS参与TLR4介导的炎症信号传导途径[15]。BOLWELL(1997)发现NADPH氧化酶主要包括质膜亚基和胞质亚基,正常情况下,这两个亚基是分开的,当细胞受刺激时,这两个亚基组装成全酶分子,具有生物活性。因此,通过O2获得电子生成超氧阴离子,再由超氧阴离子衍生出其它活性氧分子,因而NADPH氧化酶被称为产生ROS的心脏[16]。p22phox是NADPH氧化酶复合体的一种蛋白,为NADPH氧化酶的活性的必需亚单位。其mRNA及其蛋白的相应变化可在一定程度上反映NADPH氧化酶的活性。我们在实验中发现,给予VSMCs细胞LPS刺激后,TLR4mRNA和蛋白表达显著增加,同时伴有炎症因子的分泌升高。此外,p22phox mRNA和蛋白、ROS水平明显升高,提示NADPH氧化酶/ROS信号通路激活可能参与了LPS诱导的VSMCS细胞炎症反应。

图6 姜黄素、抗TLR4抗体及DPI对LPS诱导VSMCs炎症因子表达的影响Fig.6 The effects of curcumin,anti-TLR4antibody and DPI on the expressions of TNF-αand IL-1in LPS-stimulated VSMCs
姜黄素是从姜科植物姜黄中提取的一种色素,通过影响细胞内多条信号通路传导,起到抗氧化、抗炎、抗凝、降脂、抗动脉粥样硬化、抗衰老消除自由基及抑制肿瘤生长等多项保护作用。本研究中我们使用姜黄素预处理VSMCs后,再进行LPS刺激,TNF-α和IL-1分泌显著减少并具有剂量依赖性,说明姜黄素可以有效地抑制LPS诱导的VSMCs细胞的炎症反应。在给予LPS刺激的VSMCs细胞姜黄素预处理后,发现TLR4mRNA和蛋白表达水平显著下降,提示姜黄素可以有效地抑制TLR4的活性。为了进一步探究NADPH氧化酶/ROS信号通路在姜黄素抗炎作用中的作用,我们测定了p22phox mRNA和蛋白水平、ROS水平。结果显示,同单纯LPS刺激组相比,姜黄素干预组可以有效地抑制他们的表达。在VSMCs细胞内,姜黄素能够显著抑制LPS诱导的NADPH氧化酶/ROS信号通路。为了更好地阐述LPS诱导的VSMCs中炎症反应与TLR4/NADPH氧化酶/ROS通路的相关性,设立分别加入抗TLR4抗体、DPI的实验以及抗TLR4抗体或DPI与姜黄素联合使用的实验。结果显示,姜黄素组、抗TLR4抗体组、DPI组较单纯LPS刺激组,TNF-α和IL-1的浓度降低;姜黄素+抗TLR4抗体、姜黄素+DPI组较姜黄素+LPS组炎症因子明显降低;姜黄素与抗TLR4抗体、DPI具有协同作用。在VSMCs细胞内,姜黄素能够显著抑制LPS诱导TLR4介导的NADPH氧化酶/ROS信号通路的过程。
综上所述,姜黄素可以有效地拮抗LPS刺激VSMCs细胞所致的TNF-α和IL-1的分泌,抑制LPS诱导的TLR4的过表达及其下游NADPH氧化酶/活性氧信号通路的表达,并且姜黄素对LPS诱导的VSMCs炎症反应的保护作用可能依赖或部分依赖于TLR4介导的NADPH氧化酶/ROS信号通路。本结果可为临床使用姜黄素用于抗炎及抗粥样硬化等提供一定的理论依据。
[1]赵鹏,蔡辉.姜黄素药理作用研究进展[J].中医药临床杂志,2012,24(4):380-382.
[2]乔明艳.国内姜黄素制剂学研究概述[J].天津药学,2010,22(4):48-49.
[3]GOEL A,KUNNUMAKKARA AB,AGGARBWAL BB.Curcumin as “Curecumin”:from kitchen to clinic[J].Biochem Pharmacol,2008,75(4):787-809.
[4]余美荣,蒋福升,丁志山.姜黄素的研究进展[J].中草药,2009,40(5):828-831.
[5]朱明慧,杨谊,刘旭华,等.3种炎症因子在亚临床动脉粥样硬化中的应用价值[J].河南医学研究,2011,20(4):421-423.
[6]DREXLER SK,FOXWELL BM.The role of toll-like receptors in chronic inflammation[J].Int J Biochem Cell Biol,2010,42(4):506-518.
[7]AKIRA S,HEMMI H.Recognition of pathogen-associated molecular patterns by TLR family[J].Immunol Lett,2003,85(2):85-95.
[8]霍志芳,陈魁,阎西艴,等.冠心病患者血清趋化因子和白细胞介素-18水平分析[J].郑州大学学报:医学版,2011,46(5):717-719.
[9]GUHA M,MACKMAN N.LPS induction of gene expression in human monocytes[J].Cell Signal,2001,13(2):85-94.
[10]SHIH MF,CHENG YD,SHEN CR,et al.A molecular pharmacology study into the anti-inflammatory actions of Euphorbia hirta L.on the LPS-induced RAW264.7 cells through selective iNOS protein inhibition[J].J Nat Med,2010,64(3):330-335.
[11]孟哲,闫超,高登峰,等.姜黄素对内毒素诱导的血管平滑肌细胞Toll样受体4信号通路及炎症因子释放的影响[J].西安交通大学学报:医学版,2013,34(4):524-528.
[12]EDFELDT K,SWEDENBORG J,HANSSON GK,et al.Expression of toll-like receptors in human atherosclerotic lesions:apossible pathway for plaque activation[J].Circulation,2002,105(10):1158-1161.
[13]SCHONEVELD AH,HOEFER I,SLUIJTER JP,et al.Atherosclerotic lesion development and Toll like receptor 2 and 4 responsiveness[J].Atherosclerosis,2008,197(1):95-104.
[14]MULLICK AE,TOBIAS PS,CURTISS LK.Toll-like receptors and atherosclerosis:key contributors in disease and health?[J].Immunol Res,2006,34(3):193-209.
[15]YANG FL,YANG YL,LIAO PC,et al.Structure and immunological characterization of the capsular polysaccharide of a pyrogenic liver abscess caused by Klebsiella pneumoniae:activation of macrophages through Toll-like receptor 4[J].J Biol Chem,2011,286(24):21041-21051.
[16]师瑞红,谢国生.生物体活性氧的产生和信号转导研究[A]//中国植物生理学会、武汉大学、清华大学(新竹).2005海峡两岸植物生理与分子生物学教学研讨会论文集[C].中国植物生理学会、武汉大学、清华大学(新竹),2005.
