sCD14在痛风性关节炎患者炎症反应中的变化及其意义
2015-02-18党万太谢文光周京国
党万太,王 婧,谢文光,周京国
(1.川北医学院附属医院风湿免疫研究所,四川南充 637000;2.成都中医药大学临床医学院,四川成都 610075;3.甘肃中医学院,甘肃兰州 733005)
痛风(gout)是一种单钠尿酸盐(monosodium urate,MSU)沉积所致的晶体相关性关节病,与嘌呤代谢紊乱及(或)尿酸排泄减少所致的高尿酸血症直接相关,属于代谢性风湿病范畴[1]。研究发现,除代谢因素外,免疫与炎症也参与痛风的发病,尤其是固有免疫(innate immunity)在痛风的急性炎症发生发展过程中发挥着重要作用[2]。CD14即LPS(lipopolysacharide)受体,最初是一种存在于巨噬细胞、单核细胞等细胞表面的白细胞分化抗原[3]。CD14属于固有免疫反应系统的模式识别受体,在体内以2种形式存在:膜CD14(membrane CD14,mCD14)和可溶性CD14(sCD14)。sCD14是CD14分子在体内的主要存在形式,是调控LPS作用于非髓样细胞的重要介质。血浆中的sCD14能特异性识别、结合LPS或LPS/脂多糖结合蛋白(lipopolysaccharide binding protein,LBP)复合物,递呈给 Toll样受体(Toll like receptors,TLRs),TLR通过IL-1信号转导通路中的信号分子髓样分化因子(myeloid differentiation factor 88,MyD88)、端粒重复序列结合蛋白(telomeric-repeat binding factor 6,TRF6)等间的相互作用,激活核因子κB(nuclear factor-kappa,NF-κB)信号转导通路,引起多种炎性细胞因子的合成与分泌,最终导致过度的全身炎症反应及组织器官损伤[4]。已有研究显示,sCD14在炎性肠病等多种疾病中发挥重要的作用[5-6]。然而,sCD14在痛风性关节炎患者炎症反应中的作用仍不清楚。本研究通过qRT-PCR法检测GA患者PBMCs的CD14mRNA表达水平,并结合相关实验及临床指标进行分析,探讨sCD14在痛风性关节炎患者炎症反应中的变化及其意义。
1 对象与方法
1.1 临床资料 应用1977年美国风湿病协会(ACR)痛风诊断标准[6],排除肾脏、心血管、血液疾病引起的继发性痛风,排除合并感染或自身免疫性疾病者。收集2012年9月至2013年8月川北医学院附属医院风湿门诊和住院的31例急性痛风性炎节炎(acute gouty arthritis,AGA)患者、23例非 AGA(non-acute gouty arthritis,NAGA)患者,均为男性,年龄22~79(44±13)岁,病程1~21(8±4)年。健康对照(healthy control,HC)组为20名同期在川北医学院附属医院体检的健康男性,年龄24~62(40±9)岁,入选者实验室指标均无异常且无心血管系统疾病、糖尿病、肝脏疾病及痛风等病史,并排除感染及自身免疫性疾病。各组人群年龄差异无统计学意义。该实验通过当地伦理委员会的同意与支持,所有参与者均签订知情同意书。
1.2 主要试剂与仪器 PrimeScript RT reagent Kit With gDNA Eraser(Perfect Real Time)试剂盒、SYBR®Premix Ex TaqTMⅡ(日本 TaKaRa公司),IL-1β(北京四正柏生物科技有限公司),TNF-αELISA Kit试剂盒(博士德生物工程有限公司),Quantikine®ELISA Human sCD14(R&D Systems USA),Beckman-Coulter原装CRP试剂(Beckman-Coulter公司),BECKMAN特种蛋白分析仪(IMMAGE800,BECKMAN COULTER,USA),7900实时PCR仪(ABI公司,USA)。
1.3 实时荧光定量PCR检测CD14mRNA的表达变化 实时荧光定量PCR检测的基因引物设计依据GenBank中人肌动蛋白(β-actin)、CD14,由南京金斯瑞生物科技有限公司合成。β-actin上游引物:5′-GTAGTTTCGTGGATGCCACAG-3′,下 游 引 物:5′-GAGCTACGAGCTGCCTGACG-3′,片段大小120bp;CD14上游引物:5′-TGAACTCCCTCAATCTGTCGT-3′,下 游 引 物:5′-CCCGTCCAGTGTCAGGTTAT-3′,片段大小152bp。
取外周静脉血2.5mL,用肝素钠抗凝。用人淋巴细胞分离液(Ficoll)无菌分离PBMCs,严格按照说明书操作提取PBMCs的总RNA,并进行电泳检测RNA完整性。cDNA的合成严格按照逆转录试剂盒说明书操作,条件为37℃15min,85℃5s终止反应。将逆转录的cDNA在ABI 7900实时PCR仪上进行检测,20μL的反应体系:SYBR®Premix Ex TaqTMⅡ10μL,ROX Reference DyeⅡ0.4μL,上、下游引物各(10μmol/L)0.8μL,灭菌蒸馏水6μL,反应条件为:95℃10min,95℃15s,60℃1min,共40个循环。以2-△△Ct值进行统计分析目的基因mRNA表达水平。
1.4 ELISA检测血清sCD14、IL-1β、TNF-α、IL-6 ELISA Kit检测严格按照操作说明进行,各孔用酶标仪在450nm测定吸光度值,用试剂盒标准品制作标准曲线,根据样品的吸光度值在坐标上找出对应的浓度,样品最终浓度=所测浓度×稀释倍数。
1.5 收集临床实验指标及检测方法 所有受试者禁食12h,于清晨采集肘静脉血,用XE-5000全自动血液分析仪检测血常规,包括白细胞计数(white blood count,WBC)、嗜中性粒细胞绝对值(granulocyte,GR)、淋巴细胞绝对值(lymphocyte,LY)、单核细胞绝对值(monocyte,MO);用日立7600-020全自动生化分析仪检测血尿酸(uric acid,UA),血清CRP检测采用免疫比浊法。
1.6 统计学分析 采用SPSS 19.0统计软件进行统计分析,各组实验数据采用±s表示,组间比较采用单因素方差分析(One-way ANOVA)(各组间数据若不符合正态分布,采用秩变换进行转换),组间两两比较采用最小显著差数法(LSD),各组间的相关分析采用Spearman相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 各组PBMCs的CD14mRNA表达 各组PBMCs的RNA提取效果良好(图1A)。AGA组患者PBMCs的CD14mRNA表达量高于HC组,差异有统计学意义(P<0.05),NAGA组表达与HC组相比较,差异无统计学意义(P>0.05,图1B、图1C)。

图1 各组PBMCs的CD14mRNA表达Fig.1 Expression of CD14mRNA in PBMCs in gouty arthritis
2.2 各组血浆sCD14、CRP、IL-1β、TNF-α蛋白的表达AGA组血浆sCD14蛋白水平高于HC和NAGA组,但NAGA组低于HC组,差异均有统计学意义(分别P<0.01,P<0.05,图2A);AGA组CRP蛋白表达高于HC与NAGA组,差异有统计学意义(P<0.01,图2B);AGA、NAGA组血浆IL-1β、TNF-α蛋白表达均高于HC组,且AGA组IL-1β蛋白表达显著高于NAGA组,差异均有统计学意义(P均<0.01,图2C)。
2.3 各临床指标的比较 AGA组和NAGA组WBC均高于HC组,差异均有统计学意义(分别P<0.01,P<0.05,图3A);AGA组GR、MO均高于 HC组,AGA组患者MO高于NAGA组,差异均有统计学意义(P均<0.05,图3A);AGA与NAGA组UA均高于HC组,差异有统计学意义(P<0.01,图3B);AGA与NAGA组LY与HC组相比较,差异均无统计学意义(P>0.05)。
2.4 CD14mRNA表达与其临床实验指标的相关性AGA组PBMCs的CD14mRNA表达与IL-1β呈正相关(rs=0.362,P=0.045),与 WBC、GR、LY、MO、UA、CRP、TNF-α均未见相关性(P>0.05);NAGA与 HC组PBMCs的 CD14mRNA 表达与 WBC、GR、LY、MO、CRP、IL-1β、TNF-α均未见相关性(P>0.05)。

图2 各组血浆sCD14(A)、CRP(B)和IL-1β、TNF-α(C)表达Fig.2 The expressions of sCD14(A),CRP(B),IL-1βand TNF-α(C)in the plasma of gouty arthritis patients(±s)
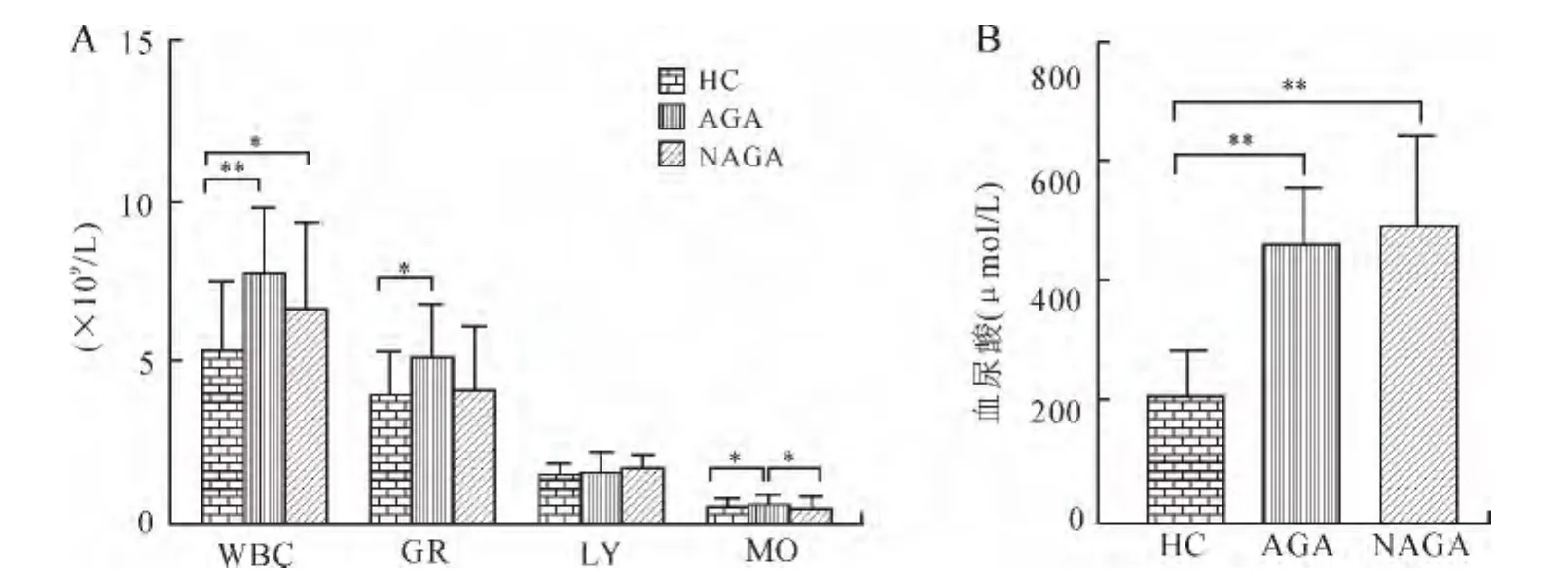
图3 各组血常规与血尿酸检测指标的比较Fig.3 Comparison of blood routine(A)and UA(B)in gouty arthritis patients(±s)
2.5 血浆sCD14蛋白表达与其临床实验指标的相关性 NAGA组血浆sCD14蛋白表达与GR呈正相关(rs=0.397,P=0.030);AGA 与 HC 组血浆sCD14蛋白表达与 WBC、GR、LY、MO、UA、CRP、IL-1β、TNF-α均未见相关性(P>0.05);NAGA组血浆sCD14蛋白表达与 WBC、LY、MO、UA、CRP、IL-1β、TNF-α均未见相关性(P>0.05)。
3 讨 论
近年来,痛风的发病率呈明显增高的趋势,已引起了医学界的高度重视[7],有研究表明炎症与免疫在痛风发病过程中发挥重要作用[2]。研究表明,MSU晶体主要通过识别细胞表面受体而激活细胞,启动炎症反应[8]。固有免疫的 Toll样受体2(Toll-like receptor 2,TLR2)与 Toll样受体4(Toll-like receptor4,TLR4)可协助MSU晶体识别并激活巨噬细胞[9]。MSU 晶体可能通过激活 TLRs,或 CD16、CD14等使TLRs激活介导炎症反应[10]。研究已证实,痛风患者外周血IL-1β明显升高[11],IL-1β通过与IL-1受体结合激活IL-1信号通路和MyD88依赖的NF-κB信号转导通路,引起大量的IL-1β、TNF-α、IL-8等促炎因子表达,产生炎症级联放大效应[12]。本研究结果显示,GA患者急性期PBMCs的CD14 mRNA表达量显著高于健康对照组,而GA患者非急性期较健康对照差异无统计学意义;进一步检测血浆sCD14蛋白表达,结果显示GA患者急性期表达显著高于健康对照与非急性期组。这提示CD14在痛风的急性炎症反应中可能发挥重要调控作用。已知sCD14是2级急性蛋白(LBP是1级急性蛋白),IL-1β可抑制sCD14的表达,而IL-6则促进其表达[13],且有研究显示sCD14是体内固有的LPS和TNF-α的拮抗剂[14]。本研究发现,GA患者急性与非急性期IL-1β、TNF-α表达均显著高于健康对照组,提示sCD14在痛风的炎症反应中可能发挥双向调控作用,其机制可能与sCD14对PBMCs的双重调节效应相关[15],该机制同时可能与痛风炎症反应的自限性相关[16]。
本研究检测并分析GA患者 WBC、GR、MO、UA,结果显示,除GA患者非急性期GR与健康对照相比较差异无统计学意义外,GA患者急性期的WBC、GR、MO、UA均显著高于健康对照组,且GA非急性期组MO显著低于急性期组,表明在GA患者的病变过程中炎症反应较为显著。值得注意的是,本研究对实验相关指标进行相关性分析后发现,AGA患者PBMCs的CD14mRNA表达与IL-1β呈正相关,AGA患者血浆sCD14表达与NAGA患者GR呈正相关,提示CD14可能参与GA患者炎症的发生并发挥重要的调控作用,其机制有待进一步研究。
[1]RICHETTE P,BARDIN T.Gout[J].Lancet,2010,375(9711):318-328.
[2]AKAHOSHI T.Pathological mechanisms of gouty arthritis[J].Nihon Rinsho,2008,66(4):705-710.
[3]TODD RF,NADLER LM,SCHLOSSMAN SF.Antigens on human monocytes identified by monoclonal antibodies[J].J Immunol,1981,126(4):1435-1442.
[4]HEUMANN D,ROGER T.Initial responses to endotoxins and Gram-negative bacteria[J].Clin Chim Acta,2002,323(1-2):59-72.
[5]KLEIN W,TROMM A,GRIGA T,et al.Interaction of polymorphisms in the CARD15 and CD14 genes in patients with Crohn disease[J].Scand J Gastroenterol,2003,38(8):834-836.
[6]WALLACE SL,ROBINSON H,MASI AT,et al.Preliminary criteria for the classification of the acute arthritis of primary gout[J].Arthritis Rheum,1977,20(3):895-900.
[7]ZENG QY,CHEN R,DARMAWAN J,et al.Rheumatic diseases in China[J].Arthritis Res Ther,2008,10(1):R17.
[8]TRAN TH,PHAM JT,SHAFEEQ H,et al.Role of interleukin-1inhibitors in the management of gout[J].Pharmacotherapy,2013,33(7):744-753.
[9]PETER S,RULB,ANYA S,et al.Innate immunity conferred by Toll-like receptors 2 and4 and myeloid differentiation factor 88 expression is pivotal to monosodium urate monohydrate crystalnduced inflammation[J].Arthritis Rheum,2005,52(9):2936-2946.
[10]SCOTT P,MA H,VINIYALKOSOL S,et al.Engagement of CD14 mediates the inflammatory potential of monosodium urate crystals[J].J Immunol,2006,177(9):6370-6378.
[11]GIAMARELLOS-BOURBOULIS EJ,MOUKTAROUDI M,BODAR E,et al.Crystals of monohydrate enhance lipopolysaccharide-induced release of interleukin 1βby mononuclear cells through a caspase 1-mediated process[J].Ann Rheum Dis,2009,68(2):273-278.
[12]DINARELLO CA.Blocking interleukin-1βin acute and chronic autoinflammatory diseases[J].J Intern Med,2011,269(1):16-28.
[13]SCHUMANN RR,KIRSCHNING CJ,UNBEHAUN A,et al.The lipopolysaccharide-binding protein is a secretory class 1 acute-phase protein whose gene is transcriptionally activated by APRF/STAT/3 and other cytokine-inducible nuclear proteins[J].Mol Cell Biol,1996,16(7):3490-3503.
[14]KIM KN,WATANABE S,MA Y,et al.Viral IL-10 and soluble TNF receptor act synergistically to inhibit collagen-induced arthritis following adenovirus-mediated gene transfer[J].J Immunol,2000,164(3):1576-1581.
[15]MARCHANT A,DUCHOW J,DELVILLE JP,et al.Lipopolysaccharide induces up-regulation of CD14 molecule on monocytes in human whole blood[J].Eur J Immunol,1992,22(6):1663-1665.
[16]CHEN YH,HSIEH SC,CHEN WY,et al.Spontaneous resolution of acute gouty arthritis is associated with rapid induction of the anti-inflammatory factors TGFβ1,IL-10 and soluble TNF receptors and the intracellular cytokine negative regulators CIS and SOCS3[J].Ann Rheum Dis,2011,70(9):1655-1663.
