利用患者骨髓瘤细胞建立NOD/SCID小鼠多发性骨髓瘤模型
2015-02-18林全德YACCOBYShmuel房佰俊宋永平
林全德,凌 雯,李 新,YACCOBY Shmuel ,房佰俊,黄 昊,宋永平
(1.郑州大学附属肿瘤医院,河南省肿瘤医院血液科,河南郑州 450008;2.阿肯色大学医学院多发性骨髓瘤研究所,美国,阿肯色州,小石城 72205)
多发性骨髓瘤(multiple myeloma,MM)是一种来源于浆细胞的恶性肿瘤,临床以血清或尿中出现单克隆球蛋白、高钙血症、肾功能损害、贫血和骨质破坏等为主要特征,虽然硼替佐米、来那度胺等新的靶向药物的应用使其生存率得到提高,但患者最终仍会复发,目前被认为是一种不可治愈的恶性血液病[1-3]。随着多发性骨髓瘤发病机制研究的进展,针对其靶向治疗药物的研究也日渐增多,而药物的体内研究也至为关键。由于人体试验所涉及的医学伦理问题,因此人源化小鼠骨髓瘤模型对于多发性骨髓瘤的生物学特性及药物体内试验等研究尤为重要[4]。本研究通过经兔骨植入的NOD/SCID小鼠局部兔骨注射患者浆细胞成功建立多发性骨髓瘤发病小鼠模型,现报道如下。
1 材料与方法
1.1 主要试剂及仪器 淋巴细胞分离液购自美国Gbico公司;CD138磁珠购自德国Miltenyi-Biotec公司;CD38、CD45单抗购自美国BD公司;1640培养液购自美国Corning Cellgro公司;D-荧光素购自美国PerkinElmer公司;免疫组化用CD38、CD138、CD45、IgG、IgA、κ、λ抗体购自美国 Abcam 公司;Auto-MACs磁珠分选仪为德国Miltenyi-Biotec公司产品;流式细胞仪为美国BD公司产品;Xenogen IVIS 200成像系统为美国PerkinElmer公司产品。
1.2 实验动物 雌性NOD/SCID小鼠(购自美国Harlan Sprague Dawley公司)48只,无特定病原体(SPF)级,4~6周龄,于阿肯色大学医学院骨髓瘤研究所实验动物饲养中心SPF级无菌层流动物饲养系统中饲养,垫料及饲养笼高温消毒,隔日更换,饲料及饮用水均经过无菌处理。3~4周龄新西兰大白兔(购自美国Thompson Station公司)于普通动物房中饲养。
1.3 兔骨植入 取上述新西兰大白兔,通过腹腔注射大剂量巴比妥纳注射液进行安乐死,无菌取股骨及胫骨,分离肌肉与软骨组织,沿骨头中部轻柔环向截断。取NOD/SCID小鼠,腹腔注射巴比妥纳注射液麻醉,750mL/L乙醇消毒后颈部皮肤,沿后颈部中线进行切口,直径约5mm,分离后背部皮肤;将分离后兔骨中心端朝小鼠尾方向经后颈部皮肤切口缓慢植入后背部皮下,采用一次性无菌手术钉钳夹切口,750mL/L乙醇消毒切口处,待NOD/SCID小鼠苏醒后送返SPF级无菌层流动物饲养系统中饲养。
1.4 多发性骨髓瘤细胞的分选 所用骨髓标本收集于2013年10月至2014年4月于美国阿肯色大学医学院骨髓瘤研究所就诊的初治多发性骨髓瘤患者,共收集12例骨髓标本,患者中位年龄48岁(32~67岁),其中男性7例,女性5例,IgGκ型6例,IgGλ型3例,IgAλ型2例,IgAκ型1例。诊断标准参照NCCN多发性骨髓瘤诊疗标准2013版[5];分期参照ISS分期系统,其中,Ⅲ期患者8例,Ⅱ期患者4例。所有患者在骨髓采集前均签署知情同意书。骨髓标本肝素抗凝,采用淋巴细胞分离液分离制备骨髓单个核细胞(bone marrow mononuclear cells,BMMNCs),采用Auto-MACs磁珠分选仪通过CD138磁珠分选多发性骨髓瘤细胞,利用流式细胞仪通过CD38+/CD45-进行检测,分选获得95%以上的CD38+/CD45-细胞。将携带荧光素酶编码基因的质粒转染分选的细胞,然后用含10mL/LFBS的RPMI-1640培养基重悬细胞,调整细胞密度为5×106/mL,总容积为100μL。
1.5 植入兔骨局部细胞注射 上述NOD/SCID小鼠植入兔骨4~6周成功植活后,将分选后的患者CD38+/CD45-骨髓瘤细胞总数5×106、总容积100 μL,经NOD/SCID小鼠植入兔骨的中心端缓慢注入,消毒穿刺处,将小鼠返回SPF级无菌层流动物饲养系统中继续饲养。
1.6 浆细胞生长的监测 注射后每周通过Xenogen IVIS 200成像系统进行1次动物活体免疫荧光检测,观察浆细胞在植入骨局部聚集及生长情况,每周测量1次局部肿瘤大小,观察小鼠生存状态。6~8周后待肿瘤体积发展至约小鼠身体1/10大小后,将小鼠用氯氨酮麻醉,脱颈处死,取出肿瘤组织,病理活检,确定肿块性质。
1.7 统计学处理 采用SPSS 19.0统计学软件行数据分析。均数间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 骨髓瘤患者骨髓标本浆细胞的分选结果 多发性骨髓瘤患者骨髓标本采集后,利用CD138磁珠通过磁珠分选仪分选患者浆细胞,采用流式细胞仪检测显示CD38阳性CD45阴性细胞占95%以上(图1)。
2.2 浆细胞生长的监测情况 在浆细胞注射后每周通过Xenogen IVIS 200成像系统进行1次动物活体免疫荧光检测,发现,在注射后第1周,所有小鼠几乎均检测不到荧光信号,在注射后第2周可以检测到免疫荧光聚集信号,并且随着局部肿瘤组织体积增大,信号持续增强,注射后第8周信号强度明显高于注射后第1周(2.4×104vs.1.5×105,P<0.05,图2)。

图1 流式细胞仪检测经CD138磁珠分选的患者浆细胞,CD38+/CD45-细胞占95%以上Fig.1 CD138beads sorted patient's plasma cells detected by flow cytometry;CD38positive and CD45negative cells accounted for more than 95%

图2 Xenogen IVIS 200成像系统进行活体小鼠免疫荧光检测浆细胞生长情况Fig.2 Xenogen IVIS 200 in vivo mouse imaging system to detect plasma cell growth
2.3 小鼠骨髓瘤成瘤的检测结果 所有小鼠在浆细胞注射后第1周未观察到明显的肿块形成,小鼠毛皮色泽明亮,精神活跃,活动正常;第3周可在植入兔骨局部观察到肿块形成,沿兔骨分部,质软,大小约0.5 cm×0.5cm,小鼠毛皮色泽明亮,活动正常,后肿块逐渐增大;至浆细胞注射后第8周,肿块长至约1.5 cm×3.0cm大小(图3)。此时小鼠毛皮色泽暗淡,精神萎靡,活动减少,反应迟钝。将成瘤小鼠脱颈处死,分离肿块,行病理检查示植入兔骨结构受损,骨小梁破坏,组织中可见大量浆细胞浸润,围绕骨小梁旁可见破骨细胞增多,成骨细胞减少(图4)。
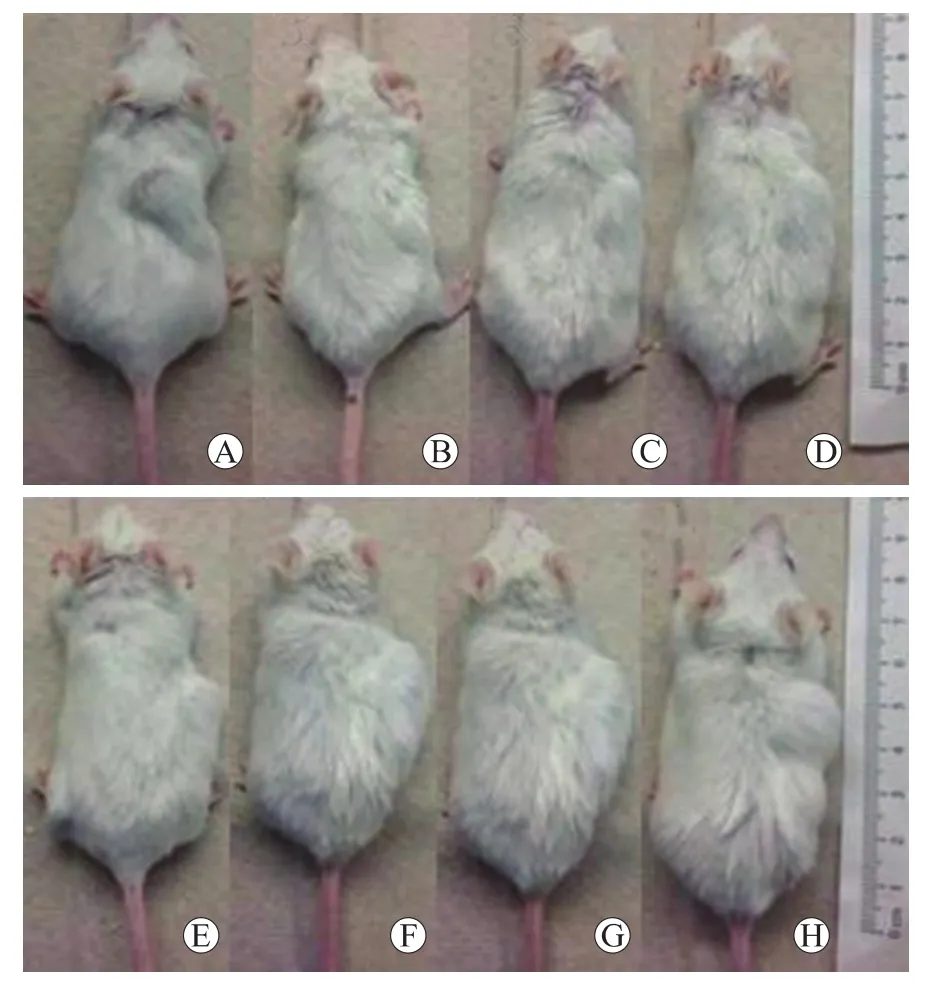
图3 大体观察植入兔骨局部注射患者浆细胞后的肿块形成情况Fig.3 Tumor was observed after the implanted rabbit bone was injected into the patient's plasma cells
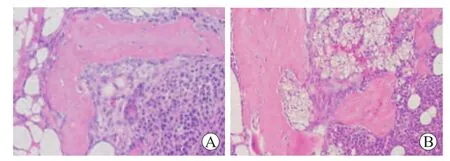
图4 常规HE染色可见肿块组织中大量浆细胞浸润,植入兔骨质破坏,骨小梁结构紊乱,破骨细胞增多Fig.4 Tumor tissue infiltrated with a large number of plasma cells detected by HE staining(×20)
3 讨 论
多发性骨髓瘤目前仍是不可治愈的血液肿瘤之一,虽然干细胞移植及靶向治疗的应用使其疗效得到一定提高,但多数患者最终仍会复发,并且在疾病晚期,多数患者会出现髓外侵犯。针对 NF/κB及PI3K/AKT等信号通路的靶向治疗药物研究已经成为目前骨髓瘤研究的热点[6-7],而骨髓瘤动物模型在药物体内研究及其发病机制研究中的作用至关重要。YACCOBY等[8]于1998年报道了采用人胚胎股骨/胫骨植入NOD/SCID小鼠皮下,建立了骨髓瘤细胞生长赖以生存的人源化骨髓微环境,利用患者骨髓瘤细胞局部注射成功建立了NOD/SCID小鼠骨髓瘤模型,正是这种植入的胚胎骨骼为浆细胞生长提供了相应的骨髓微环境,由患者分离的浆细胞才得以生长,并且形成了骨髓瘤模型。但由于胚胎骨骼受到数量及伦理学等问题的限制,利用胚胎骨骼建立的骨髓瘤小鼠模型的研究并未得到广泛开展。YATA等[9]于2004年又报道了利用兔骨替代胚胎骨骼植入成功建立NOD/SCID小鼠骨髓瘤模型的研究,植入的兔骨为骨髓瘤细胞的生长提供了造血及非造血元素,来自患者的原代骨髓瘤细胞无一例外地表达M蛋白,并且,骨髓瘤细胞只在植入兔骨内生长,与植入兔骨髓微环境相互作用,形成了溶骨病变及新生血管形成等骨髓瘤特征性病理改变。
虽然国外学者已经成功报道了通过兔骨植入建立NOD/SCID小鼠骨髓瘤模型,但国内学者多利用骨髓瘤细胞系细胞于裸鼠局部皮下注射建立骨髓瘤模型[10-11],但均未见详细建立方法及成瘤检测结果等报道,也未见到利用原代骨髓瘤细胞建立小鼠模型的报道,而将原代骨髓瘤细胞通过腹腔注射或局部皮下注射方式注入小鼠体内,骨髓瘤细胞仅在注射局部生长,并不能产生骨质破坏及骨髓浸润等现象。与之相比,通过植入兔骨局部注射患者骨髓瘤原代细胞建立的NOD/SCID小鼠模型,能够为骨髓瘤细胞生长提供更加适合的骨髓微环境。本研究中兔骨植入4周后,所有兔骨均成活,未见发现坏死现象。在植入兔骨内可以检测到兔源VEGF,以及可以观察到血管内皮细胞、破骨细胞、成骨细胞及巨噬细胞等类似于成人的主要骨髓微环境细胞成分,为浆细胞局部注入后存活提供了脂肪细胞、破骨细胞、成骨细胞、血管内皮细胞及成纤维细胞等骨髓瘤细胞赖以生存的微环境。这与之前报道符合[12-13]。而也有研究报道,骨髓瘤细胞的生长与骨髓局部的破骨细胞数量和微血管密度呈正相关[14]。
本研究中,在植入兔骨局部注射患者浆细胞后2周可以观察到植入兔骨骨质变软,局部可感觉到软组织,而此时的小鼠毛皮色泽明亮,活动灵活;动物活体免疫荧光检测也发现局部浆细胞的浓聚,并且随着注射时间的延长,局部肿物逐渐增大,至注射后8周,局部肿块增至约1.5cm×3.0cm大小。此时小鼠精神萎靡,毛皮色泽较前暗淡,活动笨拙,反应趋于迟钝,动物活体免疫荧光检测显示局部浓聚也越来越明显,荧光检测局部信号达1.5×105,远高于注射后2周的2.4×104(P<0.05)。所有小鼠均荷瘤生长,通过肿块组织活检发现肿瘤组织中大量浆细胞浸润,植入兔骨结构不完整,破骨细胞增多,与骨髓瘤病理表现吻合。
综上所述,我们利用兔骨植入NOD/SCID小鼠,并通过植入骨局部注射骨髓瘤患者浆细胞成功建立了NOD/SCID小鼠骨髓瘤模型。该模型更为完整地反映了骨髓瘤生物学特性,可用于骨髓瘤生物学特性、新药研发及耐药机制的研究。
[1]BIRD JM,OWEN RG,D'SA S,et al.Guidelines for the diagnosis and management of multiple myeloma[J].Br J Haematol,2011,154(1):32-75.
[2]MOREAU P,RICHARDSON PG,CAVO M,et al.Harousseau,Proteasome inhibitors in multiple myeloma:10 years later[J].Blood,2012,120(5):947-959.
[3]JOÃOC,COELHO I,COSTA C,et al.Efficacy and safety of lenalidomide in relapse/refractory multiple myeloma-Real life experience of a tertiary cancer center[J].Ann Hematol,2015,94:97-105.
[4]URASHIMA M,CHEN BP,CHEN S,et al.The development of a model for the homing of multiple myeloma cells to human bone marrow[J].Blood,1997,90(2):754-765.
[5]ANDERSON KC,ALSINA M,BENSINGER W,et al.Multiple myeloma,version1.2013[J].J Natl Compr Canc Netw,2013,11(1):11-18.
[6]ZHU J,WANG M,CAO B,et al.Targeting the phosphatidylinositol 3-kinase/AKT pathway for the treatment of multiple myeloma[J].Curr Med Chem,2014,21(27):3173-3187.
[7]DE LA PUENTE P,MUZ B,AZAB F,et al.Molecularly targeted therapies in multiple myeloma[J].Leuk Res Treatment,2014,16.
[8]YACCOBY S,BARLOGIE B,EPSTEIN J.Primary myeloma cells growing in SCID-hu mice:a model for studying the biology and treatment of myeloma and its manifestations[J].Blood,1998,92(8):2908-2913.
[9]YATA K,YACCOBY S.The SCID-rab model:a novel in vivo system for primary human myeloma demonstrating growth of CD138-expressing malignant cells[J].Leukemia,2004,18(11):1891-1897.
[10]李琰,杜恒飞,方洁,等.去甲斑蝥素抗多发性骨髓瘤效应的体内实验研究[J].中华血液学杂志,2013,34(11):970-973.
[11]刘芹芹,刘佳丽,郭冬梅,等.γ-分泌酶抑制剂对人多发性骨髓瘤细胞系RPMI-8226细胞小鼠移植瘤的抑制作用[J].中华血液学杂志,2013,34(9):794-797.
[12]VANDERKERKEN K,DE LEENHEER E,SHIPMAN C,et al.Recombinant osteoprotegerin decreases tumor burden and increases survival in a murine model of multiple myeloma[J].Cancer Res,2003,63(2):287-289.
[13]CROUCHER PI,SHIPMAN CM,LIPPITT J,et al.Osteoprotegerin inhibits the development of osteolytic bone disease in multiple myeloma[J].Blood,2001,98(13):3534-3540.
[14]VAN VALCKENBORGH E,DE RAEVE H,DEVY L,et al.Murine 5T multiple myeloma cells induce angiogenesis in vitro and in vivo[J].Br J Cancer,2002,86(5):796-802.
