原发性肝癌P- 糖蛋白表达与肝动脉插管栓塞化疗疗效的关系及临床意义
2015-02-18吴照宇郭应兴雷进元于海东
吴照宇,郭应兴,雷进元,于海东
(青海大学附属医院介入科,青海西宁 810001)
原发性肝癌是临床常见的恶性肿瘤类型之一,我国是世界上肝癌的高发地区,每年约有10万人死于肝癌,仅次于胃癌和肺癌,已经成为严重影响人类健康的疾病之一[1]。手术治疗是目前肝癌治疗的主要手段,但是约90%的患者发现时已经失去手术机会,因此化疗是这类患者的主要治疗方法[2]。其中肝动脉插管栓塞化疗(TACE)是目前原发性肝癌的常用治疗方法[3-4]。但是近年来化疗药物临床耐药性成为TACE治疗原发性肿瘤所面临的问题。目前,临床研究显示多药耐药(mutidrug resistance,MDR)是导致化疗失败的主要原因之一。MDR1编码的P-糖蛋白(P-gp)可将化疗药物从肿瘤细胞中“泵出”,从而降低了化疗药物的杀伤作用[5-6]。再如,P-gp在乳腺癌、肺癌以及胰腺癌中呈过表达状态,与这些肿瘤的耐药性密切相关[7-9]。本研究分析了原发性肝癌患者中MDR1基因及其编码的P-gp的表达变化,并分析了其表达与TACE化疗疗效的关系,旨在为原发性肝癌临床化疗的治疗用药提供一定的参考依据。
1 资料与方法
1.1 实验材料 逆转录试剂盒购自TaKaRa公司;实时荧光定量PCR仪购自美国Applied Biosystem公司;2×SYBR Green通用型qPCR Master Mix购自罗氏生物;鼠抗人P-gp单克隆抗体购自美国Santa公司;羊抗鼠HRP标记的二抗购自康为世纪有限公司;二氨基联苯胺显色试剂盒及抗原修复液购自福州迈新生物技术有限公司;苏木素和中性树脂购自上海试剂有限公司;其他有机试剂均购自国药集团,为分析纯试剂。
1.2 临床资料及标本采集 选取2010年6月至2013年6月青海大学附属医院收治的原发性肝癌108例患者作为研究对象,所有患者均为经B超引导下肿瘤穿刺活检病理证实,均符合原发性肝癌的临床诊断与分期标准[10]。108例患者均为初治,其中男69例,女39例;年龄50~65岁,平均年龄(60.41±10.23)岁;临床分期:Ⅲ期64例,Ⅳ期44例。甲胎蛋白(AFP)≥400μg 50例,AFP≤400μg 58例,HB-sAg 19例;肝功能Child A级71例,B级37例;肿瘤位置:左肝40例,右肝68例。
同时选择同期来院进行肝脏穿刺检查的50例健康者作为对照研究,其中男30例,女20例;年龄48~62岁,平均年龄(58.33±10.21)岁。两组患者在性别和年龄等指标的比较差异无统计学意义,具有可比性(P>0.05)。
经穿刺活检取得肝组织,分别用于提取基因和蛋白,进行后续实验检测。
1.3 化疗方案 所有肝癌组患者均采用TACE方法进行化疗,采用Seldinger技术,先注入600g/L泛影葡胺30mL,以确定肝内导管位置以及肿瘤血液供应情况。然后按照如下方案化疗:阿霉素40~60 mg/m2,D1(第1天);5-氟尿嘧啶400~600mg/m2,D1-4(第1~4天);顺铂30~40mg/m2。
1.4 实时荧光定量PCR检测肝组织中P-gp的mRNA表达 活检组织置于1mL Trizol溶液中,匀浆后加入200μL氯仿,震荡混匀后,冰上放置15min使溶液分层,然后12 000r/min离心15min,将上清转移至500μL的异丙醇中,混匀后再冰上放置15 min,12 000r/min离心10min使 RNA沉淀,然后用预冷的750mL/L乙醇洗涤2次,最后沉淀溶于DEPC处理的双蒸水中。测定样本浓度,并采用逆转录试剂盒将RNA转录为cDNA,作为PCR的模板。
根据GenBank提供的MDR1mRNA序列,设计如下引物:MDR1-F:5′-CCCATCATTGCAATAGCAGG-3′;MDR1-R:5′-GTTCAAACTTCTGCTCCTCA-3′。β-Actin-F:5′-GCGGGAAATCGTGCGTGAC-3′,β-Actin-R:5′-CGTCATACTCCTGCTTGCTG-3′。引物稀释后首先对引物特异性和退火温度进行条件优化。然后按照下述反应体系制备反应混合物:2×SYBR Green通用型qPCR Master Mix 10μL,上游/下游引物(10μmmol/L)各1μL,cDNA 1μL,补双蒸水至终体积为20μL。根据检测样本的数量配制相应的体积,对应加入PCR板中,每孔20μL。1 500r/min离心将反应混合物甩至管底,根据下列反应条件进行PCR:预变性95℃30s;变性95℃,3s;退火延伸60℃30s;构建溶解曲线。最后从实时荧光定量PCR仪上直接读取数据。
1.5 免疫组织化学法检测肝组织中P-gp的表达肝穿刺组织经石蜡包埋,连续切成5μm的薄片,粘附于多聚赖氨酸处理的玻片上,在50℃烘箱中烤1h,依次用二甲苯、梯度乙醇进行水化,蒸馏水洗涤3次。然后将玻片置于含柠檬酸钠的缓冲液中,加热处理8min,重复2次,用PBS洗涤3次;滴加30mL/L的过氧化氢(750 mL/L甲醇配制)处理30min去除内源性过氧化氢酶。PBS洗涤3次,每次5min。将稀释的P-gp一抗按比例稀释滴加后,4℃孵育过夜,经PBST洗涤3次×5min;滴加100mL/L山羊血清稀释的羊抗鼠二抗,室温孵育1h后,PBST洗涤,DAB显色,常规脱水、干燥、封片。
免疫组化评定标准:P-gp蛋白主要表达于细胞膜,每张切片选取10个视野,放大400倍,计算肿瘤组织中P-gp表达阳性细胞的比率。评定标准:阳性细胞的比例<25%视为阴性,认为非耐药性;阳性细胞大于25%视为阳性,认为耐药性。
1.6 疗效观察 近期疗效评定根据世界卫生组织客观疗效评定标准进行评定,分为完全缓解、部分缓解、无变化和进展。有效率=(完全缓解+部分缓解)/总例数。远期疗效采用1年、2年生存率进行评定。
1.7 统计学分析 所有数据均采用SPSS 13.0统计学软件进行分析,计量数据采用±s表示,计数资料比较采用卡方检验,计量数据比较采用t检验,累计生存率和累积复发率比较采用Kaplan-Meier和Log-Rank检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 肝癌组织中MDR1mRNA表达水平 肝癌组患者肿瘤组织中平均MDR1mRNA表达水平明显高于对照组,差异有统计学意义(P<0.05,图1);以MDR1mRNA/正常水平=2作为临界值,肝癌组患者MDR1mRNA/正常水平低于2的患者32例,MDR1mRNA/正常水平大于2的患者76例。
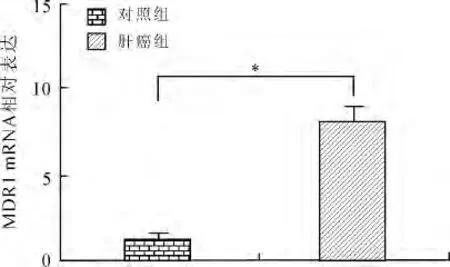
图1 对照组和肝癌组患者肝组织中MDR1mRNA水平比较Fig.1 Comparison of MDR1mRNA level in control group and observation group
2.2 肝癌组织中MDR1编码产物P-gp水平 肝癌组织中P-gp主要表达于肝癌细胞的细胞膜(图2)。根据评定结果,35例患者为阴性,73例确定为P-gp表达阳性。在MDR1mRNA/正常水平大于2的患者中有3例P-gp水平表达较低,被诊断为阴性。
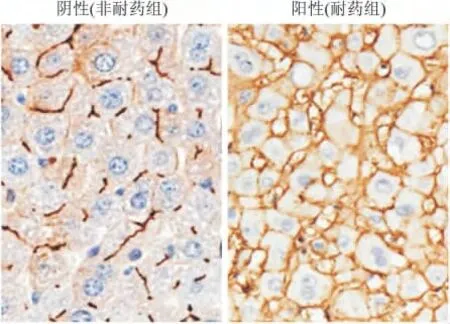
图2 原发性肝癌患者肝组织中P-gp表达水平Fig.2 P-gp expression in patients with primary liver cancer(×400)
2.3 耐药组和非耐药组患者疗效的比较 非耐药组患者经TACE后临床有效率为74.28%,耐药组的临床缓解率为43.84%,非耐药组患者临床缓解率明显高于耐药组,差异有统计学意义(P<0.05,表1)。
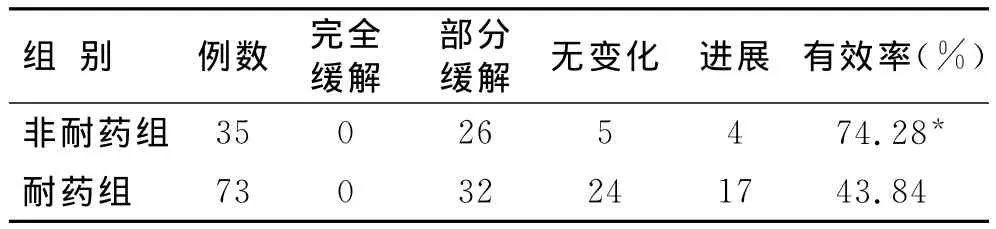
表1 耐药组和非耐药组患者临床缓解率的比较Tab.1 Comparison of clinical efficacy in non-resistance group and resistance group
2.4 耐药组和非耐药组患者生存率的比较 耐药组患者中位生存时间为8.5个月,非耐药组患者中位生存时间为11.7个月,非耐药组患者中位生存时间明显高于耐药组,差异具有统计学意义(P<0.05,图3)。耐药组患者1年、2年累积生存率为54.12%和27.40%,非耐药组1、2年累积生存率为77.14%和42.86%。耐药组患者1、2年累积生存率明显低于非耐药组患者,差异有统计学意义(P<0.05)。
3 讨 论
TACE是治疗无法手术切除的原发性肝癌的常用方法,可减少患者的痛苦,延长患者生存时间[11-12]。但是,TACE治疗原发性肝癌的长期效果不佳,主要原因是原发性肝癌存在明显的MDR现象。MDR是指在肿瘤治疗过程中,由一种抗肿瘤药物引起,但同时又对其他多种结构和作用机制不同的抗肿瘤药物产生交叉耐药现象[13]。MDR现象广泛存在于多种肿瘤中,成为目前临床肿瘤治疗的难点和热点。
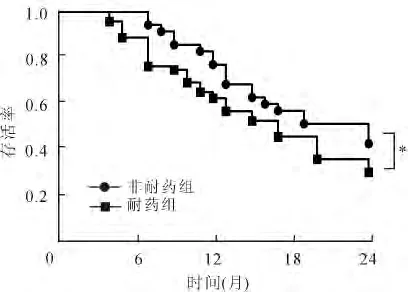
图3 非耐药组和耐药组患者生存率的比较Fig.3 Comparison of survival rate in non-resistance group and resistance group
近年来,随着分子生物学的不断发展,对肿瘤MDR机制的研究取得了显著进展。在肿瘤多种耐药机制中,其中以膜糖蛋白介导的化疗药物的外泵机制较为深入,其中MDR1基因编码产物P-gp在MDR中发挥着重要作用。MDR1基因是ATP结合家族成员之一,其编码的P-gp是一个跨膜糖蛋白,有1 280个氨基酸组成,该蛋白有2个ATP结合位点,通过与ATP结合将化疗药物泵出细胞,而发挥耐药作用[14-16]。P-gp的表达与蒽环类化合物、长春碱类、紫杉醇类、鬼臼毒素类及放线菌素D的耐药性密切相关[17]。
本研究检测了原发性肝癌组织中MDR1基因表达水平,结果显示较正常肝组织明显升高,约2/3的患者表达水平超过正常水平2倍,提示在肝癌组织中MDR1基因的转录处于激活状态。这一结果与目前报道一致[18]。此外,实验通过免疫组化检测,结果显示MDR1mRNA表达水平较高的肝癌患者肝组织中的MDR1编码产物P-gp表达水平明显升高,蛋白水平与mRNA水平一致。值得注意的是3例MDR1 mRNA/正常水平大于2的肝癌患者,在免疫组化检测中其编码产物P-gp的水平低于25%,这3例患者的 MDR1mRNA/正常水平的比值分别为2.2、2.4和2.1,可能导致了在免疫组化检测中出现上述结果,由于耐药与P-gp蛋白水平有关,因此在本研究中将3例患者归于非耐药组。
本研究进一步分析P-gp表达水平与原发性肝癌TACE疗效的关系及临床意义。结果显示非耐药患者临床治疗有效率明显高于耐药组患者,非耐药组患者的临床治疗有效率较耐药组患者高30.44%,说明原发性肝癌的肿瘤耐药严重影响化疗药物的临床治疗效果。此外,TACE后非耐药组患者1年、2年生存率明显高于耐药组患者,说明非耐药组患者的TACE长期疗效较好。
综上所述,P-gp的高表达在部分原发性肝癌组织中表达异常,会直接影响TACE的短期和长期疗效。因此,临床化疗前通过检测患者肝癌组织中P-gp水平,对选择化疗并取得较好的抗肿瘤效果,有一定的临床指导意义。
[1]SIEGEL R,NAISHADHAM D,JEMAL A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[2]HAGYMÁSI KI,TULASSAY Z.Epidemiology,risk factors and molecular pathogenesis of primary liver cancer[J].Orv Hetil,2008,149(12):541-548.
[3]ZHAO C,WANG XJ,WANG S,et al.Lobaplatin combined floxuridine/pirarubicin-based transcatheter hepatic arterial chemoembolization for unresectable primary hepatocellular carcinoma[J].Asian Pac J Cancer Prev,2014,15(5):2057-2060.
[4]CHO JY,PAIK YH,PARK HC,et al.The feasibility of combined transcatheter arterial chemoembolization and radiotherapy for advanced hepatocellular carcinoma[J].Liver Int,2014,34(5):795-801.
[5]BRAMBILA-TAPIA AJ.MDR1(ABCB1)polymorphisms:functional effects and clinical implications[J].Rev Invest Clin,2013,65(5):445-454.
[6]ZHOU JJ,DENG XG,HE XY,et al.Knockdown of NANOG enhances chemosensitivity of liver cancer cells to doxorubicin by reducing MDR1 expression[J].Int J Oncol,2014,44(6):2034-2040.
[7]MECHETNER E,KYSHTOOBAYEVA A,ZONIS S,et al.Levels of multidrug resistance(MDR1)P-glycoprotein expression by human breast cancer correlate with in vitro resistance to taxol and doxorubicin[J].Clin Cancer Res,1998,4(2):389-398.
[8]MELGUIZO C,PRADOS J,LUQUE R,et al.Modulation of MDR1 and MRP3 gene expression in lung cancer cells after paclitaxel and carboplatin exposure[J].Int J Mol Sci,2012,13(12):16624-16635.
[9]CHEN M,XUE X,WANG F,et al.Expression and promoter methylation analysis of ATP-binding cassette genes in pancreatic cancer[J].Oncol Rep,2012,27(1):265-269.
[10]陈中安.经肝动脉插管栓塞化疗原发性肝癌的临床观察[J].医学影像学杂志,2011,21(10):1498-1500.
[11]XU J,WANG YH,XIA JL,et al.Effect of transcatheter arterial chemoembolization on HBV DNA level in primary liver cancer patients[J].Ai Zheng,2009,28(5):520-523.
[12]PENG ZW,ZHANG YJ,CHEN MS,et al.Radiofrequency ablation with or without transcatheter arterial chemoembolization in the treatment of hepatocellular carcinoma:aprospective randomized trial[J].J Clin Oncol,2013,31(4):426-432.
[13]PÉREZ-TOMÁS R.Multidrug resistance:retrospect and prospects in anti-cancer drug treatment[J].Curr Med Chem,2006,13(16):1859-1876.
[14]CHANG G.Multidrug resistance ABC transporters[J].FEBS Lett,2009,555(1):102-105.
[15]WINTER SS,RICCI J,LUO L,et al.ATP Binding Cassette C1(ABCC1/MRP1)-mediated drug efflux contributes to disease progression in T-lineage acute lymphoblastic leukemia[J].Health(Irvine Calif),2013,5(5A).
[16]LIMTRAKUL P,CHEARWAE W,SHUKLA S,et al.Modulation of function of three ABC drug transporters,P-glycoprotein(ABCB1),mitoxantrone resistance protein(ABCG2)and multidrug resistance protein 1 (ABCC1)by tetrahydrocurcumin,a major metabolite of curcumin[J].Mol Cell Biochem,2010,296(1-2):85-95.
[17]LEONARD GD,FOJO T,BATES SE.The role of ABC transporters in clinical practice[J].Oncologist,2011,8(5):411-424.
[18]CHENIVESSE X,FRANCO D,BRÉCHOT C.MDR1(multidrug resistance)gene expression in human primary liver cancer and cirrhosis[J].J Hepatol,2003,18(2):168-172.
