RNA结合蛋白La对宫颈癌细胞侵袭转移的影响及其机制
2015-02-18陈昆仑
陈 茜,陈昆仑,刘 韡,李 牧,高 庆
(西安交通大学医学部第二附属医院:1.妇产科;2.普通外科,陕西西安 710004)
宫颈癌是最常见的妇科恶性肿瘤,世界范围内居女性癌症相关死亡病因的第2位[1]。其中转移复发是引起患者死亡的最主要原因[2]。癌症细胞的侵袭转移是一个多种因素参与的复杂过程,包括癌症细胞从原发部位脱离,通过分泌基质金属蛋白酶等分子降解细胞外间质,穿透血管和淋巴管管壁,最后到达远处形成新的肿瘤[3]。虽然关于宫颈癌侵袭转移的研究很多,但至今为止人们对宫颈癌细胞侵袭转移的具体机制尚未完全明确。
La蛋白(La)是一种在多种细胞中广泛分布、主要表达于细胞核的RNA结合蛋白,多数研究认为其能够在细胞质和细胞核中自由穿梭发挥重要功能[4-7]。研究发现,La蛋白在多种肿瘤细胞中发挥重要作用,如宫颈癌和头颈部肿瘤[8]。但其在宫颈癌侵袭转移的作用尚未见文献报道。
本研究为了探讨La蛋白在宫颈癌侵袭转移中的作用,通过RNA干扰技术构建稳定表达shRNA的宫颈癌细胞株HeLa,利用划痕实验和Transwell小室检测了La蛋白对宫颈癌细胞侵袭转移的影响,并利用 Western blot和明胶酶谱的方法检测La对宫颈癌细胞侵袭转移的影响及其可能机制。
1 材料与方法
1.1 主要试剂 La-shRNA重组质粒、阴性对照(negative control,NC)重组质粒由上海吉玛制药有限公司构建;HeLa细胞株购自ATCC(美国组织培养保藏中心);La蛋白抗体(Abcam,美国);MMP-2,TIMP-2蛋白抗体(Cell Signal,美国);β-actin单抗(Santa Cruz,美国);脂质体lipofectamine2000(Invitrogen,美国);G418(Sigma,美国);ECL化学发光试剂盒(Pierce,美国);DMEM 培养基;胎牛血清(Gibco,美国);其他试剂均为国产分析纯。
1.2 方法
1.2.1 细胞培养与转染 HeLa细胞用含100mL/L胎牛血清的DMEM培养液,于CO2培养箱中,37℃常规培养。用La-shRNA干扰质粒及阴性对照质粒转染HeLa细胞,操作步骤严格按照Lipofectamine 2000说明书进行。细胞转染后24h按1∶9的比例传代,48h后开始用含1 000mg/L的G418选择性培养液进行筛选,2~3周后克隆形成,挑取阳性克隆细胞转移至6孔板扩大培养,阳性克隆在荧光显微镜下可见绿色荧光表达[9]。
1.2.2 划痕实验 将各组细胞接种到6孔板中培养,当细胞融合率达到70%时,用1μL枪头在6孔板中均匀划痕,用PBS将细胞清洗3遍后,采用血清浓度为20mL/L的培养基对细胞进行培养。在培养开始后0、24h时对细胞进行照相,并选取具有代表性的视野进行统计分析。
1.2.3 Transwell小室法检测细胞的侵袭能力 按照使用说明,将购置的Transwell小室(BD,美国)底部均匀涂上基质胶。取对数生长期HeLa细胞,利用不含血清的培养基制成单细胞悬液,每个小室中加入2×104个细胞(体积200μL),下室中加入500μL血清浓度为100mL/L的完全培养基。培养24h之后,将小室取出并用PBS清洗,然后利用40g/L多聚甲醛对细胞进行固定。对上室中没有穿过的细胞,用棉签轻轻擦掉。其后利用结晶紫溶液对细胞进行染色并对穿过的细胞进行计数。
1.2.4 Western blot 按照描述的方法进行,收集对数生长期的细胞,蛋白裂解液冰上裂解细胞30 min,13 000r/min离心15min,取上清,BCA 法测蛋白浓度。煮沸变性后,进行SDS-PAGE电泳,湿法转膜,50g/L脱脂奶封闭1h,MMP-2一抗(1∶1 000),TIMP-2一抗(1∶1 000)及β-actin一抗(1∶1 000),膜上4℃孵育过夜,TBST洗膜10min×3次,HRP偶联的二抗,室温摇床孵育1h,用增强化学发光系统(ECL)显色、曝光、显影、定影。
1.2.5 明胶酶谱法检测蛋白酶活性 利用细胞基数结果调整上样量,利用0.1%gelatin-8%SDS-PAGE进行电泳。电泳结束后利用2.5%Triton X-100室温下对胶进行洗涤2次,每次30min。然后在反应液中 (10mmol/L CaCl2,40mmol/L Tris-HCl 和0.01%NaN3,pH 8.0)37℃孵育12h。然后利用考马斯亮蓝对胶进行染色并照相,最后对结果利用Image J进行分析。
1.3 统计学分析 应用SPSS 13.0软件进行分析,数据以±s表示,分别采用t检验分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 La蛋白对HeLa细胞迁徙能力的影响 对照组(shNC组)细胞迁徙速度明显高于干扰组(shLa组)(图1)。划痕缩小面积百分比(各组细胞24h后划痕面积占0h划痕面积的百分比),shNC:25.1±3.34、shLa:57.4±7.52,shNC组细胞的划痕面积占其0h的百分比明显低于低于shLa组,差异有统计学差异(P<0.01)。
2.2 La蛋白对HeLa细胞侵袭能力的影响 本研究发现,La蛋白干扰能够明显抑制HeLa细胞的侵袭能力。从图2A中可以看出,La干扰后HeLa细胞的侵袭能力明显下降,穿过小室基底膜到达下室的细胞明显减少(shNC:367±35.1、shLa:158±19.3)。shNC和shLa组相比穿过基底膜到达下室的细胞数具有统计学差异(P<0.01,图2B)。
2.3 La蛋白对HeLa细胞MMP-2和TIMP-2的表达的影响 MMP-2及其抑制剂TIMP-2在肿瘤细胞侵袭转移过程中发挥重要作用。本研究发现,shNC组HeLa细胞内MMP-2的表达水平明显高于shLa组(图3A),而TIMP-2的表达水平明显低于shLa组。对MMP-2和TIMP-2的表达差异进行统计学分析,发现差异具有统计学意义(图3B)。
2.4 La蛋白对HeLa细胞MMP-2酶活性的影响利用明胶酶谱的方法分析了细胞培养上清中MMP-2和MMP-9的酶活性。结果显示,shNC组MMP-2酶活性水平高于shLa组,二者之间的差异有统计学意义,而MMP-9在两组细胞的活性没有明显差异(图4)。

图1 La蛋白对HeLa细胞迁徙能力的影响Fig.1 La protein inhibited the motility of HeLa cells**P<0.01(n=5)。
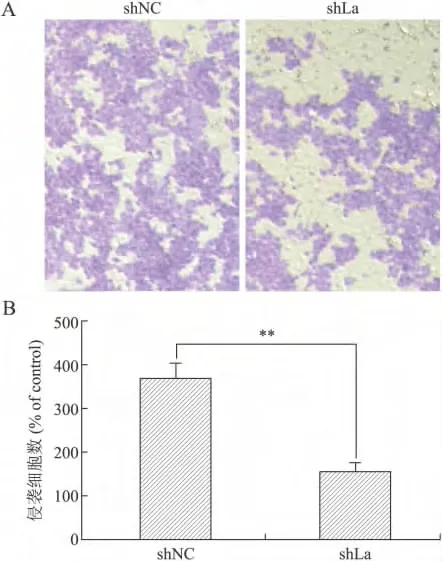
图2 La蛋白对HeLa细胞侵袭能力的影响Fig.2 La protein inhibited the invasion of HeLa cells

图3 La蛋白对HeLa细胞MMP-2和TIMP-2蛋白表达的影响Fig.3 Effects of La protein on the expressions of MMP-2 and TIMP-2in HeLa cells
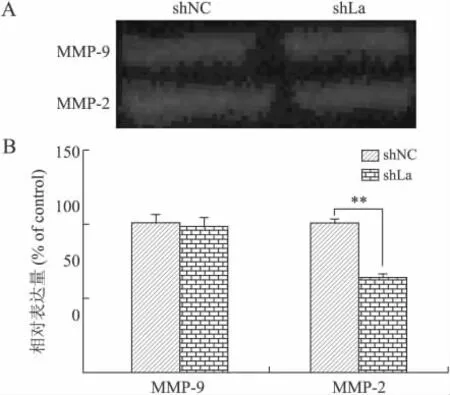
图4 La蛋白对HeLa细胞MMP-2与MMP-9酶活性的影响Fig.4 Effects of La protein on the activity of MMP-2and MMP-9in HeLa cells
3 讨 论
宫颈癌是较为常见的妇科恶性肿瘤之一,在妇科癌症相关死亡病因中居第2位[1-2],其中复发转移是引起患者死亡的主要病因[10-11]。癌症的转移和复发是一个多步骤多环节的复杂过程,其具体分子机制至今尚未完全明确,但许多基因参与调控了这一复杂过程。La在多种肿瘤细胞中高表达[12]。我们前期研究发现其与宫颈癌细胞系HeLa细胞增殖相关,低表达La后肿瘤细胞的增殖能力明显降低[9]。也有研究发现,La与头颈部肿瘤细胞的增殖及侵袭转移相关[13]。但其与宫颈癌细胞侵袭转移的关系尚未见报道。基于此,本研究探讨了La对宫颈细胞侵袭转移作用及其可能机制。
我们前期研究发现,La在宫颈癌HeLa细胞中高表达,所以本实验选取HeLa细胞为研究对象,通过构建干扰载体,降低其La蛋白的表达水平。我们利用检测细胞迁徙和侵袭能力最为常用的划痕实验和Transwell小室,来检测HeLa细胞的迁徙和侵袭能力。结果发现,La低表达后HeLa细胞的迁徙和侵袭能力明显降低(图1、图2),表面为穿过划痕和Transwell小室的细胞数目降低。
基质金属蛋白酶的表达和活性以及其抑制剂的表达在肿瘤细胞侵袭转移过程中发挥重要作用[14-17]。MMP-2能够选择性降解基底膜和细胞外基质中的主要成分Ⅳ型胶原的作用,TIMP-2是MMP-2的抑制物,多由分泌MMP-2的细胞分泌,多随MMP-2的表达而表达[18]。为了进一步检测La表达降低引起HeLa细胞侵袭转移能力降低的机制。我们利用Western blot和明胶酶谱的方法检测了两组HeLa细胞中MMP-2的表达水平和活性及TIMP-2的表达水平。结果发现,La表达调低后MMP-2的表达水平和活性明显降低,而TIMP-2的表达水平明显升高。提示La促进HeLa细胞侵袭转移的作用可能与其对MMP-2和TIMP-2的表达的调控相关。
综上所述,本研究发现La能够促进宫颈癌He-La细胞的侵袭转移,其具体机制可能是通过对MMP-2和TIMP-2的调节实现的。
[1]PARKIN DM,BRAY F,FERLAY J,et al.Global cancer statistics 2002[J].Cancer J Clin,2005,55(2):74-108.
[2]GUPTA GP,MASSAGUE J.Cancer metastasis:building a framework[J].Cell,2006,127(4):679-695.
[3]YILMAZ M,CHRISTOFORI G,LEHEMBRE F,et al.Distinct mechanisms of tumor invasion and metastasis[J].Trends Mol Med,2007,13(12):535-541.
[4]BRENET F,SOCCI ND,SONENBERG N,et al.Akt phosphorylation of La regulates specific mRNA translation in glial progenitors[J].Oncogene,2009,28(1):128-139.
[5]FOK V,FRIEND K,STEITZ JA,et al.Epstein-Barr virus noncoding RNAs are confined to the nucleus,whereas their partner,the human La protein,undergoes nucleocytoplasmic shuttling[J].J Cell Biol,2006,173(3):319-325.
[6]TROSTER H,METZGER TE,SEMSEI I,et al.One gene,two transcripts:isolation of an alternative transcript encoding for the autoantigen La/SS-B from a cDNA library of a patient with primary Sjogrens'syndrome[J].J Exp Med,1994,180(6):2059-2067.
[7]CHAMBERS JC,KENAN D,MARTIN BJ,et al.Genomic structure and amino acid sequence domains of the human La autoantigen[J].J Biol Chem,1988,263(34):18043-18051.
[8]SOMMER G,DITTMANN J,KUEHNERT J,et al.The RNA-binding protein La contributes to cell proliferation and CCND1 expression[J].Oncogene,2011,30(4):434-444.
[9]陈昆仑,吴怡,李牧,等.RNA结合蛋白La在宫颈癌组织中的表达及临床意义[J].南方医科大学学报,2013,33(7):999-1003.
[10]SIEGEL R,NAISHADHAM D,JEMAL A,et al.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
[11]YILMAZ M,CHRISTOFORI G,LEHEMBRE F,et al.Distinct mechanisms of tumor invasion and metastasis[J].Trends Mol Med,2007,13(3):535-541.
[12]AL-EJEH F,DARBY JM,BROWN MP.The La autoantigen is a malignancy-associated cell death target that is induced by DNA-damaging drugs[J].Clin Cancer Res,2007,13(6):5509s-5518s
[13]SOMMER G,ROSSA C,CHI AC,et al.Implication of RNA-binding protein La in proliferation,migration and invasion of lymph node-metastasized hypopharyngeal SCC cells[J].PLoS One,2011,6(10):e25402.
[14]CHEN P,PARKS WC.Role of matrix metalloproteinases in epithelial migration[J].J Cell Biochem,2009,108(7):1233-1243.
[15]DERYUGINA EI,QUIGLEY JP.Matrix metalloproteinases and tumor metastasis[J].Cancer Metastasis Rev,2006,25(1):9-34.
[16]DERYUGINA EI,QUIGLEY JP.Pleiotropic roles of matrix metalloproteinases in tumor angiogenesis:contrasting,overlapping and compensatory functions[J].Biochim Biophys Acta,2010,1803(1):103-20.
[17]WANG ZD,HUANG C,LI ZF,et al.Chrysanthemum indicum ethanolic extract inhibits invasion of hepatocellular carcinoma via regulation of MMP/TIMP balance as therapeutic target[J].Oncol Rep,2010,23(9):413-21.
[18]朱丹,刘晓军,潘颖,等.MMP-2与TIMP-2在宫颈鳞状细胞癌组织中的表达及临床意义[J].中国实验诊断学,2013,17(7):1254-1257.
