伴癌与非伴癌胃高级别上皮内瘤变全基因表达谱的比较
2015-02-18周炜洵费贵军程书钧陆星华
俎 明,徐 雪,周炜洵,费贵军,吴 晰,姚 方,李 媛,程书钧,陆星华
中国医学科学院 北京协和医学院 北京协和医院 1消化内科 2病理科,北京 100730
3中国医学科学院 北京协和医学院 肿瘤研究所分子肿瘤学国家重点实验室,北京 100021
伴癌与非伴癌胃高级别上皮内瘤变全基因表达谱的比较
俎明1,徐雪1,周炜洵2,费贵军1,吴晰1,姚方1,李媛2,程书钧3,陆星华1
中国医学科学院北京协和医学院北京协和医院1消化内科2病理科,北京 100730
3中国医学科学院北京协和医学院肿瘤研究所分子肿瘤学国家重点实验室,北京 100021
摘要:目的比较伴癌患者的胃高级别上皮内瘤变(HGIN)与非伴癌患者的胃HGIN组织全基因表达谱的差异。方法收集北京协和医院2010年3月至2013年5月间行放大染色胃镜检查的21例患者的标本,胃镜活检组织病理均为HGIN。21例患者均行内镜黏膜下剥离术,病理示10例为HGIN,11例为HGIN伴部分癌变。采用4×44K人全基因表达谱芯片,用非配对t检验和Benjamini-Hochberg假发现率(FDR)校正筛选差异基因,采用GeneSpring GX 12.6进行基因本体(GO)富集分析。结果伴癌HGIN与非伴癌HGIN组织的全基因表达谱比较,共有差异基因470个(P<0.05,倍数变化>2),其中表达上调的基因180个,表达下调的基因290个。上调基因GO富集主要与三酰甘油合成、甘油酯合成、中性脂质合成、甘油醚代谢、有机醚代谢及甘油酯类代谢有关。结论脂质代谢改变可能是胃癌发生的早期事件。
关键词:胃高级别上皮内瘤变;胃癌;全基因表达谱微阵列
Whole Genome Expression Profiling of Gastric High-grade Intraepithelial Neoplasia with or without Cancer
ActaAcadMedSin,2015,37(1):23-29
我国胃癌的发病率及死亡率长期排在世界前列,2012年新发胃癌约40.5万例,居恶性肿瘤第2位;胃癌死亡病例约32.5万例,居恶性肿瘤第3位[1]。Lauren分型将胃癌分为肠型和弥漫型,两者各有特异的病理形态及免疫表型[2]。肠型胃癌有经典的Correa癌变模式:萎缩性胃炎——肠上皮化生——异型增生(上皮内瘤变)——癌[3- 4]。目前一致认为胃高级别上皮内瘤变(high-grade intraepithelial neoplasia,HGIN)是癌前病变,与胃癌发生密切相关[5],但胃癌发病的分子机制目前尚不清楚。研究胃HGIN组织的表达谱可将胃癌的防治研究提前至癌前病变阶段,在实现胃癌的早期防治方面具有重要意义。本研究采用全基因表达谱芯片技术,寻找伴癌HGIN组织与非伴癌HGIN组织的差异基因,为胃癌的早期诊断和胃癌发生的分子机制提供实验依据。
材料和方法
样本来源选取2010年3月至2013年5月在北京协和医院接受放大染色胃镜检查并行内镜黏膜下剥离术的21例患者。入选标准:无胃癌以外的恶性肿瘤;取样前未经放疗、化疗或生物治疗;临床病理资料完整。胃镜活检标本病理均为HGIN;内镜黏膜下剥离标本病理10例为HGIN,11例为HGIN伴部分癌变。非伴癌HGIN组患者年龄(66.40±9.41)岁,伴癌HGIN组患者年龄(61.18±8.07)岁。病理诊断依据消化系统肿瘤WHO标准(2010版)[6],经2名病理医师独立诊断。胃镜检查时对可疑胃黏膜用活检钳平行取病变组织2块,其中1块行病理学检查,另1块置入含组织储存试剂(RNAlater,美国Life Technologies公司)的离心管内,4 ℃过夜,-80 ℃冰箱保存备用。
研究方案通过北京协和医院伦理委员会审查,入选患者均签署知情同意书。
试剂和器材RNA抽提采用RNeasy mini Kit(德国Qiagen公司);芯片采用人全基因组表达谱芯片(Whole Human Genome microarray Kit,4×44K,美国Agilent公司),单色荧光少量快速扩增标记试剂盒(Low Input Quick Amp Labeling Kit,One-Color,美国Agilent公司),单色荧光RNA加标试剂盒(RNA Spike-in Kit One-color,美国Agilent公司),基因表达谱杂交试剂盒(Gene Expression Hybridization Kit,美国Agilent公司)。主要器材包括紫外分光光度仪(Nanodrop ND- 1000,美国NanoDrop公司),生物分析仪(Agilent 2100),杂交炉(G2545A,美国Agilent公司)和芯片扫描仪(G2505BA,美国Agilent公司)。
总RNA提取与质量检测将组织块从离心管中转移至装有600 μl RLT(含1% β-ME)的离心管中,吹打混匀,至组织充分裂解。将全部液体加到离心绞碎柱(QIA shredder spin column,德国Qiagen公司)内,13 000×g 4 ℃离心2 min,将收集管内液体移入1.5 ml离心管内,按照RNeasy mini Kit的说明书进行总RNA提取,20 μl无核酸酶水溶解RNA,经紫外分光光度仪和生物分析仪检测RNA的纯度及完整性,-80 ℃冰箱分装保存。
基因芯片的杂交和扫描芯片杂交步骤参照单色荧光标记表达谱芯片研究说明书(Version 6.5,美国Agilent公司)。配制单色Spike-in 混合物,取100 ng总RNA,反转录合成cDNA,以NTPs(掺入以Cy3标记的CTP)为原料合成cRNA,RNeasy mini柱纯化cRNA,测定cRNA的浓度和标记效率,cRNA片段化,采用人全基因组表达谱芯片,杂交炉内65 ℃ 10 r/min 17 h,洗涤芯片,采用芯片扫描仪扫描芯片杂交图像。
统计学处理采用Feature Extraction version 10.5.1.1(美国Agilent公司)进行图像信号的处理分析和表达数据提取,GeneSpring(GX12.6,美国Agilent公司)对所有样本芯片结果进行质控分析,并采用第75百分位数移位(75th percentile shift)进行标准化,用每个基因在所有样本中的表达中位数进行基线校正;筛选表达基因的条件为Detected 及Not Detected,且至少在1种表型(伴癌HGIN或非伴癌HGIN)全部样本中满足上述条件。采用GeneSpring完成主成分分析、差异基因筛选及基因本体(gene ontology,GO)富集分析。组间数据比较采用非配对t检验,原始P值经Benjamini-Hochberg方法校正,显著性水平为0.05,同时满足倍数变化(fold change,FC)>2筛选差异表达基因;GO富集以P<0.05为差异有统计学意义;非监督聚类分析采用开放性平台R绘制热图;信号通路分析采用DAVID分析平台,通过京都基因与基因组百科全书(Kyoto Encyclopedia of Gene and Genomics,KEGG)进行信号通路富集分析。
结果
总RNA质量检验总RNA浓度为(181.5±134.2)ng/μl,吸光度(absorbance,A)260/A280为2.05±0.04,A260/A230 为1.94±0.12。RNA完整性为8.61±0.57(图1),质量符合基因芯片杂交要求。
芯片杂交结果21例样本的所有质控指标均在合理范围内,芯片数据可靠。经过筛选共有41 033条探针纳入分析,数据归一化处理后的箱式图显示各样本数据分布基本一致,样本之间的数据具有可比性(图2)。

HGIN:高级别上皮内瘤变
HGIN:high-grade intraepithelial neoplasia
图 1非伴癌HGIN组织(1~6)及伴癌HGIN组织(7~12)的RNA质量图
Fig 1The quality of RNA in HGIN without cancer(1- 6)and in HGIN with cancer(7- 12)
主成分分析对所有样本的全基因表达谱进行的主成分分析显示伴癌HGIN及非伴癌HGIN的组内样本有一定的聚集倾向(图3)。
差异基因与非伴癌HGIN比较,伴癌HGIN共有470个差异基因(图4),其中表达上调的基因180个,表达下调的基因290个。与非伴癌HGIN比较,在伴癌HGIN中表达上调及下调的前20位基因见表1。
聚类分析结果根据表达上调的180个差异基因对所有样本进行非监督聚类分析,可将伴癌HGIN与非伴癌HGIN区分,总体正确聚类效率为90.5%(图5)。
GO富集分析GO富集分析结果显示,表达上调的180个基因主要参与三酰甘油合成、甘油酯合成、中性脂质合成、甘油醚代谢、有机醚代谢及甘油酯类代谢(表2)。表达下调的基因无GO条目通过显著性检验。
信号通路分析采用KEGG对上调的180个差异表达基因进行分析,发现甘油酯类代谢、精氨酸及脯氨酸代谢、PPAR信号通路显著富集(表3)。
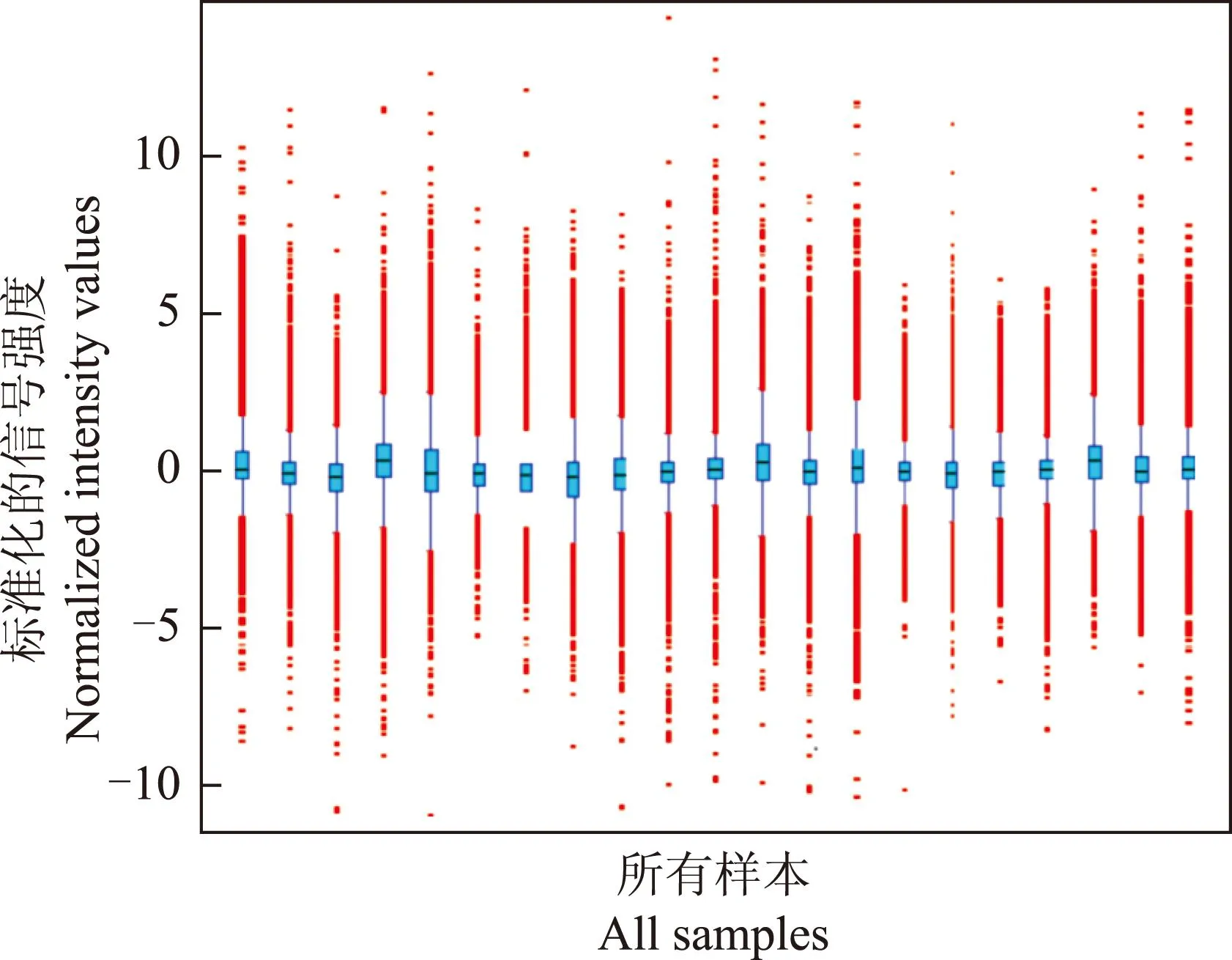
图 2数据归一化处理后的箱式图
Fig 2Boxplots after normalization

蓝色:非伴癌HGIN;红色:伴癌HGIN
Blue:HGIN without cancer;red:HGIN with cancer
图 3主成分分析
Fig 3Principal components analysis
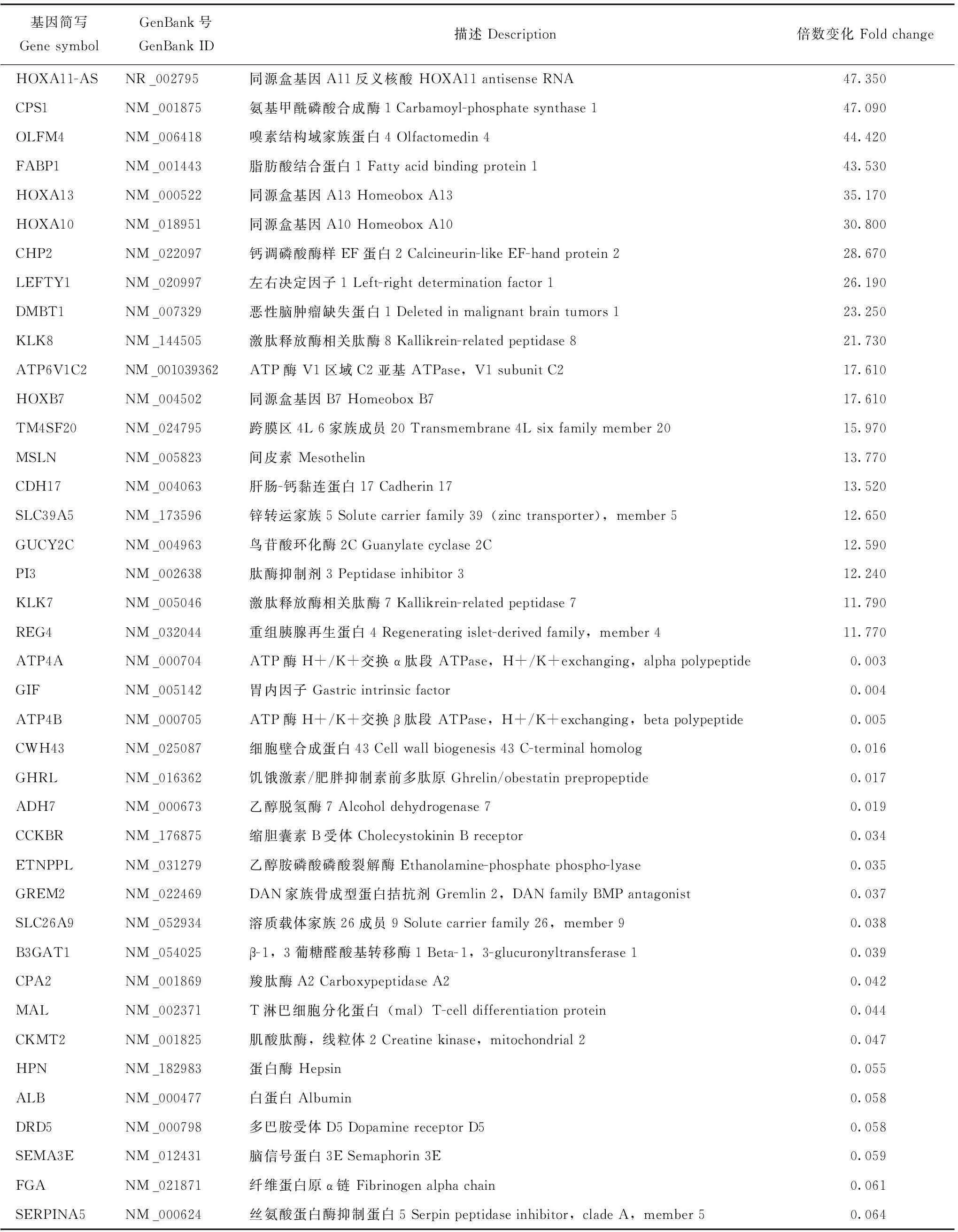
表 1 与非伴癌HGIN比较,在伴癌HGIN中表达上调或下调的前20位基因
HGIN:高级别上皮内瘤变
HGIN:high-grade intraepithelial neoplasia

图 4火山图筛选伴癌HGIN与非伴癌HGIN的差异基因(红色方点为P<0.05,倍数变化>2的差异基因)
Fig 4Volcano plot for screening the differentially expressed genes(the red squares withP<0.05 and fold change>2)in HGIN with cancer compared with HGIN without cancer

每1纵列代表1个样本,每1横列代表1个基因,颜色由绿色到红色代表基因的表达丰度由低到高
Each column represents a sample and each row represents a transcript,the expression abundance from low level to high level is shown by the color spectrum from green to red
图 5基于180个上调基因对非伴癌HGIN和伴癌HGIN组织的非监督聚类分析
Fig 5Unsupervised cluster analysis of HGIN without cancer and HGIN with cancer with the 180 up-regulated genes

表 2 基于180个上调基因的GO富集分析
GO:基因本体;MOGAT2:单酰甘油O-酰基转移酶2;DGAT1:二酰甘油O-酰基转移酶同源物1;APOC2:载脂蛋白C-Ⅱ;CPS1:氨基甲酰磷酸合成酶1;GPD1:甘油三磷酸脱氢酶1;AGPAT2:1-甘油酯-3磷酸O-酰基转移酶2
GO:gene ontology;MOGAT2:monoacylglycerol O-acyltransferase 2;DGAT1:diacylglycerol O-acyltransferase homolog 1;APOC2:apolipoprotein C-Ⅱ;CPS1:carbamoyl-phosphate synthetase 1;GPD1:glycerol- 3-phosphate dehydrogenase 1;AGPAT2:1-acylglycerol- 3-phosphate O-acyltransferase 2
讨论
研究发现胃HGIN的癌变率为4.8%~100%[7],但目前在临床上尚无可靠的分子标记来预测胃HGIN的癌变。本研究以胃镜下取得的组织样本为研究材料,采用cDNA微阵列技术首次分析了伴癌胃HGIN与非伴癌胃HGIN组织的基因表达谱差异,筛选出了胃HGIN向胃癌转变的相关基因,不仅有利于胃癌的早期诊断和早期治疗,也增进了对胃癌发病分子机制的了解。
伴癌HGIN与非伴癌HGIN共筛选出470个差异基因,与非伴癌HGIN比较,伴癌HGIN有180个基因表达上调,290个基因表达下调。根据表达上调的180个差异基因进行非监督聚类分析,两组样本总体正确聚类效率为90.5%,两组样本组织在基因水平上具有组内的相似性和组间的差异性,说明两组的基因表达水平差异有统计学意义。通过对上调的180个基因行GO富集及KEGG通路分析,笔者发现差异基因主要与脂类代谢有关,提示在胃细胞向恶性细胞转化过程中,脂类代谢改变可能起到重要作用。

表 3 京都基因与基因组百科全书信号通路分析结果
肿瘤细胞的一大特征为能量代谢的变化[8],表现为糖酵解过度活跃,而线粒体有氧代谢减弱,被称为“Warburg效应”[9]。研究表明,肿瘤细胞内还存在脂类代谢异常,在能量代谢、细胞膜骨架形成、肿瘤信号传导、转录后蛋白修饰方面有着重要影响[10]。越来越多研究发现,肥胖是食管癌、结肠癌、肝癌、胰腺癌等肿瘤的危险因素[11- 12],致病机制可能与胰岛素和胰岛素样生长因子- 1信号通路、瘦素、性激素、肥胖相关炎症反应有关[13]。研究表明,肿瘤细胞中脂肪酸合成增加,内源性合成的脂肪酸可以在线粒体内经脂肪酸β氧化途径进行氧化代谢,而脂肪酸β氧化可能是前列腺癌细胞的主要能量来源[14]。一项全基因表达谱的乳腺癌代谢模型显示,脂肪酸合成代谢异常是乳腺癌发生的早期特征[15]。另有研究指出,高脂饮食可加速致瘤性K-ras驱动的胰腺上皮瘤变[16]。有两项研究通过高分辨率魔角旋转核磁共振技术发现胃癌组织中三酰甘油含量显著高于正常胃黏膜[17- 18],从另一方面支持了本研究的发现。
本研究发现的在伴癌HGIN组织上调的前20位基因中,OLFM4、HOXA13、HOXA10、CDH17在胃癌中研究较多。有研究显示,OLFM4在胃癌组织中表达高于正常组织,并与转移及预后相关[19]。利用小分子干扰RNA干扰胃癌细胞系SGC7901及MKN45中OLFM4的表达,可抑制肿瘤的增殖[20]。有学者采用全基因表达谱芯片发现HOXA13、HOXA10在胃癌组织中高表达[21]。Han等[22]也发现,HOXA13在胃癌中高表达,并与不良预后相关。CDH17在胃癌组织中显著高表达,且与浸润深度、肿瘤分期、淋巴结转移相关,高表达者预后较差[23]。CDH17在胃癌细胞系MKN- 45中可激活NF-κB信号通路,从而促进肿瘤生成及淋巴结转移[24]。CDH17还可以通过调节Ras/Raf/MEK/ERK信号通路来促进癌细胞增殖[25]。
综上,本研究筛选出了470个可能与胃HGIN向胃癌转变相关的基因,发现脂质代谢改变可能是胃癌发生的早期事件,有助于从分子水平理解胃癌的病因,为胃癌的早期诊断和治疗提供了深入研究的新思路。
参考文献
[1]Ferlay J,Soerjomataram I,Ervik M,et al. GLOBOCAN 2012 v1.0,cancer incidence and mortality worldwide:IARC cancer base No.11 [EB/OL]. [2014- 09- 15]. http://globocan.iarc.fr.
[2]Lauren P. The two histological main types of gastric carcinoma:diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification [J]. Acta Pathol Microbiol Scand,1965,64:31- 49.
[3]Correa P. Human gastric carcinogenesis:a multistep and multifactorial process-First American Cancer Society Award Lecture on Cancer Epidemiology and Prevention [J]. Cancer Res,1992,52(24):6735- 6740.
[4]Meining A,Morgner A,Miehlke S,et al. Atrophy-metaplasia-dysplasia-carcinoma sequence in the stomach:a reality or merely an hypothesis [J]. Best Pract Res Clin Gastroenterol,2001,15(6):983- 998.
[5]Dinis-Ribeiro M,Areia M,de Vries AC,et al. Management of precancerous conditions and lesions in the stomach(MAPS):guideline from the European Society of Gastrointestinal Endoscopy(ESGE),European Helicobacter Study Group(EHSG),European Society of Pathology(ESP),and the Sociedade Portuguesa de Endoscopia Digestiva(SPED)[J]. Endoscopy,2012,44(1):74- 94.
[6]Bosman FT,Carneiro F,Hruban RH,et al. WHO classification of tumours of the digestive system [M]. 4th ed. Lyon:International Agency for Research on Cancer,2010:46- 48.
[7]Raftopoulos SC,Kumarasinghe P,de Boer B,et al. Gastric intraepithelial neoplasia in a Western population[J]. Eur J Gastroenterol Hepatol,2012,24(1):48- 54.
[8]Hanahan D,Weinberg RA. Hallmarks of cancer:the next generation [J]. Cell,2011,144(5):646- 674.
[9]Koppenol WH,Bounds PL,Dang CV. Otto Warburg’s contributions to current concepts of cancer metabolism [J]. Nat Rev Cancer,2011,11(5):325- 337.
[10]Baenke F,Peck B,Miess H,et al. Hooked on fat:the role of lipid synthesis in cancer metabolism and tumour development [J]. Dis Model Mech,2013,6(6):1353- 1363.
[11]Renehan AG,Tyson M,Egger M,et al. Body-mass index and incidence of cancer:a systematic review and meta-analysis of prospective observational studies [J]. Lancet,2008,371(9612):569- 578.
[12]Bhaskaran K,Douglas I,Forbes H,et al. Body-mass index and risk of 22 specific cancers:a population-based cohort study of 5.24 million UK adults [J]. Lancet,2014,384(9945):755- 765.
[13]Alemán JO,Eusebi LH,Ricciardiello L,et al. Mechanisms of obesity-induced gastrointestinal neoplasia [J]. Gastroenterology,2014,146(2):357- 373.
[14]Liu Y. Fatty acid oxidation is a dominant bioenergetic pathway in prostate cancer [J]. Prostate Cancer Prostatic Dis,2006,9(3):230- 234.
[15]Jerby L,Wolf L,Denkert C,et al. Metabolic associations of reduced proliferation and oxidative stress in advanced breast cancer [J]. Cancer Res,2012,72(22):5712- 5720.
[16]Khasawneh J,Schulz MD,Walch A,et al. Inflammation and mitochondrial fatty acid beta-oxidation link obesity to early tumor promotion [J]. Proc Natl Acad Sci USA,2009,106(9):3354- 3359.
[17]Calabrese C,Pisi A,Di Febo G,et al. Biochemical alterations from normal mucosa to gastric cancer byexvivomagnetic resonance spectroscopy [J]. Cancer Epidemiol Biomarkers Prev,2008,17(6):1386- 1395.
[18]Tugnoli V,Mucci A,Schenetti L,et al.ExvivoHR-MAS Magnetic Resonance Spectroscopy of human gastric adenocarcinomas:a comparison with healthy gastric mucosa [J]. Oncol Rep,2006,16(3):543- 553.
[19]Luo Z,Zhang Q,Zhao Z,et al. OLFM4 is associated with lymph node metastasis and poor prognosis in patients with gastric cancer [J]. J Cancer Res Clin Oncol,2011,137(11):1713- 1720.
[20]Liu RH,Yang MH,Xiang H,et al. Depletion of OLFM4 gene inhibits cell growth and increases sensitization to hydrogen peroxide and tumor necrosis factor-alpha induced-apoptosis in gastric cancer cells [J/OL]. J Biomed Sci,2012,19:38. [2014- 09- 15]. http://www.jbiomedsci.com/content/19/1/38.
[21]周崇治,韩杨,凃威伟,等.同源盒基因家族在胃癌中差异表达的研究[J]. 中华实验外科杂志,2013,30(7):1507- 1510.
[22]Han Y,Tu WW,Wen YG,et al. Identification and validation that up-expression of HOXA13 is a novel independent prognostic marker of a worse outcome in gastric cancer based on immunohistochemistry [J/OL]. Med Oncol,2013,30(2):564. [2014- 09- 15]. http://link.springer.com/article/10.1007%2Fs12032- 013- 0564- 1.
[23]Ge J,Chen Z,Wu S,et al. A clinicopathological study on the expression of cadherin- 17 and caudal-related homeobox transcription factor(CDX2)in human gastric carcinoma [J]. Clin Oncol(R Coll Radiol),2008,20(4):275- 283.
[24]Wang J,Kang WM,Yu JC,et al. Cadherin- 17 induces tumorigenesis and lymphatic metastasis in gastric cancer through activation of NFκB signaling pathway [J]. Cancer Biol Ther,2013,14(3):262- 270.
[25]Lin Z,Zhang C,Zhang M,et al. Targeting cadherin- 17 inactivates Ras/Raf/MEK/ERK signaling and inhibits cell proliferation in gastric cancer [J/OL]. PLoS One,2014,9(1):e85296. [2014- 09- 15]. http://www.plosone.org/article/info%3Adoi%2F10.1371%2Fjournal.pone.0085296.
·论著·
ZU Ming1,XU Xue1,ZHOU Wei-xun2,FEI Gui-Jun1,WU Xi1,YAO Fang1,LI Yuan2,CHENG Shu-jun3,LU Xing-hua1
1Department of Gastroenterology,2Department of Pathology,PUMC Hospital,
CAMS and PUMC,Beijing 100730,China
3State Key Laboratory of Molecular Oncology,Cancer Institute Hospital,CAMS and PUMC,Beijing 100021,China
Corresponding author:LU Xing-huaTel:010- 69155770,E-mail:Lxhbj2000@aliyun.com
ABSTRACT:ObjectiveTo investigate the whole genome expression profiles between gastric high-grade intraepithelial neoplasia(HGIN)tissues with cancer and HGIN tissues without cancer. MethodsGastric specimens from an upper magnifying chromoendoscopic targeted biopsy were collected at Peking Union Medical College Hospital from March 2010 to May 2013. Each of the forceps biopsies from the 21 patients was HGIN,but there were 10 HGIN and 11 HGIN with cancer after the endoscopic submucosal dissection. The whole genome expression profiling was performed on 10 HGIN samples and 11 HGIN with cancer samples using Agilent 4 × 44K Whole Human Genome microarrays. Differentially expressed genes between different types of lesions were identified using an unpaired t-test and corrected with the Benjamini and Hochberg false discovery rate algorithm. A gene ontology(GO)enrichment analysis was performed using the GeneSpring software GX 12.6. ResultsThe gene expression patterns were different between HGIN tissues with cancer and HGIN tissues without cancer. There were 470 significantly differentially expressed transcripts between them(P<0.05,Fold Change>2),with 180 up-regulated genes and 290 down-regulated genes in HGIN tissues with cancer. A GO enrichment analysis demonstrated that the most striking over-expressed transcripts in HGIN with cancer were in the category of triglyceride biosynthetic process,acylglycerol biosynthetic process,neutral lipid biosynthetic process,glycerol ether metabolic process,organic ether metabolic process,and glycerolipid metabolic process. ConclusionThe change of lipid metabolism may contribute to the pathogenesis of gastric cancer at an early stage.
Key words:gastric high-grade intraepithelial neoplasia;gastric cancer;whole genome expression microarray
收稿日期:(2014- 09- 30)
DOI:10.3881/j.issn.1000- 503X.2015.01.005
中图分类号:R735.2
文献标志码:A
文章编号:1000- 503X(2015)01- 0023- 07
通信作者:陆星华电话:010- 69155770,电子邮件:Lxhbj2000@aliyun.com
基金项目:卫生部卫生公益性行业科研专项经费项目(200902002-3)Supported by the Specific Grants of Public-Funded Projects in the Health Industry(200902002- 3)
