外加磁场对SPIO-shRNA分子探针转染卵巢癌SKOV3细胞的影响
2015-02-18葛晓东李妹玲邓小林吴晓凤曾丹妮廖蕤堃李少林
葛晓东,李妹玲,邓小林,吴晓凤,曾丹妮,廖蕤堃,文 明,李少林
重庆医科大学附属第一医院放射科,重庆 400016
外加磁场对SPIO-shRNA分子探针转染卵巢癌SKOV3细胞的影响
葛晓东,李妹玲,邓小林,吴晓凤,曾丹妮,廖蕤堃,文明,李少林
重庆医科大学附属第一医院放射科,重庆 400016
摘要:目的探讨外加磁场对SPIO-shRNA分子探针转染人卵巢癌SKOV3细胞的影响。方法设定质量浓度为45 mg/L的SPIO-shRNA分子探针转染人卵巢癌SKOV3细胞,并将SKOV3细胞分为3组:未转染的细胞组(空白对照组),SPIO-shRNA分子探针转染的细胞组(阴性对照组),培养皿底部外加磁场的SPIO-shRNA分子探针转染的细胞组(实验组)。采用流式细胞术检测细胞转染率,CCK- 8法检测细胞增殖及活性,Western blot法检测细胞表皮生长因子受体(EGFR)蛋白水平,荧光定量PCR检测EGFR mRNA 水平,磁共振(MR)扫描检测细胞内信号强度变化。结果与阴性对照组比较,实验组的细胞转染率[(79.20±3.31)%]显著增加(P=0.001);实验组的细胞活性(P=0.011)、EGFR蛋白及mRNA表达量均明显降低(P均<0.05);实验组的MR图像信号强度明显降低( P=0.0004)。结论外加磁场可以诱导SPIO-shRNA分子探针进入卵巢癌SKOV3细胞,从而提高细胞的转染率。
关键词:分子探针;磁场;SKOV3细胞;转染
ActaAcadMedSin,2015,37(1):12-16
分子影像学能够在无创条件下,早期可视化疾病的特异性分子变异及病理改变过程,是近年研究热点,而实现分子成像的关键技术之一是制备特异性高、亲和力强的分子探针[1- 2]。本课题组前期已经成功制备出针对人卵巢癌SKOV3细胞表皮生长因子受体(epidermal growth factor receptor,EGFR)的磁性纳米分子探针(SPIO-shRNA分子探针),考虑到在随后的活体动物实验中,外周静脉注射的分子探针的体内循环时间较长,可能会影响到达病变部位的探针浓度,因此有必要通过某种诱导方式,来提高分子探针的靶向剂量。磁转染是指通过外部磁场作用,使包含基因等的磁性纳米粒子载体聚集在靶向细胞附近,促进其被靶向细胞摄取,具有转染效率高、靶向性强及安全性好等优点[3]。本研究通过观察在外加磁场条件下,SPIO-shRNA分子探针体外转染人卵巢癌SKOV3细胞的能力,探讨提高SPIO-shRNA分子探针转染效率的方法,以期为活体动物实验提供理论依据和实验数据。
材料和方法
材料SPIO-shRNA分子探针由本课题组合成[2]。人卵巢癌SKOV3细胞株购自中国科学院上海生命科学研究院细胞资源中心。RPMI- 1640培养基及胎牛血清(美国Gibco公司),0.25%胰蛋白酶(美国Hyclone公司),兔抗人EGFR抗体(北京博奥森生物技术有限公司),CCK- 8试剂盒(上海BestBio贝博生物公司),RNA抽提试剂盒、反转录试剂盒以及荧光定量PCR试剂盒(日本Takara公司),PCR引物序列由美国Invitrigon公司合成。CO2恒温细胞培养箱(美国Thermo Fisher公司),多功能酶标仪(美国Bio-Tek公司),永磁王钕铁硼强力磁铁(上海金昆磁电科技有限公司),流式细胞仪(美国BD公司),凝胶成像系统(美国Bio-Rad公司),荧光定量PCR仪(美国Bio-Rad公司),3.0 T超导型MR成像仪以及8通道腕关节线圈(美国GE公司)。
SPIO-shRNA分子探针转染卵巢癌细胞人卵巢癌SKOV3细胞置于含10%胎牛血清的RPMI- 1640培养基中,于37 ℃、5% CO2培养箱中培养,选择对数生长期细胞用于实验。将SKOV3细胞分为3组:未转染的细胞组(空白对照组),SPIO-shRNA分子探针转染的细胞组(阴性对照组),外加磁场的SPIO-shRNA分子探针转染的细胞组(实验组)。磁场条件:在SPIO-shRNA分子探针转染SKOV3细胞时,于细胞培养皿下固定钕铁硼磁铁(25 mm×25 mm×10 mm,B=250 mT)15 min。将各组细胞置于37 ℃、5% CO2培养箱中培养24 h,用于后续试验。
流式细胞仪检测细胞转染率转染24 h后收集各组细胞,直接于流式细胞仪上机检测。实验重复3次。阳性荧光细胞数与总的细胞数之比即为细胞转染率。
CCK- 8法检测细胞活性取200 μl细胞悬液以2.0×103个/ml的浓度接种于96孔培养板,每组设3个复孔,培养12 h后,空白对照组不加探针,阴性对照组及实验组各孔分别加入SPIO-shRNA分子探针10 μl,同时在实验组各孔下固定钕铁硼磁铁15 min,于37 ℃、5% CO2培养箱培养24 h。PBS清洗3次,每孔加入10 μl CCK- 8溶液,培养箱孵育4 h,酶标仪测定450 nm波长处各孔光密度值(optical density,OD值)。细胞活性(%)=[(实验组OD-空白组OD)/(对照组OD-空白组OD)]×100%。
Western blot法检测EGFR蛋白表达水平分别收集3组细胞(1×106/组)并提取总蛋白,检测各组蛋白质浓度,SDS-PAGE凝胶电泳分离蛋白质,然后将蛋白电转印至PVDF膜上,并置于5%脱脂牛奶室温封闭l h,再加入兔抗人EGFR抗体(稀释比例1∶400)以及Actin内参蛋白抗体(稀释比例1∶1000)4 ℃孵育过夜,TBST洗涤3次,每次5 min,加入辣根过氧化物酶标记的二抗(稀释比例1∶1000)孵育2 h,TBST洗涤3次,每次5 min,ECL化学发光,Bio-Rad凝胶成像系统采集图像,Quantity one软件进行灰度值分析,每组重复3次。
荧光定量PCR检测EGFR mRNA表达水平提取各组细胞总RNA,酶标仪测定RNA浓度和纯度,取1 μg RNA采用逆转录试剂盒合成cDNA。各组分别取1 μl cDNA 作为反应模板,分别以EGFR和β-Actin特异性引物进行荧光定量PCR。引物序列:(1)β-Actin:上游序列5’-TGACCCAGATCATGTTTGAGACC- 3’,下游序列5’-GAGTCCATCACGATGCCAGTAG- 3’;(2)EGFR:上游序列5’-CCAAGGCACGAGTAACAAGC- 3’,下游序列5’-AGGGCAATGAGGACATAACCAG- 3’。反应条件:预变性95 ℃ 30 s;变性95 ℃ 3 s,退火延伸60 ℃ 30 s,40个循环。各组分别选择3个复孔,记录各组的循环阈值Ct,目的基因的表达量用2-△△Ct进行分析,△Ct=CtEGFR-Ctβ-Actin,△△Ct=△CtEGFR-△Ct空白对照组。
体外MR扫描各组细胞使用0.25%胰酶消化,800 r/min离心3 min,弃上清,之后将各组细胞置于1.5 ml含有1%琼脂糖EP管内,插于自制的泡沫板上并编号,置于3.0 T超导型MR腕关节线圈中做横断位扫描。具体扫描参数:T2*WI序列,翻转角度为23°,TE 12 ms,TR 250 ms,FOV 9×9 cm,激励次数3,层间距0.5 mm,矩阵 320×224。图像传至GE公司ADW 4.6工作站,选择20 mm2圆形游标为感兴趣区,分别测量同层面各组细胞的信号强度,每个感兴趣区重复测量3次并取平均值。
统计学处理采用SPSS 17.0统计学软件,计量资料以均数±标准差表示,多组比较采用单因素方差分析,组间比较采用LSD法,P﹤0.05为差异有统计学意义。
结果
SPIO-shRNA分子探针转染SKOV3细胞的转染率空白对照组细胞转染率为(0.62±0.16)%,阴性对照组细胞转染率为(62.54±4.92)%,实验组细胞转染率为(79.20±3.31)%;与阴性对照组比较,实验组的细胞转染率显著增加(P=0.001)。
SPIO-shRNA分子探针转染抑制SKOV3细胞活性阴性对照组与实验组的细胞活性分别为(49.96±8.89)%和(21.36±10.24)%,均明显低于空白对照组的100%(P均<0.05),实验组的细胞活性与阴性对照组相比差异有统计学意义(P=0.011)。
磁转染诱导SKOV3细胞内EGFR蛋白水平下降空白对照组、阴性对照组和实验组细胞EGFR蛋白表达量分别为99.02±0.13、48.62±9.76和22.63±5.98。其中,实验组细胞EGFR蛋白的表达量明显低于阴性对照组和空白对照组(P均<0.05)(图1)。
磁转染诱导SKOV3细胞内EGFR mRNA水平下降以空白对照组作为标准,实验组及阴性对照组SKOV3细胞中的EGFR mRNA水平均有所降低,表达量分别为22.01±9.61和43.22±14.08,其中,实验组较阴性对照组EGFR mRNA表达量降低约为21%,两者差异有统计学意义(P=0.0008)(图2)。
SPIO-shRNA分子探针转染SKOV3细胞降低MR图像信号强度空白对照组、阴性对照组和实验组磁共振T2*WI图像信号强度分别为618.88±5.18、148.81±1.22和241.36±1.27。实验组的细胞信号强度显著低于阴性对照组(P=0.0004)和空白对照组(P=0.0000)(图3)。

EGFR:细胞表皮生长因子受体
EGFR:epidermal growth factor receptor
图 1各组SKOV3细胞EGFR蛋白表达结果
Fig 1EGFR protein expressions in three groups(Western blot analysis)

与阴性对照组比较,aP=0.0008
aP=0.0008 compared with the negative control group
图 2各组SKOV3细胞EGFR mRNA基因表达水平
Fig 2Expression levels of EGFR mRNA after transfection into SKOV3 cells in three groups
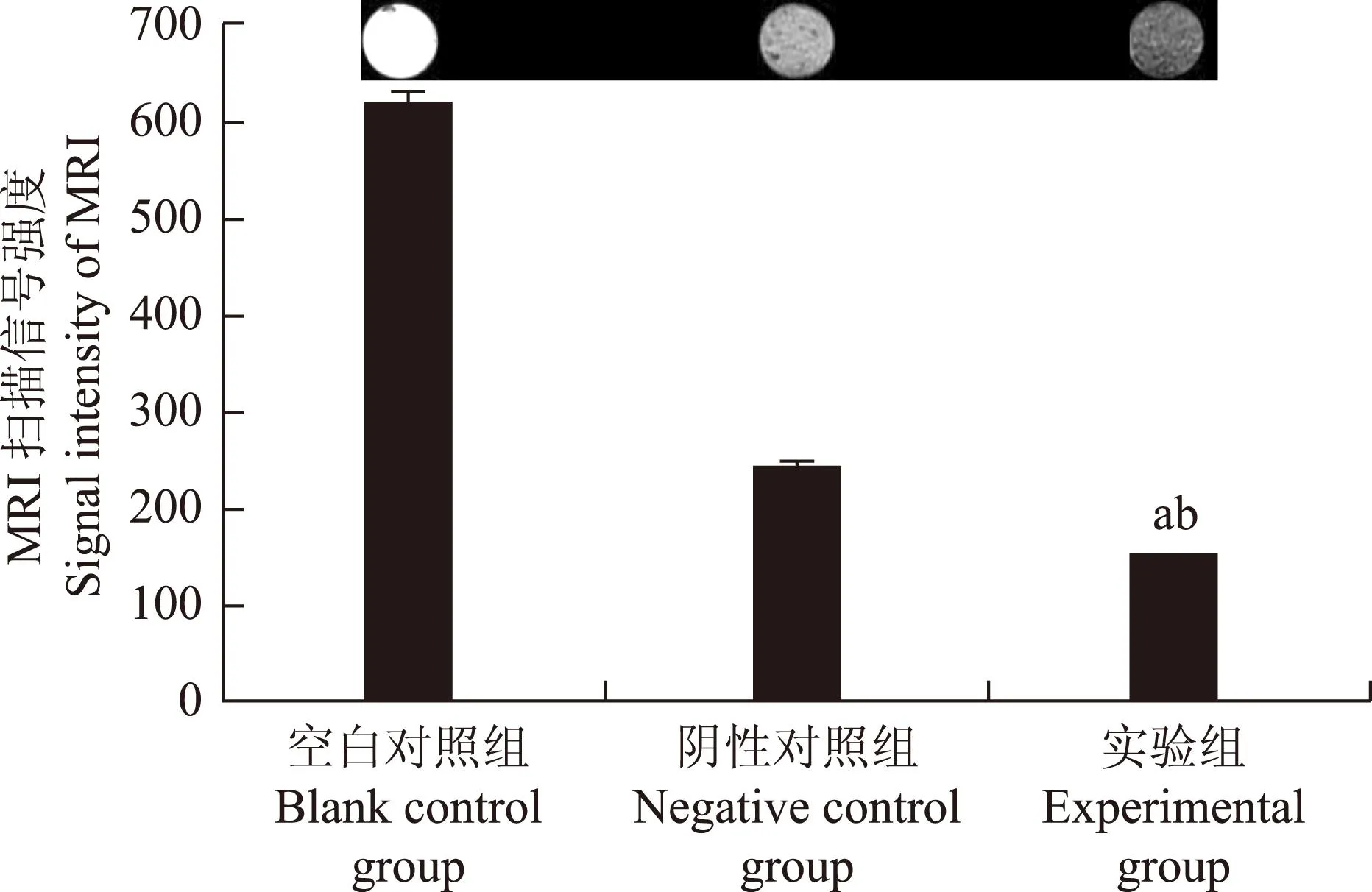
与空白对照组比较,aP=0.0000;与阴性对照组比较,bP=0.0004
aP=0.0000 compared with the blank control group;bP=0.0004 compared with the negative control group
图 3不同转染组MR T2*WI成像结果
Fig 3MR T2*WI imaging results in three groups
讨论
卵巢癌是女性生殖系统最常见的恶性肿瘤之一,由于深居盆腔,早期诊断极为困难,找到早期特异性诊断进而早期治疗的方法,是提高患者生存率、改善生活质量的关键。结合RNA干扰的特异靶向性及MR对SPIO检测的敏感性,本课题组前期成功合成了SPIO-shRNA分子探针,该探针含有不成对的Fe3+电子,能够改变组织周围的磁场环境,造成弛豫时间明显缩短,从而在MR图像上呈现低信号[4];同时,shRNA进入细胞后产生特异性的RNA干扰效应,能够抑制基因表达,诱导细胞凋亡[5]。通过一系列检测结果显示,该探针同时具有诊断及治疗的双重功能[2],且SKOV3细胞最佳转染浓度为45 mg/L。因此,本研究采用质量浓度为45 mg/L SPIO-shRNA分子探针转染卵巢癌SKOV3细胞,观察外加磁场对其转染效率的影响。
SPIO-shRNA分子探针转染细胞效率的提高可以增强其对卵巢癌诊断及治疗的效果。多项研究表明,通过体外实验在细胞培养皿底部外加磁场,可使细胞的转染率提高3~36倍不等[6- 13]。分子探针中的磁性颗粒借助外加静态磁场,能够增加其与细胞膜接触时间以及接触量,从而提高转染效率,此方法称为磁转染,是近年来兴起的一种新的基因物理靶向递送技术,最早应用于乳腺癌细胞、肝细胞、骨髓间充质干细胞、壶腹癌细胞以及血管内皮生长因子等局部转染,此外利用该方法进行反义核苷酸体外、体内转染也取得了较好效果[8]。由此可见,磁转染是一种提高细胞内探针浓度的有效方法,但其是否也能提高SPIO-shRNA分子探针转染SKOV3细胞的效率,目前未见相关文献报道,这也是本研究亟待解决的问题。
通过对各组细胞流式细胞术、Western blot法以及荧光定量PCR检测结果发现,外加磁场后,细胞转染率提高约17%,EGFR蛋白表达量及mRNA水平的抑制率均大于20%,说明外加磁场后,与EGFR结合的探针量明显增加,从而出现抑制卵巢癌SKOV3细胞EGFR mRNA及蛋白表达的效果,这些结果表明,外加磁场能够提高细胞的转染率。郑洁等[14]在SPIO标记间充质干细胞定向迁移的试验中,采用CCK- 8法证实外加磁场对SPIO标记细胞的增殖及活性均无负面影响。Schiffer等[15]报道EA2细胞暴露在7 T磁场强度条件下,其增殖和活性同样未受影响,而本研究CCK- 8实验结果显示,加入SPIO-shRNA分子探针后,SKOV3细胞增殖及活性均有所降低,与上述报道结论不一致,这可能与分子探针中的shRNA靶向结合肿瘤细胞内EGFR基因后,抑制EGFR基因表达,诱导细胞凋亡有关。此外,本研究CCK- 8检测结果还显示,外加磁场后,实验组细胞活性明显低于阴性对照组,提示实验组可能有更多的SPIO-shRNA分子探针进入细胞,间接说明外加磁场可能会增加细胞的转染率。
本研究MR扫描结果显示,实验组信号强度最低,且与阴性对照组相比差异有统计学意义,这是由于在外加磁场作用下,进入SKOV3细胞内的分子探针数量明显增加,Fe3+改变了周围磁场环境,产生磁敏感效应,导致信号强度降低,这也进一步证明了外加磁场能够增加探针的转染率。
综上,在外加磁场作用下,SPIO-shRNA分子探针更易靶向进入SKOV3细胞内,进而提高细胞的转染率。当然,本实验是在体外培养条件下进行的,可能会与体内实验条件存在差异,外加磁场能否对SPIO-shRNA分子探针活体转染实体肿瘤组织产生影响,以及最佳的外部磁场强度及磁化时间等问题,将是今后重要的研究方向之一。
参考文献
[1]Al Faraj A,Shaik AS,Afzal S,et al. MR imaging and targeting of a specific alveolar macrophage subpopulation in LPs-induced COPD animal model using antibody-conjugated magnetic nanoparticles [J]. Int J Nanomedicine,2014,9(1):1491- 1503.
[2]文曦琳,李易,葛晓东,等. SPIO-PLL-pshRNA分子探针转染卵巢癌SKOV3细胞及MR成像研究 [J].重庆医科大学学报,2014,39(4):498- 502.
[3]Prosen L,Prijic S,Music B,et al. Magnetofection:a reproducible method for gene delivery to melanoma cells[J]. Biomed Res Int,2013,2013:209452.doi:10.1155/2013/209452.
[4]Wabler M,Zhu W,Hedayati M,et al. Magnetic resonance imaging contrast of iron oxide nanoparticles developed for hyperthermia is dominated by iron content [J]. Int J Hyperthermia,2014,30(3):192- 200.
[5]Hong H,Zhang Y,Cai W.Invivoimaging of RNA interference[J]. J Nucl Med,2010,51(2):169- 172.
[6]Prijic S,Sersa G. Magnetic nanoparticles as targeted delivery systems in oncology [J]. Radiol Oncol,2011,45(1):1- 16.
[7]Leung KC,Lee SF,Wong CH,et al. Nanoparticle-DNA-polymer composites for hepatocellular carcinoma cell labeling,sensing,and magnetic resonance imaging [J]. Methods,2013,64(3):315- 321.
[8]Krotz F,de Wit C,Sohn HY,et al. Magnetofection-a highlyeicient tool for antisense oligonucleotide deliveryinvitroandinvivo[J]. Mol Ther,2003,7(5 pt 1):700- 710.
[9]Prijic S,Prosen L,Cemazar M,et al. Surface modified magnetic nanoparticles for immu no-gene therapy of murine mammary adenocarcinoma [J]. Biomaterials,2012,33(17):4379- 4391.
[10]Prijic S,Scancar J,Romih R,et al. Increased cellular uptake of biocompatible superparamagnetic iron oxide nanoparticles into malignant cells by an external magnetic field [J]. J Membr Biol,2010,236(1):167- 179.
[11]黄国庆,李欣,廖晓星,等. 外加磁场诱导超顺磁氧化铁标记骨髓间充质干细胞迁移的体外研究 [J]. 中山大学学报:医学科学版,2011,32(5):683- 688.
[12]Laurentt N,Sapet C,Le Gourrierec L,et al. Nucleic acid delivery using magnetic nanoparticles:the magnetofection technology[J]. Ther Deliv,2011,2(4):471- 482.
[13]陈本科,王晓文,阚思行,等. 用于高效磁转染的鱼精蛋白修饰的铁氧磁性纳米粒研究[J]. 科技导报,2010,28(19):63- 67.
[14]郑洁,陈晓丹,郑希,等. 体外磁铁定向迁移 SPIO 标记的间充质干细胞对大鼠脑缺血治疗的影响 [J]. 基础医学与临床,2013,10(33):1088- 1094.
[15]Schiffer IB,Schreiber WG,Graf R,et al.No influence of magnetic fields on cell cycle progression using conditions relevant for patients during MRI [J].Bioelectromagnetics,2003,24(3):241- 250.
·论著·
Effects of External Magnetic Field on the Transfection Rate of SPIO-shRNADual Functional Molecular Probe into Ovarian Carcinoma SKOV3 Cells in Vitro
GE Xiao-dong,LI Mei-ling,DENG Xiao-lin,WU Xiao-feng,ZENG Dan-ni,LIAO Rui-kun,WEN Ming,LI Shao-lin
Department of Radiology,the First Affiliated Hospital of Chongqing Medical University,Chongqing 400016,China
Corresponding author:WEN MingTel:023- 89013721,E-mail:13883669699@163.com
ABSTRACT:ObjectiveTo explore the transfection rate of SPIO-shRNA dual functional molecular probe into ovarian carcinoma SKOV3 cells in external magnetic field. MethodsDual functional molecular probe at an iron concentration of 45 mg/L was transfected into SKOV3 cells. The cells with coexisting probe and magnetic fields were set as the intervention group,the probe-transfected cells as negative control group,and normally cultured SKOV3 without any transfection as blank control group. The transfection rate was detected by flow cytometry. Cell viability was observed by CCK- 8 assay. Epidermal growth factor receptor(EGFR) expression level in SKOV3 cells was determined by real-time quantitative PCR and Western blot analysis.The signal intensity was measured by magnetic resonance imaging(MRI). ResultsThe transfection rate of the intervention group was (79.20±3.31)%,which was significantly higher than that of negative control group(P=0.001). Compared with the negative control group,the cell viability of the intervention group significantly decreased(P=0.011), protein and mRNA expression levels of EGFR in the intervention group were significantly decreased(both P<0.05). The signal intensity on T2*WI in the intervenion group also significantly decreased(P=0.0004). ConclusionThe external magnetic field can improve the transfection efficiency SPIO-shRNA dual functional molecular probe into ovarian carcinoma SKOV3 cells.
Key words:molecular probe;magnetic field;SKOV3 cells;transfection
收稿日期:(2014- 05- 22)
DOI:10.3881/j.issn.1000- 503X.2015.01.003
中图分类号:R737.3
文献标志码:A
文章编号:1000- 503X(2015)01- 0012- 05
通信作者:文明电话:023- 89013721,电子邮件:13883669699@163.com
基金项目:国家自然科学基金(81171366)和国家临床重点专科建设项目(2013- 544)Supported by the National Natural Sciences Foundation of China(81171366)and the National Clinical Key Subject Construction Project(2013- 544)
