如何判断复杂复分解反应的产物
2015-02-17吴文中浙江省越州中学浙江绍兴312075
吴文中(浙江省越州中学 浙江绍兴 312075)
如何判断复杂复分解反应的产物
吴文中
(浙江省越州中学浙江绍兴312075)
摘要:复分解反应的活化能几乎为0,但各种离子的扩散速率不尽相同,多种离子参加反应时,到底哪种离子首先碰撞先发生反应,难以判断,事实上也不重要,化学反应实际上就是状态Ⅰ转化为状态Ⅱ的过程(假设状态Ⅱ为反应的结果),文章认为状态Ⅱ中存在的各种平衡关系是判断复分解反应最终产物的依据。
关键词:复杂复分解反应;电离平衡;产物判断
中图分类号:
文章编号:1008-0546(2015)02-0072-03G632.41
文献标识码:B
doi:10.3969/j.issn.1008-0546.2015.02.024
NH4HCO3溶液中滴加NaOH溶液,首先发生的反应是什么?定性分析能否确定?
假如NH4+先和OH-参加反应,得到氨水,氨水能和HCO3-共存吗?假如HCO3-先参加反应,得到CO32-,CO32-能与NH4+能大量共存吗?
以上的回答应当谨慎的,不可妄下结论,简单的定性分析往往不足以说明上述问题,也不具说服力,在教学中,把结论强加给学生的做法不但“不时髦”,也是“不明智”的,也会使学生误以为化学学科的理性思维的缺乏。
学者曾应超的论文中提到:NH4HCO3与NaOH溶液的反应和反应物的量是无关的(即反应几乎没有先后之分的),可以用同一离子反应方程式来描述[1],论文中首先阐述了碳酸类和氨类体系中相关粒子和溶液pH的关系,而后得出结论,文章的确解决了NH4+和HCO3-与OH-竞争反应问题,但其理由和反应体系是隔离的,本文将直接从NH4HCO3溶液与NaOH溶液的反应体系入手,通过改变反应物之间量的关系,计算出反应体系相关粒子的浓度,依据变化的趋势得出NH4HCO3溶液中加入NaOH溶液的真实反应情景。
一、问题的起因
假如OH-先和NH4+参加反应,得到氨水,有人认为NH3·H2O是能够和NaHCO3溶液反应的,得到Na2CO3和(NH4)2CO3,意思该假设错误,结论是HCO3-先和OH-先反应。
但假如OH-先和HCO3-反应,得到CO32-,那么CO32-能与NH4+共存吗?
查阅资料表明:对于(NH4)2CO3溶液来说,不但有NH4+的水解,同时存在CO32-的水解,两种性质相反的离子都水解,相互促进,水解几乎彻底,具体讨论如下:
(NH4)2CO3的水解常数为K=Kw÷(Kb×Ka2),其中Kb为氨水的电离常数,Ka2是碳酸的二级电离常数,Kw为水的离子积(T=298K,下同)。
已知Ka2=5.6×10-11,Kb=1.8×10-5,Kw=10-14,求得(NH4)2CO3的水解平衡常数为K约为103,假如(NH4)2CO3溶液的浓度为0.1 mol/L,计算表明(NH4)2CO3溶液大约90%水解,即(NH4)2CO3溶液实际上就是NH4HCO3和NH3·H2O的混合物溶液,即HCO3-和NH3·H2O可以共存。甚至有人认为(NH4)2CO3实为NH4HCO3和NH2COONH4(氨基甲酸铵),也就是说,工艺上纯净的(NH4)2CO3并不能制备[2]。
至此,我们显然无法判断一定量的NH4HCO3与一定量的NaOH溶液混合后的产物到底是什么。
二、理论计算
在NH4HCO3溶液中滴加NaOH溶液,主要发生以下两个过程:
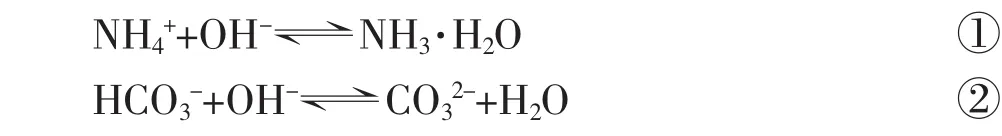
一般来说,对同类化学反应而言(反应机理几乎一样时),若化学平衡常数越大,则反应进行得越完全彻底[3],在同一个体系中,多个平衡之间既相互联系、又相互制约,平衡常数大的反应,最终反应物减少量
更大,至于溶液中到底哪些粒子首先碰撞而发生反应,其实是不重要的,重要的是,反应结束后体系状态II是怎样的。
三、计算机辅助作图显示状态Ⅱ各粒子浓度的变化趋势
1.研究NH4HCO3溶液中加NaOH固体后体系粒子浓度的变化趋势
假设在0.1mol/LNH4HCO3溶液加入x mol固体NaOH后(把加入NaOH溶液改为加入固体,不影响讨论结果,且设加入固体后溶液总体积变化忽略不计,下同),则溶液中存在如下关系(其中,单位为mol/L):
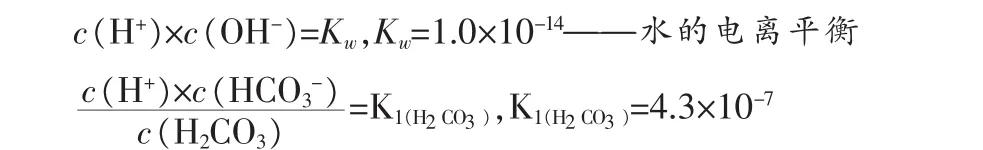
——碳酸一级电离平衡
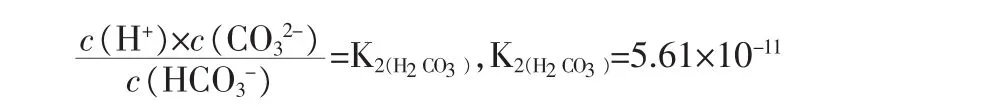
——碳酸二级电离平衡
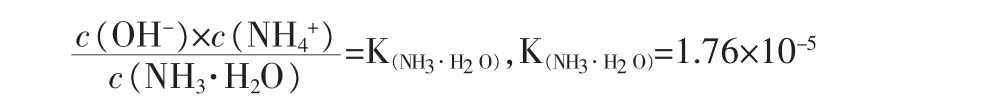
——氨水的电离平衡
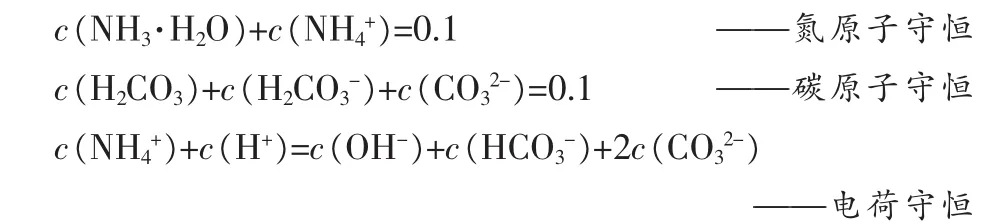
注:忽略NH3分子的存在(NH3分子浓度极低[4]),不影响讨论结果。
假设:c(H+)=a,c(OH-)=b,c(NH4+)=c,c(NH+·H2O)=e,c(HCO3-)=f,c(CO32-)=y,c(H2CO3)=z
打开Wolfram Mathematica 8应用平台(或别的应用软件),新建笔记本,键入:Solve[expr,vars,dom]语句如下:(即利用以上等量关系,建立方程式,解多元多次方程组)
Solve[{c+x+a=b+f+2y,a×b=1×10-14,(a×f)/z=4.3× 10-7,(a×y)/f=5.61×10-11,(b×c)/e=1.76×10-5,c+e=0.1,(y+f+z)=0.1,x=0},{x,y,z,a,b,c,e,f}]
令x分别为0,0.01,0.02,0.03,0.04,0.05,0.06,0.07,0.08,0.09,0.1,0.12,0.14,0.16,0.18,0.2,0.225,0.25,0.275,0.3,0.325,0.35,0.375,0.4(单位:mol),利用上述计算机语句,运行程序,分别计算体系中各种粒子浓度,见表1:
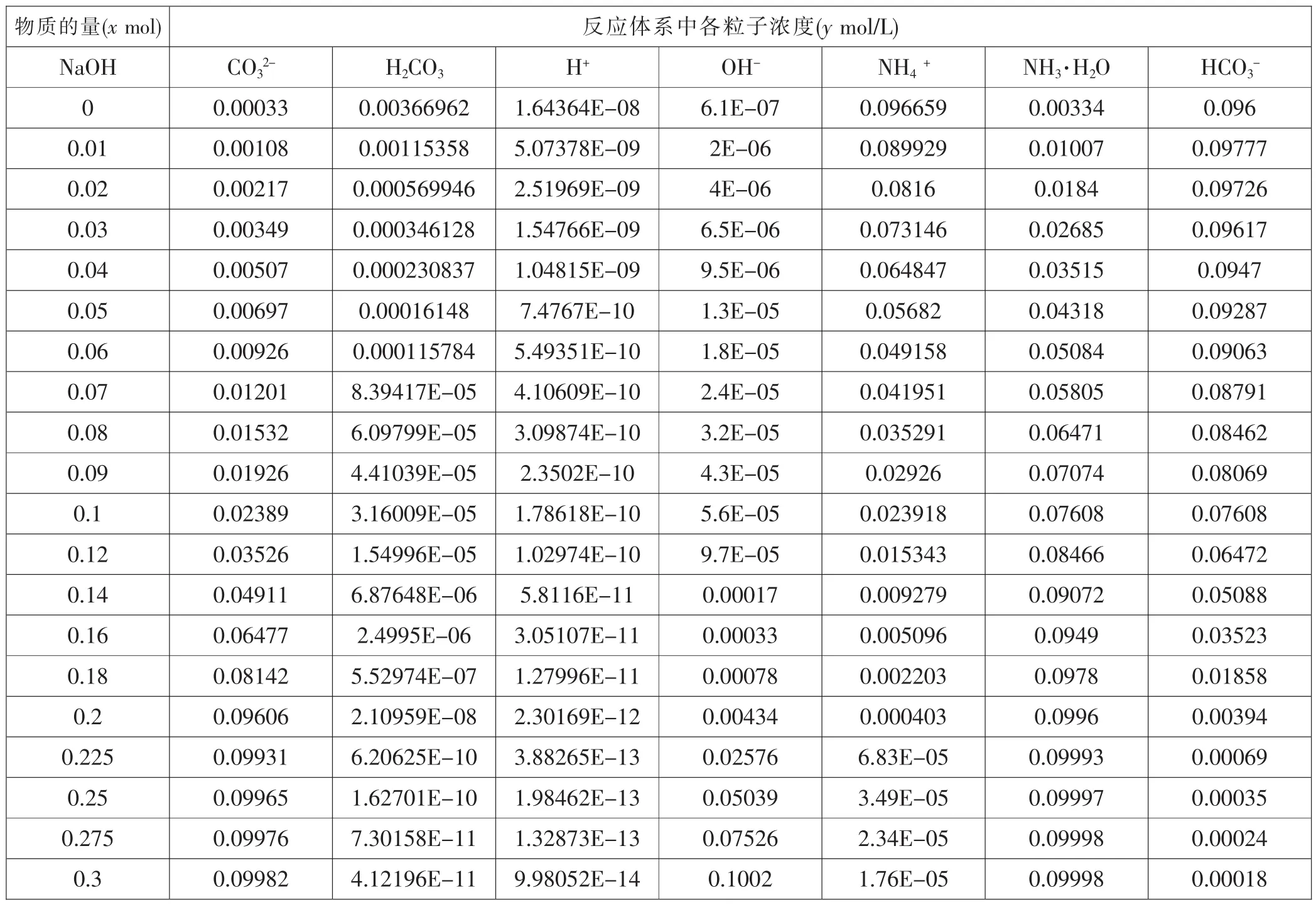
表1 0.1mol/L的NH4HCO3溶液中加入x mol NaOH(s)后各粒子浓度

0.325 0.09986 2.64268E-11 7.99001E-14 0.12516 1.41E-05 0.09999 0.00014 0.35 0.09988 1.83703E-11 6.66088E-14 0.15013 1.17E-05 0.09999 0.00012 0.375 0.0999 1.35051E-11 5.71064E-14 0.17511 1E-05 0.09999 0.0001 0.4 0.09991 1.03442E-11 4.99756E-14 0.2001 8.79E-06 0.09999 8.9E-05
然后利用Microsoft Office Excel 2003,作图1(以加入的NaOH x mol为横坐标,各种粒子浓度为纵坐标作图,下同):描述在0.1mol/LNH4HCO3溶液中加NaOH固体后NH4+、NH3·H2O分子、HCO3-、CO32-等粒子浓度变化情况。
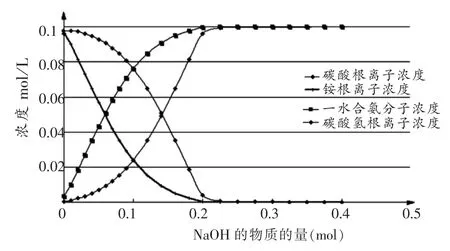
图1 在0.1mol/L的NH4HCO3溶液中加固体NaOH后,粒子浓度变化
从图1中可以看出,在NH4HCO3溶液中加固体NaOH后,NH4+浓度首先明显下降,NH3·H2O分子浓度首先明显升高,但是,HCO3-浓度也随之减小,当加入的NaOH的固体为0.2mol时,两者的浓度几乎为0,溶液中主要离子为CO32-和Na+。
反应到底那两种离子先发生并不重要,也无需纠结其反应的先后,我们只需知道状态Ⅱ的情景,前文提到的两种观点实为都有道理,溶液酸碱性的大小,影响了NH4+、HCO3-浓度,碱性越强,这两种离子浓度小,只是NH4+浓度随pH的变化,变化幅度更大而已,不能说NH4+首先反应,各种粒子浓度的变化都“为了”使得每一个可逆过程趋向平衡。
2.研究NH4HSO3溶液中加NaOH固体后体系粒子浓度的变化趋势
利用上述同样方法作图2:描述在0.1 mol/L NH4HSO3溶液中加NaOH固体后NH4+、NH3·H2O分子、HSO3-、SO32-等粒子浓度变化情况。
从图2中可以看出,在NH4HSO3溶液中加固体NaOH后,开始阶段,HSO3-离子浓度随NaOH的加入减少很明显,而NH4+离子几乎不变(但也变化,只是变化量非常小),当HSO3-离子浓度接近0时,NH4+离子才开始明显减小,当加入的NaOH的固体为0.2mol时,溶液中主要离子为SO32-和Na+。
难道我们就可据此判断:NH4+在开始加入NaOH固体时不和OH-反应吗?显然不能,NH4+在开始阶段也和OH-发生反应,只是NH4+减少程度很小而已。
假如一定要说该反应的先后,我们也只能依据最终状态的含量变化来说明,那样的话,我们可以说NH4HSO3溶液中加固体NaOH后,首先发生的反应的是HSO3-,甚至可以说是H+离子先和OH-离子反应。

图2 在0.1mol/L的NH4HSO3溶液中加固体NaOH后,粒子浓度变化
四、讨论
中学阶段,我们经常讲到的竞争反应,其涵义不是真正的反应先后问题,而是反应结果,我们往往把反应结果当作反应的先后,如在CH3COONa和NaHCO3混合溶液中加盐酸,只需计算CH3COO-和HCO3-和H+的反应的平衡常数(常数分别为5.7×104,2.3×106),很容易看出,可逆过程趋向平衡时,HCO3-和H+作用,得到的H2CO3浓度很大,最后分解为水和二氧化碳,这就是我们所说的先发生反应,但事实上,溶液中的CH3COO-也在减少,也得到CH3COOH分子,在复杂体系中,“也许”是CH3COO-先遇到高浓度的H+而发生反应也是可能的。
许多有关的离子竞争反应先后顺序问题,有时可能是想当然了,很多反应的先后到底怎样,实际上属于微观的动力学范畴,一般的实验无法验证,我们大多依据的是最终产物的多少来反推反应的先后,但实际上是不合理的,甚至是歪曲了微观反应过程的本来面貌。
但我们可以通过计算,得出状态Ⅱ的各种情况,得到最终主要产物是什么,次要
产物是什么,至于某反应的先后顺序,建议不要过多地强调。
参考文献
[1]曾应超.NH4HCO3与NaOH溶液的反应和反应物的量有关吗[J].化学教学,2013,(4)
[2]百度百科:http://baike.baidu.com/view/455682.htm?fr=aladdin
[3]朱志昂.近代物理化学(上下册)[M].北京:科学出版社,2004
[4]宋天佑,程鹏等.无机化学[M].北京:高等教育出版社,2009
