基于“感性认识 理性分析”的教学实践和反思——以“元素周期表·周期律”教学为例
2015-02-17丛高如东县教师发展中心江苏南通226400
丛高(如东县教师发展中心 江苏南通 226400)
基于“感性认识理性分析”的教学实践和反思——以“元素周期表·周期律”教学为例
丛高
(如东县教师发展中心江苏南通226400)
摘要:基于感性认识和理性认识两个不同的认识阶段,紧扣元素周期律和周期表这对“灵”和“肉”的关系,设计了认识元素周期表、认识元素周期律二个渐进的教学环节,从而体验元素周期表和元素周期律的“表里”完美统一。
关键词:感性认识;理性分析;元素周期表;周期律;金属性;非金属性
中图分类号:
文章编号:1008-0546(2015)02-0030-04G633.8
文献标识码:B
doi:10.3969/j.issn.1008-0546.2015.02.009
2014年11月2日,在江苏省第18届“金帆杯”教育科研活动中,笔者代表高中组参加课堂展示,在江苏省如东高级中学高一(1)班借班上了一堂新授课“元素周期表·周期律”。本文就这堂课的教学设计等相关环节的构思作一介绍。
一、设计理念
由于该校(江苏省四星级高中)高一学生刚刚教完人教版必修一的第三章,从知识储备上看具备了金属及其化合物的相关知识背景,故设计了三组学生小组实验,探究钾、钠、镁、铝单质的活动性强弱,让学生在实践中去体验。但还缺乏非金属及其化合物的相关知识做铺垫,所以设计了一个演示实验——滤纸上微型实验:探究氯、溴、碘单质的活动性强弱,以帮助学生建立对非金属性的感性认识。而人教版化学2[1]教材将周期表的学习置于周期律之前(苏教版化学2[2]正好相反),为了学生初步体验元素周期表和元素周期律的“表里”完美统一(其实这也是本节课教学的重难点),本节课采用由表及里,从感性上升到理性的教学思路,具体来说,先解决周期表是怎样的?从认知思维特点上看,高一的学生完全有能力认识周期表的结构,这部分的学习主要以学生交流展示为主。再理性分析为什么会是这样的?针对高一的学生的抽象思维能力相对薄弱,尽量发挥学生学习的自主性,通过设计分析几组层层推进的“数”、“形”、“意”相统一的图像,利用数学模型,加强对“周期性”的理解,提升抽象思维能力。最后体验周期表和周期律的运用是高潮,但限于学生现有发展区,本节课主要是从周期律发展历史流程图,理性客观评价化学史,本身就兼有课堂活动向课后延伸之意,以期“余音绕梁”。最后值得一提的是,本节课采用交互式电子白板技术辅助教学。
二、教学目标
1.知识与技能
(1)初步认识元素周期表的结构;
(2)以钾、钠、镁、铝为例,体验同一周期、同一主族内元素性质(如:化合价、原子半径、金属性等)的递变规律以及与原子结构的关系,从而初步了解元素周期律。
2.过程与方法
初步尝试从大量的事实和数据中分析总结规律、透过现象看本质(抽象归纳)、宏观与微观相互转化等科学抽象方法。
3.情感态度价值观
(1)从周期表的演变历史,培养学习自然科学的兴趣以及求知欲;
(2)从周期律的学习,初步树立辩证唯物主义观点:如事物是普遍联系的、对立与统一、量变与质变、结构决定性质等。
三、教学过程
1.情境导入
[师]我们先来做个游戏——借我一双慧眼!游戏规则是在1分钟内对屏幕无序的化学物质进行抢记,(不许用笔记录)1分钟后再动笔写在所发卡片上!组内先评选,推举一位代表本组进行组间的评比,所写物质正确且最多者即为获胜者!该组即为获胜组。
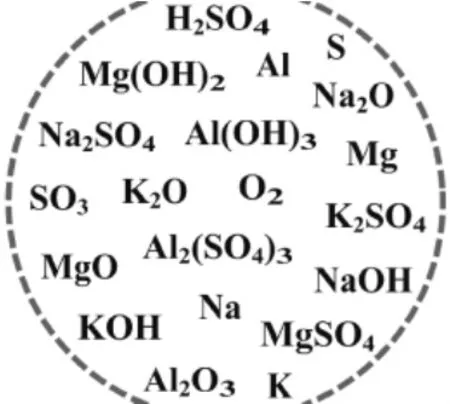
[师]展示学生成果,并有意识引导全班学生分享用分类思想进行记忆的学生们的思维方式。

利用实物投影仪展示的各小组卡片
教学反思:第一:以学生喜闻乐见的游戏方式,不仅可以活跃课堂气氛,提高学生的学习兴趣,同时,增强学生和谐竞争、小组合作的意识。第二:利用交互式电子白板的“幕布”功能,结合实物投影仪,使得游戏及评价变得更可操作。第三:如何对这些看似杂乱无序的化学物质快刀斩乱麻?即寻找它们之间的相互联系和内在变化,分类是个好办法!正所谓恰如其分的情境是激发学习动力的巨大源泉。

[师]联系到金属活动性顺序表给屈指可数的相关金属元素排序了,那么如何给人们现已发现的100多种元素排序?显然按照“一字长蛇”阵的办法无法解决?
教学反思:根据最近发展区,让学生进入“愤悱”的学习状态,同时为后面非金属顺序表打下伏笔。
2.活动一、认识神奇的周期表
[生]小组内交流对元素周期表结构的认识。
教学反思:基于学生是学习的主体,且人教版九年级上册也有关于元素周期表的简介,学生完全有能力感性认识元素周期表的结构,这部分的学习主要以学生交流展示为主,结合交互白板演示介绍元素周期表的软件。
[师]目前人们已经发现的118种元素都能在表中找到它的相应位置,也就是说每间“房间”都有了它的“主人”。那么这张表到底是怎么编排出来的?下面以钾、钠、镁、铝四种元素的位置关系为例讨论。
3.活动二、讨论周期表的编排原则,初步认识元素周期律
[师]请根据提供的试剂及仪器,小组合作设计实验证明钾、钠、镁、铝的金属性强弱,记录实验结果并交流。
[生]实验探究钾、钠、镁、铝单质的活动性强弱
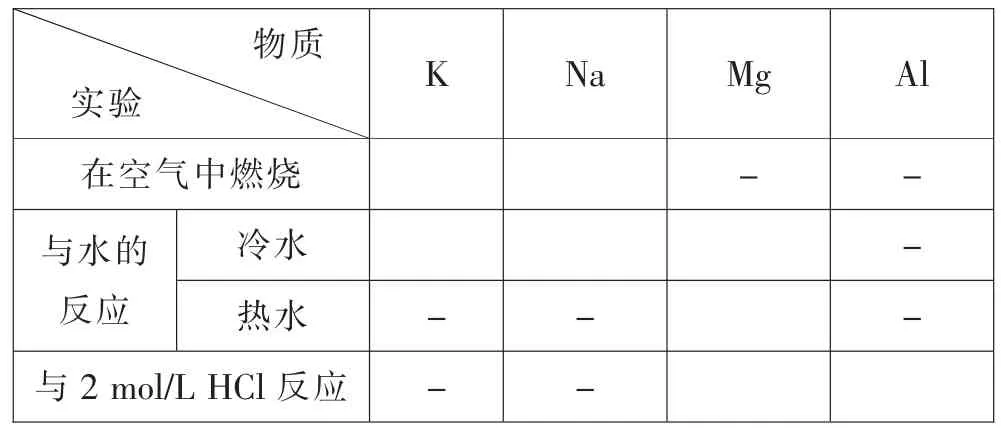
物质实验K Na Mg Al冷水 -热水-- -与2 mol/L HCl反应 - -在空气中燃烧 - -与水的反应
信息提示:通常情况下,元素的金属性(气态金属原子失去电子的能力)越强,其单质越容易从水或酸中置换出氢,该元素最高价氧化物的水化物的碱性越强。元素的非金属性越强,其单质越容易与氢气化合生成气态氢化物,气态氢化物越稳定,该元素最高价氧化物的水化物的酸性越强。
[师]那么铝和水的反应性如何呢?(结合图片讲述)美国《大众科学》网站2011年9月23日报道说有新理论认为美国世贸中心倒塌源于爆炸性化学反应,飞机撞击世贸大厦之后,大量熔化的铝液流入建筑受撞击部分下方的楼层,与大厦的自动喷水灭火设备喷出的数百公升水混合。铝与水相遇会引起化学反应,不但能够提高温度,反应过程中还会产生大量可燃性氢气。骤然升高的温度削弱了钢结构的支撑力,氢气爆炸异常强烈,足够炸毁部分建筑物[3]。

设计意图:承载“知识”和“情感”双重教学目标。
[生]钾、钠、镁、铝的金属性是越来越弱的。
[师]那么与此相对的非金属如何呢?以卤素中氯、溴、碘为例!大家先预测一下,我通过滤纸上微型实验:探究氯、溴、碘单质的活动性强弱。
演示实验:在一张洁净的滤纸中央先滴2滴新制氯水(代替氯气),氯水的淡黄绿色不明显,现在继续滴入2滴NaBr,发现试纸颜色加深呈黄色。再取一张新的滤纸,在中央滴入2滴KI,然后将刚才两片滤纸重叠,不久发现滤纸颜色又加深变成褐色。
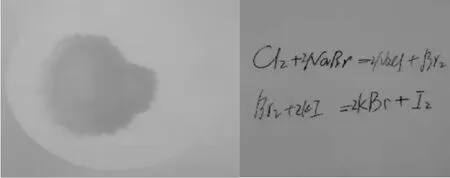
实物投影仪上展示滤纸实验白板上学生书写方程式
[生]书写相应的离子方程式。从而证实了氯、溴、碘的活动性依次减弱。
[师]为什么元素的金属性和非金属性会呈现如此的变化规律呢?下面我们从原子核外电子排布、元素主要化合价等角度,借助于数学手段——作图找规律:
[生](1)画出短周期元素原子序数与最外层电子数的直方图。
作图提示:直方图是一种统计报告图,由一系列高度不等的纵向条纹或线段表示数据分布的情况。一般用横轴表示数据类型(如此处即为原子序数),纵轴表示分布情况。
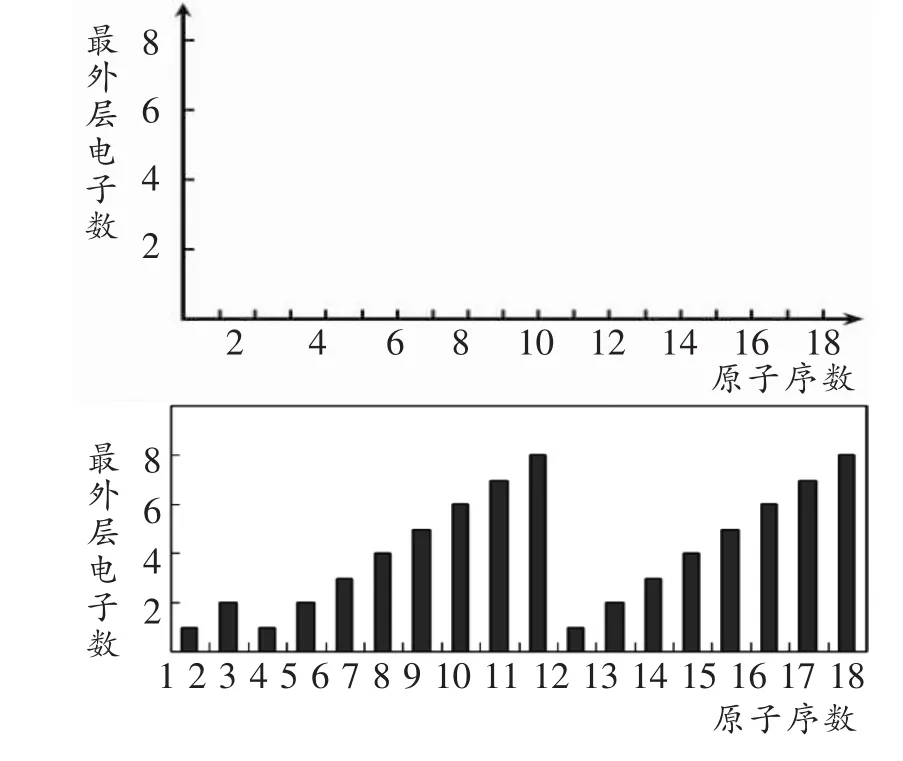
(2)画出短周期元素原子序数与最高正价、最低负价关系图。
设计意图:与前面的实验同样重要,理性分析也是科学最基本的方法。通过数据深加工,培养学生理性思维能力,让“规律”不再朦胧,让“周期”不再抽象,直观正如“年年岁岁花相似”、“年年年尾接年头”。
[师](3)观察短周期元素原子序数(最外层电子数)和原子半径(注:固态2个邻近原子核间距离的一半)折线图。
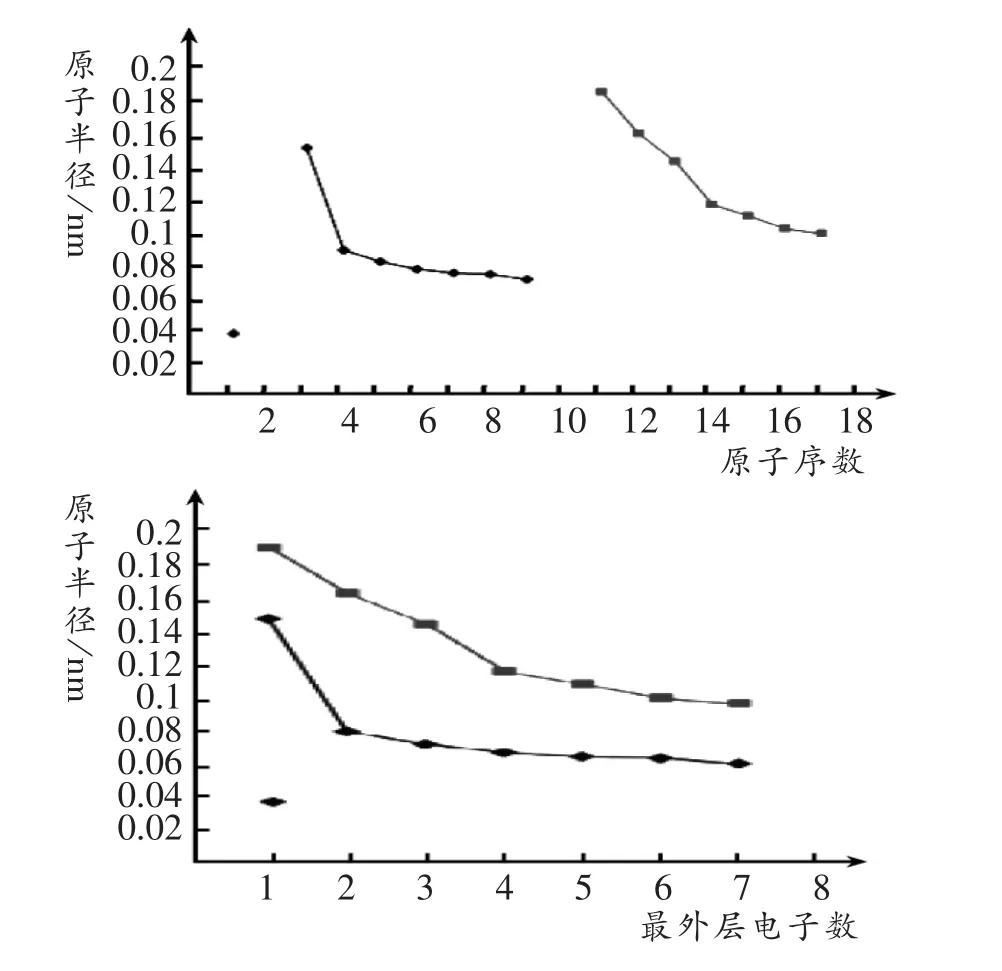
设计意图:左图从横行即周期的角度看元素原子半径的变化规律,将横坐标由原子序数改为原子最外层电子数即得右图(而苏教版必修2中则直接要求作出此图[3]),还能从纵的方向即族的角度看元素原子半径的变化规律。
[师]综上所述,元素的性质(主要化合价、原子半径)随原子序数的递增呈现周期性变化,这就是元素周期律。周期律是元素原子核外电子排布随着核电荷数的递增发生呈周期性变化的必然结果。
[生]讨论周期表的编排原则,厘清元素“位”、“构”、“性”间的关系:
位置:原子序数、周期序数、主族序数等;
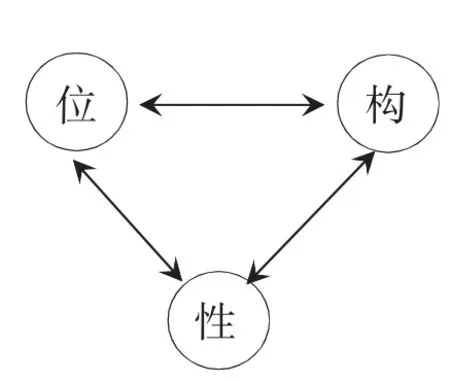
结构:核电荷数、质子数、核外电子数、最外层电子数、电子层数等;
性质:主族元素最高正化合价、最低负化合价等
将其中相关化学数据的相互关系表示出来:
如:原子序数=核电荷数_。
设计意图:洞察规律,进一步挖掘元素周期表中的显性、隐性的关系,加深对“周期表是周期律的具体体现,周期律是周期表的实质”的理解。
4.初步体验元素周期表·周期律的运用
[师]周期表的发展经历了漫长的一个世纪,其
中起决定性作用的是1869年门捷列夫所编的第一张元素周期表。(并阅读信件:1875年,门捷列夫建议法国化学家布瓦博德朗对其所发现的新元素——镓的密度重新测定……)
设计意图:再次领略元素周期表的神奇(预见性),激发学生学习化学的兴趣,激励学生投身科研。承载“人文科学”的教学目标,诠释“吾爱吾师,吾更爱真理”,追求教育教学功能的立体、丰富和厚重。
[生]从教材感受周期表对化学科学工作者的巨大作用。
[师]本节课从“借我一双慧眼”开始,发现游戏中的6种元素及其形成物质之间是普遍联系的,就让我们一直带着这双慧眼,不断深入领悟和感受周期表所蕴含的化学思想及辩证观:性构相依、量变到质变、对立与统一……今天,我们站在巨人的肩膀上,所以看得更远、更透,元素周期表的学习也必将使我们学习化学进入到一个崭新的平台。
设计意图:配合白板以“脚印”的形式依次显示本节课学习探究历程,其延伸之意——“路漫漫其修远兮”也。
四、主板书设计

五、教学评价设计及实施

学习小组活动记载表2014.11.2
六、教学反思
如何架设“感性”和“理性”之间的桥梁?一直是教者在这堂课教学过程中所纠结的。席勒认为,通过体验可以在感性与理性之间架设起一座桥梁,课的一开始就让学生在游戏中体验6种元素及其形成物质之间是普遍联系的,从展示的各小组卡片来看,起到了预期的效果。
基于感性认识上升到理性认识的条件,首先,组织“感性材料”,如结合操作简便、现象明显的分组和演示实验;整合教材,虽然学生仅有一本教材(人教版),但本节课在教学过程中借鉴了苏教版和鲁科版[4],在不增加学生负担的前提下,教者合理整合与开发现有教材。其次运用科学的思维方法,如抽象的元素周期律通过“柱形图”、“折线图”等二次转化,最大限度发挥学生的主观能动性,加深学生对教材的理解,从而完成感性认识到理性认识的上升,从实际教学反馈看,学生课堂反映良好。
但根据本节课后该班科任老师张老师反馈,部分学生将“元素”性质与“物质”性质等同,对“金属活动性”、“金属性”、“金属活动顺序”等概念混淆……反思自身的教学,未将学生知识背景尚不足以深入的细节通过适度的“解释”,开个窗口,以给学生今后的学习留有发展空间,以更好的体现“以人为本”的教学要求,未能放手让学生从获得的感性认识自觉上升到深入原子微观结构的角度去考虑原子核与电子的相互影响上来思考的理性分析的高度,进而对元素的金属性和非金属性的周期性变化规律作出解释,在教学过程中仍有“牵引”学生的痕迹。
[致谢:感谢江苏省如东高级中学的老师在整个活动过程中给予的大力帮助。]
参考文献
[1]宋心琦.普通高中课程标准实验教科书.化学2[M].北京:人民教育出版社,2008
[2]王祖浩.普通高中课程标准实验教科书.化学(化学2)[M].南京:江苏教育出版社,2007
[3]http://news.xinhuanet.com/world/2011-09/23/c_122075979.htm
[4]王磊.普通高中课程标准实验教科书.化学(化学2)[M].济南:山东科学技术出版社,2013
