α-酮戊二酸对杂交鲟肠道形态、消化酶活力和抗氧化能力的影响
2015-02-17陈迪王连生徐奇友
陈迪,王连生,徐奇友
(1.上海海洋大学水产与生命学院,上海201306;2.中国水产科学研究院黑龙江水产研究所,黑龙江哈尔滨150070)
谷氨酰胺 (Glutamine,Gln)是血液循环和组织内游离氨基酸池中含量最丰富的一种氨基酸[1],对机体具有多方面的影响。随着人们对Gln研究的逐步深入,发现其在肠道营养与免疫等方面作用突出。许多研究表明,Gln是条件性必需氨基酸,也是胃肠道管腔细胞的基本能量来源,并在维持早期断奶仔猪肠道结构和功能方面起重要作用,如促进肠黏膜组织在应激损伤后的修复,为肠道提供转运能源,为核酸的生物合成提供胺氮等[1]。在生产实践中,Gln因单体稳定性差、溶解度低、价格昂贵等缺点限制了其在动物生产中的应用。近年来,α-酮戊二酸 (α-ketoglutarate,AKG)作为Gln的前体物质,其良好的稳定性及在体内能迅速为肠道供能等特性引起了研究者的广泛关注,国内外对一些医学和动物科学的研究表明,AKG在肠道营养与免疫作用中具有可替代Gln的功效。AKG是生物体三羧酸循环重要的中间体,也是谷氨酸家族氨基酸如L-谷氨酸、L-谷氨酰胺、L-脯氨酸、L-精氨酸等的生物合成前体[2]。目前,已有学者对AKG在仔猪、肉仔鸡和大鼠的生长、肠道发育和抗氧化能力等方面做了相关研究[3-7],位莹莹等[8]研究了AKG对松浦镜鲤生长及血清生化指标等的影响,结果发现,在饲料中添加适量的AKG可以在一定程度上降低饲料系数,提高鱼体的增重率和蛋白质效率,并最终起到促进蛋白质和脂肪代谢的作用。而有关AKG对水产动物影响的研究仍然不够全面,有待于进一步深入探讨。
西伯利亚鲟Acipenser schrenckii♀和史氏鲟Acipenser baeri♂的杂交鲟是目前生产上饲养的主要品种,其生长速度较快,5个月内可长到0.5 kg左右,本试验中以其为研究对象,研究了不同蛋白源条件下添加AKG的饲料对杂交鲟肠道形态、消化酶活力和抗氧化能力的影响,以期为AKG在生产实践中的应用提供理论依据。
1 材料与方法
1.1 材料
试验用杂交鲟购自北京房山鲟鱼养殖基地。AKG(纯度≥98.5%)购自Sigma-Aldrich公司。
1.2 方法
1.2.1 饲料的配制 根据鲟鱼幼鱼营养需要配制基础饲料。试验采用进口蒸汽鱼粉为动物蛋白源,以大豆浓缩蛋白为植物蛋白源,以混合油 (大豆磷脂、鱼油、豆油)为脂肪源,试验饲料理论蛋白质水平为39%,分为大豆浓缩蛋白源组以及鱼粉与大豆浓缩蛋白的复合蛋白源组,每组设两个AKG水平 (0和1%),配制4种试验饲料,试验饲料的组成和营养成分见表1。将各种饲料原料粉碎过80目筛,逐级混合均匀,再加入一定量的水充分混合并用小型颗粒机挤压成颗粒饲料,常温下风干后,储存于冰箱 (-20℃)中。
1.2.2 试验分组及饲养管理 将试验鱼用食盐水(浓度为30 g/L)消毒后养殖于车间的可控温循环水系统中,驯养 2周后,将体质量为 (7.65±0.04)g的健康杂交鲟500尾随机分为4组,每组设5个平行,每个平行放25尾鱼。试验用水为曝气的自来水,水温保持在22℃左右,溶氧大于5 mg/L,自然光照。试验期间饱食投喂,每天8:00、13:00、17:00投饵,及时吸取残饵和粪便,定期检测水质,每7天换水1次,确保水质良好。养殖周期为8周。
1.2.3 样品的采集与处理 试验结束后,将试验鱼饥饿24 h,使其完全排空肠胃中的食物,然后进行样品采集。从每组随机取10尾鱼,并用浓度为100 mg/L的MS-222麻醉,置于冰盘上解剖,取出肠道,称重并测量肠道长度,剔除肠道上的附属物,用滤纸吸去肠道表面水分,再称重后加入9倍质量的8.6 g/L的生理盐水匀浆,以4000 r/min离心20 min,取上清液,分装后于冰箱 (-20℃)中保存备用。
1.2.4 肠道Gln含量和谷氨酰胺合成酶 (GS)活性的测定 采用南京建成生物工程研究所试剂盒测定Gln含量和GS活性。Gln含量的测定原理为Gln在GS的作用下反应生成谷氨酸和氨,通过测定氨的含量来计算Gln的量。
GS酶活力单位定义为:在37℃下,每小时反应生成1 μmol γ-谷氨酰氧肟酸的量为1个酶活力单位 (U)。
1.2.5 肠道形态指标的测定 从每组随机取10尾鱼,麻醉后分离前肠、中肠和后肠,取肠道中段1 cm左右的肠段放入Bouin氏液中,逐级脱水、二甲苯透明、浸蜡、包埋、修块、切片、H.E染色、脱水、透明、中性树胶封片,用Motic显微图像系统 (Motic Images Plus 2.0软件)测量肠道绒毛高度、隐窝深度和皱襞厚度。
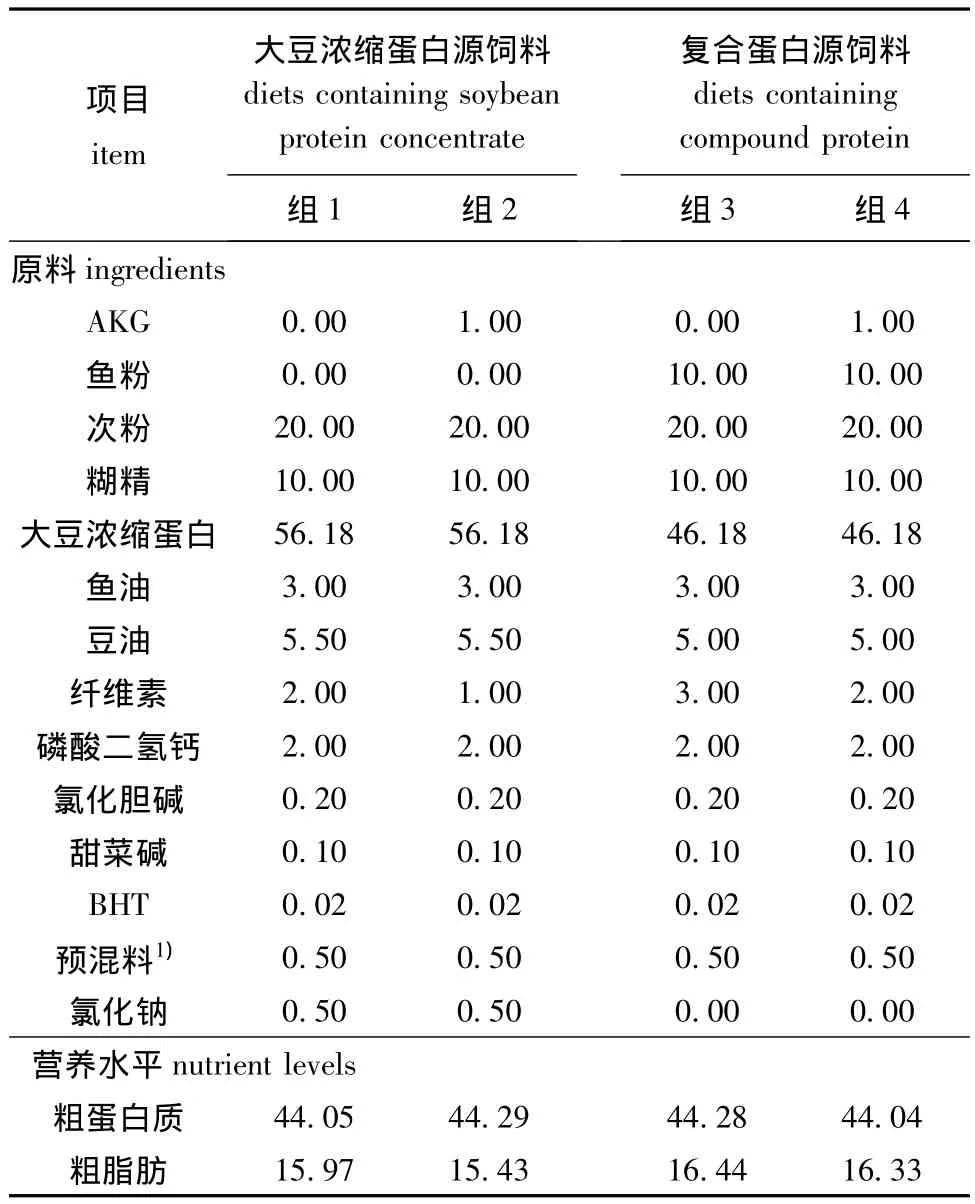
表1 试验饲料组成及营养水平 (风干基础)Tab.1 Ingredients and approximate composition of the experimental diets(air-dry basis) w/%
1.2.6 肠道消化酶活力的测定 采用福林-酚(Folin-phenol)法测定蛋白酶活力。福林-酚试剂在碱性溶液中极不稳定,易被酚类化合物还原为蓝色化合物,本试验中使用0.5%的酪素作为底物与酶液反应,生成含酚基的氨基酸与福林-酚试剂成蓝色反应,可从蓝色的深浅测知酶活力的多少,在680 nm波长下比色,测定光密度。蛋白酶活力单位定义为:在37℃下,每分钟水解酪素产生1 μg酪氨酸为一个酶活力单位 (U)。
采用南京建成生物工程研究所的试剂盒测定脂肪酶活力,具体方法参见试剂盒说明书。脂肪酶活力单位定义为:在37℃下,每克组织蛋白在本反应体系中与底物反应1 min,每消耗1 μmol底物为一个酶活力单位 (U)。
采用淀粉-碘比色法测定淀粉酶活力,以0.04%可溶性淀粉为底物,与酶液进行反应,反应后加入的碘液与未被水解的淀粉结合成蓝色复合物,将蓝色的深浅与未经酶促反应的空白管比较,测定其吸光度,从而推算出淀粉酶活力的大小。淀粉酶活力单位定义为:在37℃下,30 min内100 mL酶液中的淀粉酶能完全水解淀粉10 mg为一个淀粉酶活力单位 (U)。
1.2.7 肠道抗氧化指标的测定 采用南京建成生物工程研究所的试剂盒测定肠道超氧化物歧化酶(SOD)、过氧化氢酶 (CAT)活力和微量还原型谷胱甘肽 (GSH)、丙二醛 (MDA)含量。
1.3 数据处理
试验数据均以平均值±标准差表示。以不同蛋白源和AKG浓度为影响因素,采用SPASS 17.0软件进行双因素方差分析,并用Duncan法进行多重比较,显著性水平设为0.05。
2 结果与分析
2.1 各组杂交鲟肠道Gln含量和GS活性的变化
从表2可见:AKG能显著提高肠道Gln含量和GS活性 (P<0.05);不同蛋白源对肠道Gln含量和GS活性均无显著影响 (P>0.05);蛋白源和AKG对肠道Gln含量和GS活性无交互作用 (P>0.05)。
2.2 各组杂交鲟肠道形态的变化
从表3可见:AKG能显著提高后肠绒毛高度(P<0.05);不同蛋白源对肠道形态均无显著影响(P>0.05);蛋白源和AKG对肠道形态无交互作用(P>0.05)。
2.3 各组杂交鲟肠道消化酶活力的变化
从表4可见:AKG能显著提高蛋白酶活性(P<0.05),对脂肪酶和淀粉酶无显著性影响 (P>0.05);大豆浓缩蛋白源可显著提高蛋白酶活性(P<0.05),复合蛋白源可显著提高肠道淀粉酶活性 (P<0.05);蛋白源与AKG对脂肪酶和淀粉酶活力有交互作用 (P<0.05)。
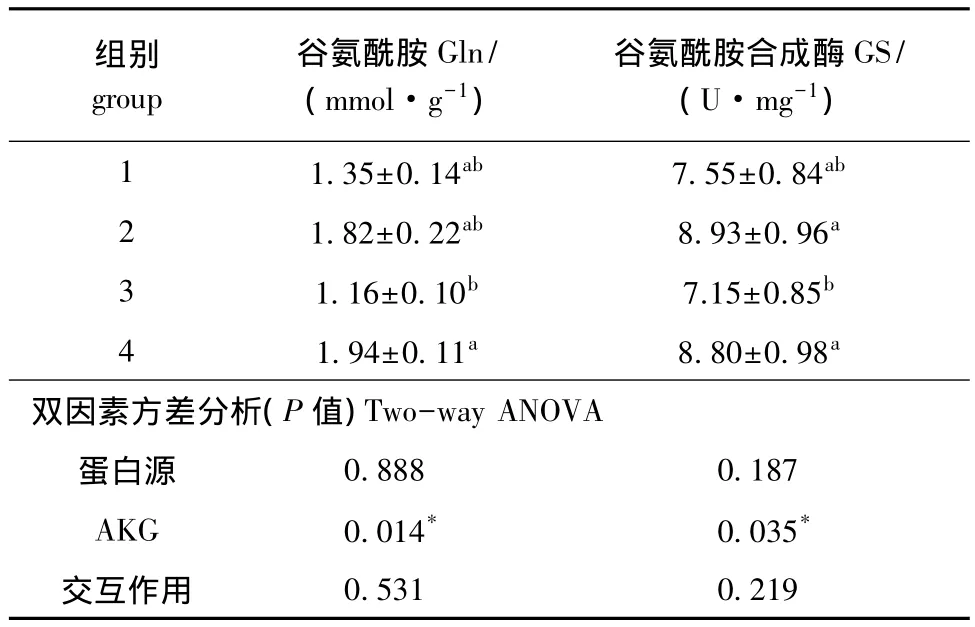
表2 AKG对杂交鲟肠道Gln含量和GS活性的影响 (n=10)Tab.2 Effects of AKG on glutamin(Gln)content and glutamine synthetase(GS)activity in intestine of hybrid sturgeon(n=10)
2.4 各组杂交鲟肠道抗氧化能力的变化
从表5可见:AKG能显著提高肠道中SOD活性 (P<0.05),并显著降低MDA含量 (P<0.05),对CAT活性和GSH含量无显著影响 (P>0.05);不同蛋白源对肠道抗氧化能力均无显著影响 (P>0.05);蛋白源与AKG对MDA含量有交互作用(P<0.05),对其他抗氧化指标均无交互作用 (P>0.05)。
3 讨论
3.1 AKG对杂交鲟肠道Gln含量和GS活性的影响
AKG不仅是生物体三羧酸循环的重要中间产物,也是谷氨酸家族氨基酸的生物合成前体。AKG进入鱼体后在一系列酶的催化作用下可以迅速生成谷氨酸,并进一步形成Gln。研究表明,饲料中添加Gln可改善水生动物的生长性能、肠道发育和免疫力[9-11]。本试验中,AKG显著提高了杂交鲟肠道Gln的含量,其机理可能是AKG进入鱼体后经一系列反应生成了Gln。肠道是Gln最主要的消耗器官[12],所以肠道的Gln含量显著增加,而酶活性随着底物浓度的增加而增强,Gln含量增加进而使得GS活性也相应增强。本研究表明,添加AKG可以增加肠道Gln含量。
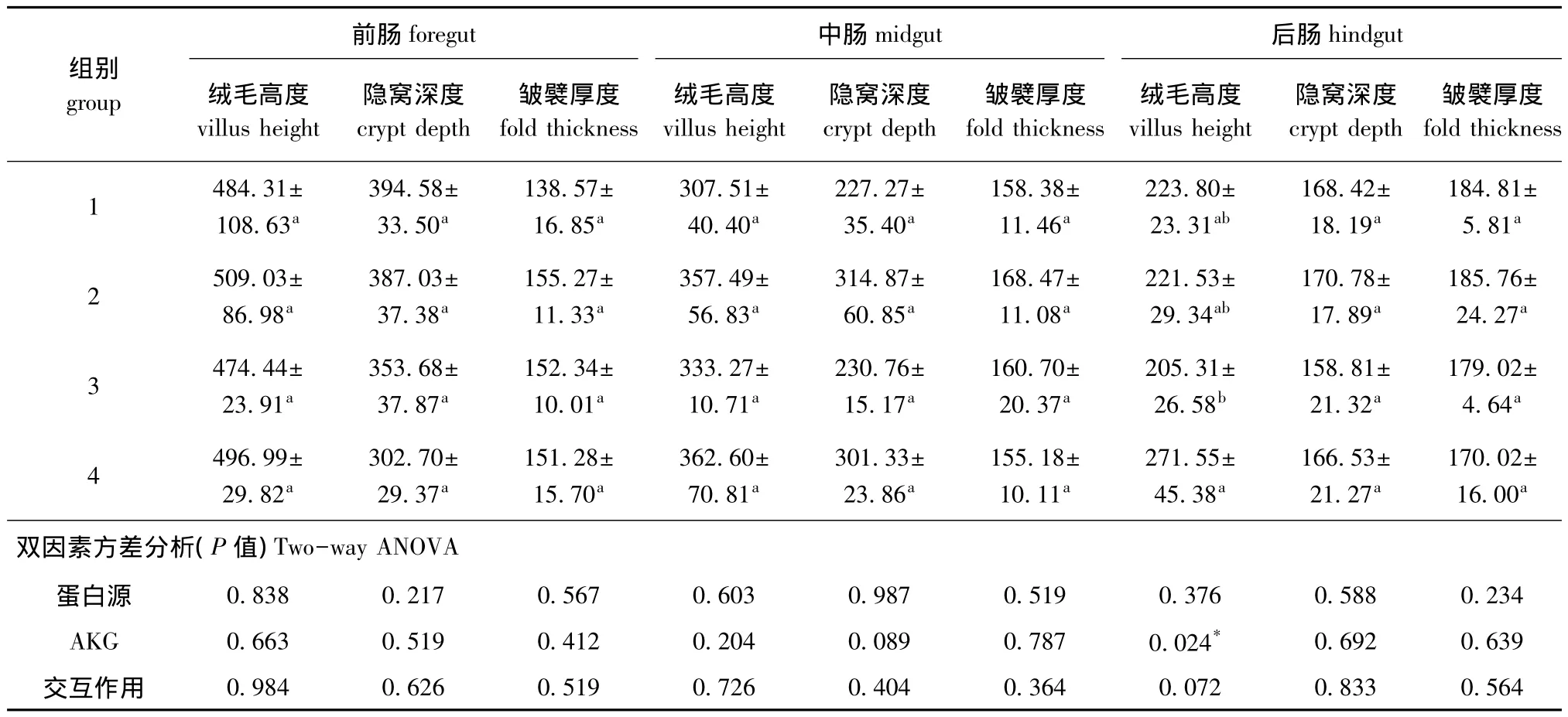
表3 AKG对杂交鲟肠道形态的影响 (40×10倍光镜)(n=10)Tab.3 Effects of AKG on intestinal morphology of hybrid sturgeon(40×10)(n=10) μm
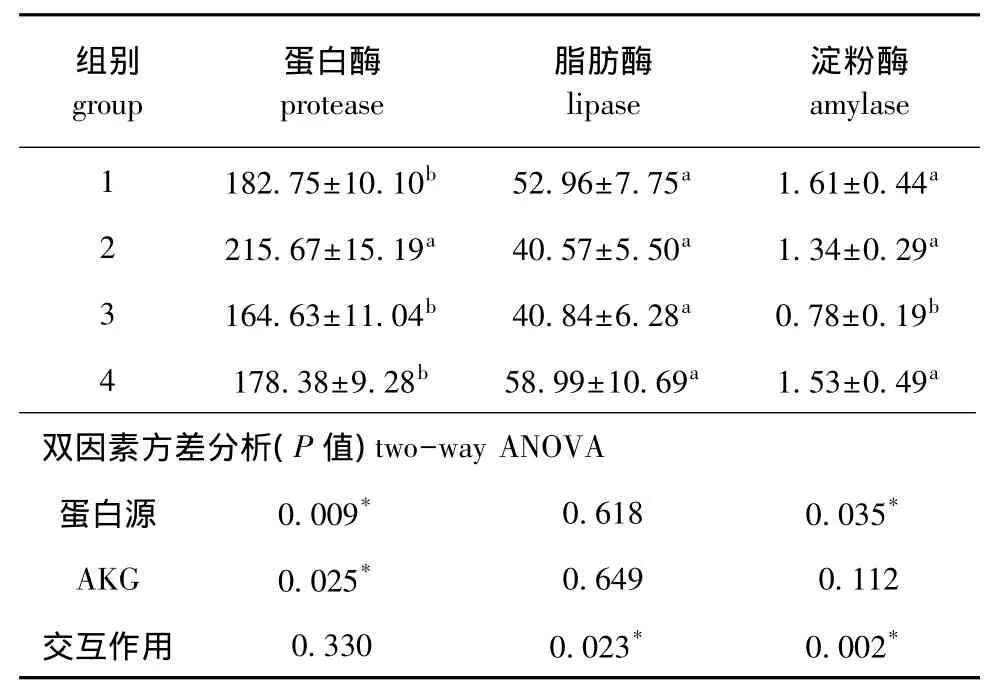
表4 AKG对杂交鲟肠道消化酶活力的影响 (n=10)Tab.4 Effects of AKG on intestinal digestive enzyme activity in hybrid sturgeon(n=10) U/g
3.2 AKG对杂交鲟肠道形态的影响
小肠是碳水化合物、脂肪和蛋白质等主要营养物质消化吸收的重要器官[13],其内黏膜结构与功能的完整性是养分消化吸收、动物正常生长与生产的基本保证,若肠黏膜发育不良或受损,将严重影响动物的生长、发育和免疫功能等,最终也会使经济效益受损。小肠的绒毛高度、隐窝深度和黏膜厚度等是衡量小肠消化吸收功能的重要指标。肠绒毛是小肠黏膜表面上皮和固有层向肠腔内的细小突起,是动物机体对营养物质吸收和转运的最主要部位,在十二指肠和空肠中分布最为密集。绒毛高度和黏膜厚度增加,小肠与营养物质的相对接触面积就会变大,对营养物质的吸收就会更有利。研究表明,外源性的Gln可以提高鲤肠道绒毛高度,促进肠道发育[14]。本试验条件下,AKG能显著提高后肠绒毛高度,其作用机理可能是,AKG进入杂交鲟体内经反应生成Gln,Gln可使肠黏膜功能性表面积增大,进而使得肠道对营养物质的吸收增大。本研究表明,添加AKG可以在一定程度上促进肠道发育。
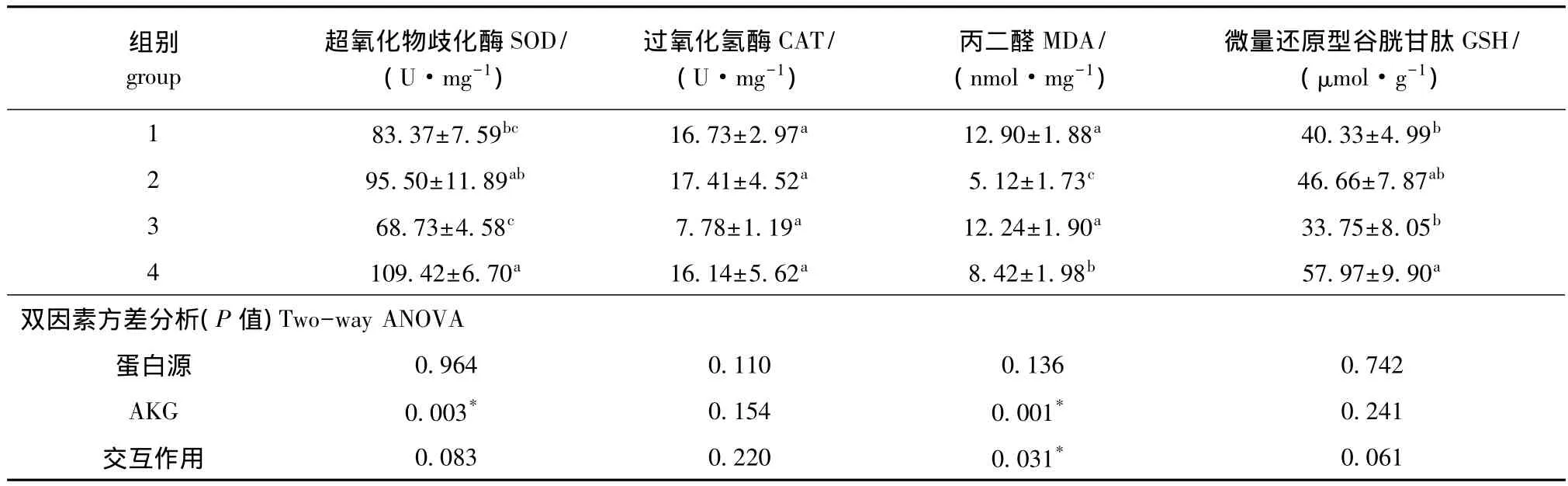
表5 AKG对杂交鲟肠道抗氧化能力的影响 (n=10)Tab.5 Effects of AKG on intestinal antioxidant capacity in hybrid sturgeon(n=10)
3.3 AKG对杂交鲟肠道消化酶活力的影响
鱼类的消化酶活性决定鱼类对营养物质的消化吸收能力,进而决定鱼类的生长发育速度。鱼体内的消化酶主要分为蛋白酶、脂肪酶和淀粉酶,对于不同食性和生活习惯的鱼,其体内3种酶的活力是不同的,且消化酶的变化可能跟饲料中的添加物有关[15]。肠在鱼类消化过程中起着重要的作用,是主要的消化器官。因此,了解鱼类肠道消化酶的分泌、贮存机制,以及其如何消化吸收营养成分是非常必要的。本试验中,AKG能显著增加蛋白酶活性,其机理可能是,AKG进入鱼体后,经一系列反应生成Gln,Gln可以促进肠道对营养物质的消化吸收。林燕[14]研究表明,饲料中添加适宜的Gln可促进幼建鲤肠细胞蛋白质的合成,从而影响肠道的生长发育。此外,AKG还可以有效促进氮的代谢,减轻动物生产中的代谢应激,保护氨基酸作为能量被肠道利用,并起到节约氨基酸的作用。由此可知,AKG在促进机体及组织蛋白质的合成中起到了重要作用。本研究表明,添加AKG可促进杂交鲟肠道消化吸收,提高肠道蛋白质含量,进而增强其蛋白酶活性。
3.4 AKG对杂交鲟肠道抗氧化能力的影响
酶和非酶系统构成了水产动物的主要抗氧化防御系统,两者协作可以有效清除机体内的活性氧等自由基及其代谢产物,测定抗氧化酶系的活性常用于评估体内自由基反应的动态变化及组织损伤情况[16]。抗氧化酶系主要包括SOD、GSH-PX、CAT等,非酶系统主要包括 GSH、VE、VC 等[17]。SOD作用于超氧自由基,使鱼体内的超氧自由基转化为过氧化氢,从而清除机体内的自由基,保护机体免受损伤。MDA作为脂质过氧化的终产物之一,是生物体内自由基的指示物,并广泛作为各种氧自由基损伤机体的指标。动物组织里的MDA能使核酸、蛋白质和脑磷脂发生交联而丧失活性。因此,测定MDA含量可以反映机体脂质氧化的程度,从而间接反映机体细胞组织受损伤和肌肉品质变化的严重程度。鱼类组织中含有大量多不饱和脂肪酸以维持细胞膜的必须功能[18],因此,鱼类极易受到自由基攻击,导致机体氧化损伤[19]。由于水生动物肠道与外界水环境相通,肠道抗氧化能力在一定程度上反映了肠黏膜防御屏障的发育程度。本试验条件下,AKG能显著提高肠道中SOD活性,降低MDA含量,表明AKG有效改善了肠道的抗氧化能力,这与胡泉州等[20]对断奶仔猪血浆的研究结果一致。其机理可能是,AKG进入鱼体后经反应生成Gln,Gln可以作为能源物质氧化,清除细胞内的一些强氧化性物质,保护细胞内一些重要组分免受氧化性损害[21],最终达到提高机体抗氧化能力的目的。本研究表明,添加AKG可以提高肠道的抗氧化能力。
[1]Rhoads M J,Wu G.Glutamine,arginine,and leucine signaling in the intestine[J].Amino Acids,2009,37(1):111-122.
[2]Wu G,Meier S A,Knabe D A.Dietary glutamine supplementation prevents jejuna atrophy in weaned pigs[J].The Journal of Nutrition,1996,126:2578-2584.
[3]余亲平,陈雁群,谢金蝉,等.日粮添加α-酮戊二酸对肉仔鸡生长性能及组织器官发育的影响[J].中国畜牧兽医,2010,37(10):10-14.
[4]Buddington R K,Pajor A,Buddington K K,et al.Absorption of αketoglutarate by the gastrointestinal tract of pigs[J].Comparative Biochemistry and Physiology,Part A:Molecular& Integrative Physiology,2004,138(2):215-220.
[5]Hou Yongqing,Wang Lei,Ding Binying,et al.Dietary α-ketoglutarate supplementation ameliorates intestinal injury in lipopolysaccharide-challenged piglets[J].Amino Acids,2010,39:555-564.
[6]Segaud F,Combaret L,Neveux N.Effects of ornithine α-ketoglutarate on protein metabolism in Yoshida sarcoma-bearing rats[J].Clinical Nutrition,2007,26:624-630.
[7]罗金升,项方献,张磊,等.中草药结合α-酮戊二酸促进仔猪生长发育的研究[C]//中国畜牧兽医学会动物解剖学及组织胚胎学分会第十六次学术研讨会论文集.北京:中国农业科学技术出版社,2010:421-427.
[8]位莹莹,徐奇友,李晋南,等.不同蛋白质水平饲料中添加α-酮戊二酸对松浦镜鲤生长性能、体成分和血清生化指标的影响[J].动物营养学报,2013,25(12):2958-2965.
[9]叶元土,王永玲,蔡春芳,等.谷氨酰胺对草鱼肠道L-亮氨酸、L-脯氨酸吸收及肠道蛋白质合成的影响[J].动物营养学报,2007,19(1):28-32.
[10]徐奇友,王常安,许红,等.丙氨酰Ala-Gln对哲罗鱼仔鱼生长和抗氧化能力的影响[J].动物营养学报,2009(6):1012-1017.
[11]徐奇友,王常安,许红,等.外源性谷氨酰胺对虹鳟稚鱼生长和肠道形态的影响[J].中国粮油学报,2009,24(4):98-102.
[12]姜俊,周小秋.Gln对鲤鱼肠上皮细胞增殖和分化的影响[C]//第五届全国饲料营养学术研讨会.北京:中国农业科学技术出版社,2006:167.
[13]胡泉舟,侯永清,丁斌鹰,等.α-酮戊二酸对仔猪小肠组织学形态与功能的影响[J].动物营养学报,2008,20(6):662-667.
[14]林燕.谷氨酰胺对幼建鲤肠道功能和免疫力的影响[D].雅安:四川农业大学,2005.
[15]Hidalgo M C,Urea E,Sanz A.Comparative study of digestive enzymes in fish with different nutritional habits:proteolytic and amylase activities[J].Aquaculture,1999,170(3):267-283.
[16]许治冲,刘晖,徐奇友,等.温度和饲料脂肪水平对松浦镜鲤免疫及抗氧化能力的影响[J].大连海洋大学学报,2012,27(5):429-435.
[17]周婷婷,曹俊明,赵红霞,等.谷胱甘肽在水产动物中的营养生理作用研究进展[J].水产科学,2012,31(10):630-634.
[18]Martlnez-Alvarez R M,Morales A E,Sanz A.Antioxidant defenses in fish:biotic and abiotic factors[J].Fish Biology and Fisheries,2005,15(1/2):75-88.
[19]Oruc E O,Usta D.Evaluation of oxidative stress responses and neurotoxicity potential of diazinon in different tissues of Cyprinus carpio[J].Environmental Toxicology and Pharmacology,2007,23(1):48-55.
[20]胡泉舟,侯永清,丁斌鹰,等.α-酮戊二酸对断奶仔猪生长性能和肠道功能的影响[C]//中国畜牧兽医学会动物营养学分会第十次学术研讨会论文集.北京:中国农业科学技术出版社,2008:362.
[21]王学斌,刘凤莲,李东风,等.体内游离谷氨酰胺的抗氧化作用[J].生物物理学报,2005,20(6):429-433.
