两种微藻胞外分泌物与Fe(Ⅲ)、Cu(Ⅱ)对苯酚光解的影响
2015-02-17孔淮王华刘萱于春艳葛林科
孔淮,王华,刘萱,于春艳,葛林科
(1.大连海洋大学水产与生命学院辽宁省贝类良种繁育工程技术研究中心,辽宁大连116023;2.国家海洋环境监测中心,辽宁大连116023)
光解是水环境中有毒有机污染物降解的主要途径之一,天然水中的溶存物质可能会影响有毒有机污染物的光解。腐殖酸分子中含有多种含氧功能基团,是天然水环境中广泛分布的一类有机化合物,其存在会影响有机污染物的光解历程[1]。腐殖酸对水中双酚A的光解有促进作用[2],对阿特拉津和2,4-D的光解有一定的抑制作用[3-4],但对噻苯咪唑的光解却无明显影响[5]。
微藻是水生生态系统的重要组成部分,微藻的生物量可影响水体的初级生产力[6]。微藻在生长过程中会产生一定量的代谢产物,这些代谢产物一般被称为胞外分泌物 (Extracellular organic matter,EOM)[7]。EOM的主要成分是蛋白质、多糖和腐殖酸等,但不同种类的微藻产生的 EOM不同[8-9]。研究表明,部分微藻的EOM会对水中其他水生生物产生影响。赤潮异弯藻 Heterosigma akashiwo EOM中含有糖类物质,能抑制其他硅藻生长,而对其本身的生长则有促进作用[10-11];铜绿微囊藻Microcystis aeruginosa EOM释放的物质可抑制某些蓝绿藻生长[12];小定鞭金藻 Prymnesium parvum EOM能产生溶血性鱼毒素[13]。腐殖酸是微藻EOM中的一种主要组成成分,这意味着微藻EOM可能会具有与腐殖酸相似的环境化学行为,会对水环境中有机污染物的光解过程产生影响[14],但目前对这方面的研究较少。此外,天然水环境中的Fe(Ⅲ)和Cu(Ⅱ)均具有一定的光化学活性[15-16],在太阳光照射下,两者均可引发有机污染物的光化学反应,进而对其最终的环境归宿产生影响[17-18]。
苯酚是水环境中一种常见的有机污染物,其存在会威胁水域生态和水生生物的安全[19]。光解作用是水环境中苯酚非生物转化的重要途径之一[20]。本试验中,研究了扁藻Tetraselmis chui和新月菱形藻Nitzschia closterium EOM及其与Fe(Ⅲ)、Cu(Ⅱ)共存时对苯酚光解的影响,旨在为研究微藻EOM的水环境光化学行为以及评价有机污染物对环境的影响提供参考。
1 材料与方法
1.1 材料
扁藻和新月菱形藻取自大连金瑞水产养殖公司藻种室,经培养达到指数生长期后使用。试验用海水取自大连市黑石礁近岸,盐度为29,经0.45 μm滤膜 (天津津腾实验设备有限公司)过滤,加热煮沸后冷却待用。
苯酚 (天津市致远化学试剂有限公司)、三氯化铁 (天津市恒兴化学试剂制造有限公司)和硫酸铜 (天津科密欧化学试剂有限公司)均为分析纯,色谱纯甲醇和乙腈购自于美国Tedia公司。
1.2 方法
苯酚储备液 (1 g/L)用乙腈配制,4℃下避光保存,使用期限1个月。扁藻和新月菱形藻EOM通过离心 (3000 r/min)获得。将扁藻与新月菱形藻的EOM分别用不同量海水稀释,得到EOM试验用溶液,并用总有机碳分析仪 (日本岛津)测得的TOC值作为微藻EOM的浓度。
苯酚光解试验在自制的光化学反应装置中进行[22],光源为500 W 高压汞灯,光照强度为27 mW/cm2。采用PYREX试管作为苯酚光化学反应容器,该试管可阻挡290 nm以下波长的入射光。RYREX试管中苯酚的初始浓度设为5 mg/L,扁藻和新月菱形藻EOM以及Fe(Ⅲ)、Cu(Ⅱ)浓度按试验梯度设置,反应溶液体积为40 mL,同时设置空白对照和黑暗对照。试验时间为10 h,光化学反应期间定时取样。所有样品均先经过0.22 μm针孔滤膜过滤,样品中苯酚浓度使用高效液相色谱仪(美国Waters公司)测定,检测波长为230 nm,选择甲醇和高纯水 (二者的体积比为50∶50)作为色谱流动相,流动相流速为1.0 mL/min。
2 结果与分析
2.1 不同浓度扁藻及新月菱形藻EOM对苯酚光解的影响
图1为分别加入扁藻和新月菱形藻EOM后,溶液中苯酚浓度随时间的变化趋势。从图1可见:在黑暗条件下,溶液中苯酚的浓度基本未发生变化;在有光照的条件下,溶液中苯酚浓度下降明显,各反应组苯酚的光解过程可用准一级反应动力学方程ln(C/C0)=-k·t描述,其中反应溶液中苯酚的初始浓度用C0表示,t时刻溶液中苯酚的浓度用C表示,k为苯酚的光解速率常数。从试验结果可以看出,在波长大于290 nm的模拟太阳光照射下,海水中的苯酚光解速率常数为0.036 4 h-1。与对照组相比,随着反应溶液中扁藻与新月菱形藻EOM浓度的增加,海水中苯酚的光解速率常数减小。当反应溶液中扁藻EOM的初始浓度从1.585 mg/L增加到15.850 mg/L时,苯酚的光解速率常数由 0.033 8 h-1降至 0.012 8 h-1(图 1-A);当溶液中新月菱形藻EOM的初始浓度从1.416 mg/L增加至 14.160 mg/L时,苯酚光解速率常数由0.034 8 h-1降至 0.014 7 h-1(图 1-B)。

图1 不同浓度扁藻及新月菱形藻EOM对苯酚光解的影响Fig.1 Effects of different EOM concentrations of algae Tetraselmis chui and Nitzschia closterium on phenol photodegradation
2.2 扁藻、新月菱形藻EOM与Fe(Ⅲ)共存时对苯酚光解的影响
图2为一定浓度的扁藻和新月菱形藻EOM与不同浓度的Fe(Ⅲ)共存时对苯酚光解的影响,反应溶液中扁藻和新月菱形藻EOM的浓度分别设定为1.585、1.416 mg/L。从图 2-A 可见:在扁藻EOM溶液中,苯酚光解速率常数随着Fe(Ⅲ)浓度的增加而增大;当溶液中Fe(Ⅲ)为10 mg/L时,苯酚的光解速率常数为0.045 5 h-1,高于空白对照组 (0.036 4 h-1)和未加Fe(Ⅲ)的扁藻EOM组的光解速率常数 (0.033 8 h-1);当溶液中Fe(Ⅲ)浓度由20 mg/L增加至50 mg/L时,苯酚光解速率常数由 0.068 5 h-1增大至 0.125 3 h-1,比在未加Fe(Ⅲ)的扁藻EOM溶液中的光解速率常数提高近2.71倍。从图2-B可见:当新月菱形藻EOM溶液中Fe(Ⅲ)浓度为10 mg/L时,苯酚的光解速率常数为0.046 0 h-1,是苯酚在未加Fe(Ⅲ)的新月菱形藻EOM溶液中光解速率常数的1.32倍,高于空白对照组中苯酚的光解速率常数。综上分析可知,在扁藻和新月菱形藻EOM溶液中,Fe(Ⅲ)的存在可促进苯酚的光解。

图2 扁藻、新月菱形藻EOM与不同浓度Fe(Ⅲ)共存时对苯酚光解的影响Fig.2 Effects of coexistence of algae Tetraselmis chui,and Nitzschia closterium EOM with different concentrations of Fe(Ⅲ)on phenol photodegradation in seawater
2.3 扁藻、新月菱形藻EOM与Cu(Ⅱ)共存时对苯酚光解的影响
从图3可见:当溶液中扁藻和新月菱形藻EOM分别为 1.585、1.416 mg/L时,苯酚的光解速率常数随着溶液中Cu(Ⅱ)浓度的增加而增大;溶液中Cu(Ⅱ)浓度由0.5 mg/L增加至 10 mg/L时,扁藻EOM溶液中苯酚的光解速率常数由0.035 2 h-1增大至 0.039 3 h-1(图 3-A),新月菱形藻EOM溶液中苯酚的光解速率常数由0.036 0 h-1增大至0.043 3 h-1(图3-B)。
2.4 扁藻、新月菱形藻EOM与Fe(Ⅲ)和Cu(Ⅱ)共存时对苯酚光解的影响
本研究中考察了微藻EOM与Fe(Ⅲ)、Cu(Ⅱ)共存时对苯酚光解的影响。从图4-A可见,在扁藻EOM(1.585 mg/L)与Fe(Ⅲ)、Cu(Ⅱ)共存时对苯酚光解的影响中,随着Fe(Ⅲ)和Cu(Ⅱ)浓度的增加,苯酚光解速率常数由0.033 8 h-1增大至0.144 5 h-1,提高近3.28倍。由图4-B可见,在新 月 菱 形 藻 EOM(1.416 mg/L)与 Fe(Ⅲ)、Cu(Ⅱ)共存时对苯酚光解的影响中,随着Fe(Ⅲ)和Cu(Ⅱ)浓度的增加,苯酚的光解速率常数由0.034 8 h-1增大至 0.150 5 h-1,提高近 3.32 倍。
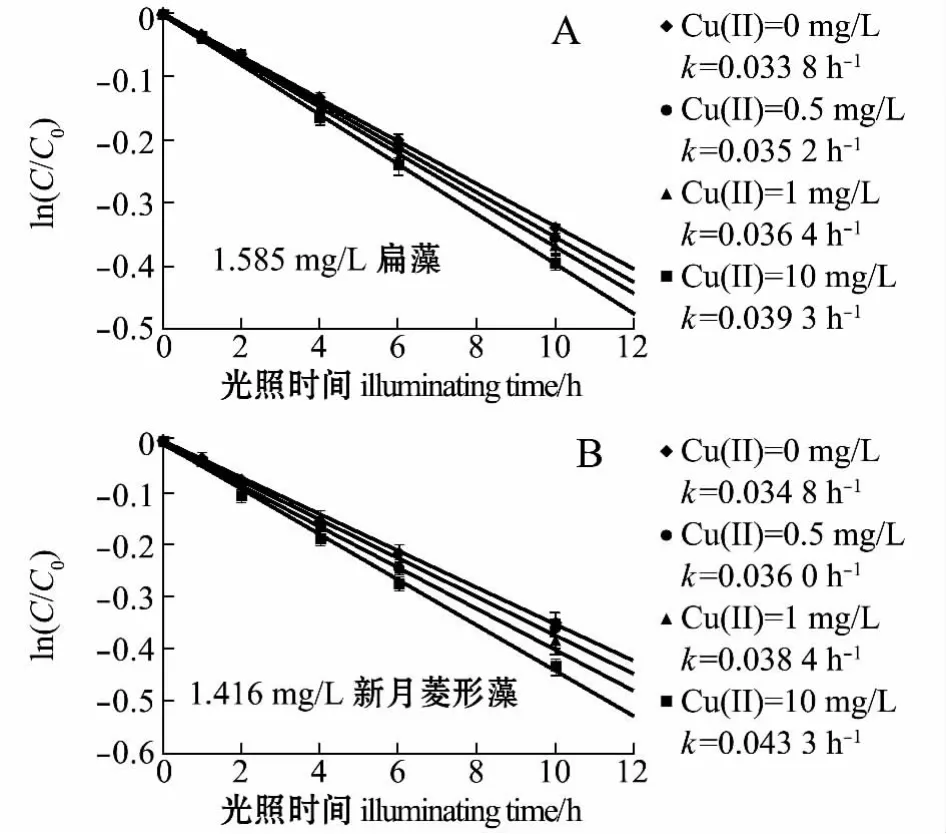
图3 扁藻、新月菱形藻EOM与不同浓度Cu(Ⅱ)共存时对苯酚光解的影响Fig.3 Effects of coexistence of algae Tetraselmis chui,and Nitzschia closterium EOM with different concentrations of Cu(Ⅱ)on phenol photodegradation in seawater
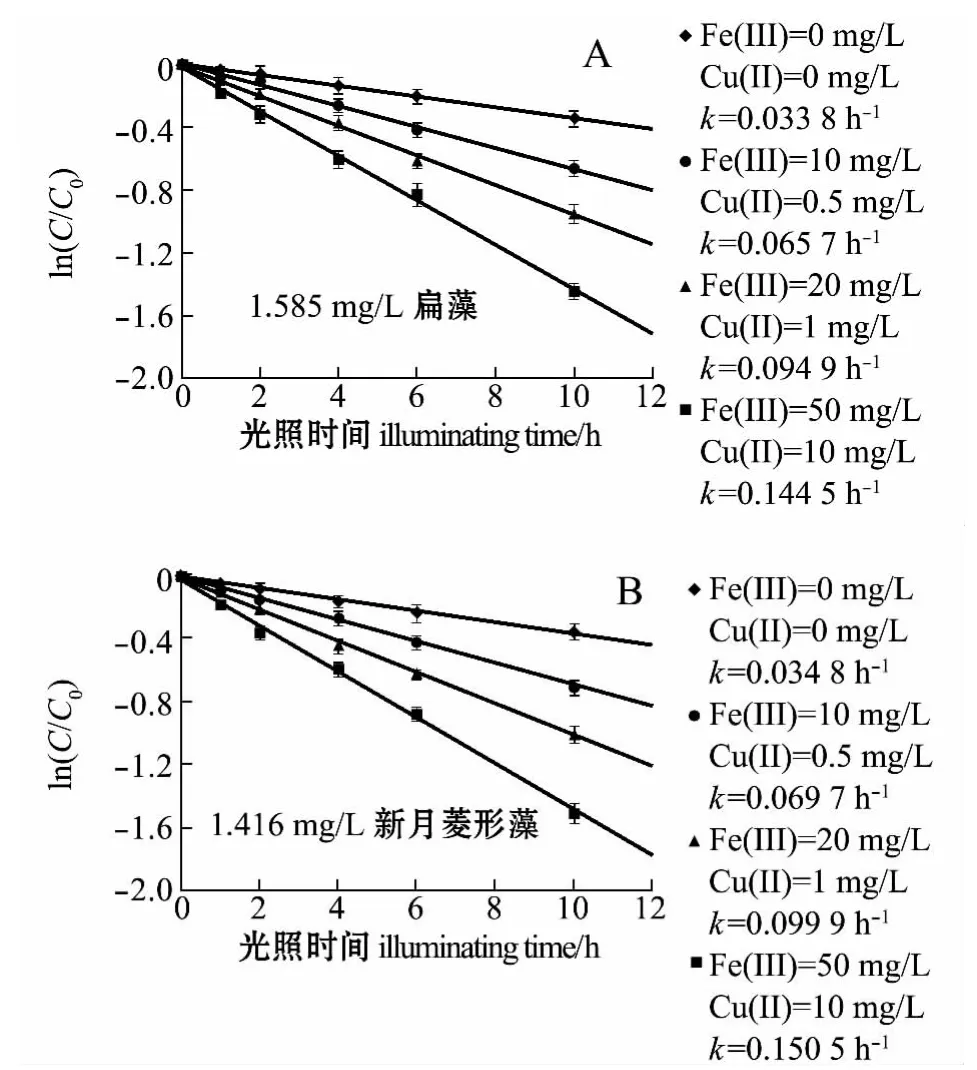
图4 扁藻、新月菱形藻EOM与不同浓度Fe(Ⅲ)和Cu(Ⅱ)共存时对苯酚光解的影响Fig.4 Effects of coexistence of algae Tetraselmis chui,and Nitzschia closterium EOM with different concentrations of Fe(Ⅲ),and Cu(Ⅱ)on phenol photodegradation in seawater
3 讨论
3.1 扁藻和新月菱形藻EOM对苯酚光解的影响
本试验结果表明,随着反应溶液中扁藻和新月菱形藻EOM浓度的增加,苯酚光解速率常数下降,表明扁藻与新月菱形藻EOM会抑制海水中苯酚的光解。但是,扁藻和新月菱形藻EOM对苯酚光解的影响程度存在一定差异,扁藻EOM的抑制作用比新月菱形藻稍强一些,这可能是由于不同微藻EOM的组成成分不同所致。苯酚作为一种广泛存在于水环境中的有机污染物,水环境因子会影响苯酚的光解历程。张燕[21]采用500 W氙灯作为光源,考察了不同pH对苯酚光解的影响,结果表明,随着pH的增大,苯酚的光解速率呈减小的趋势。张昕[22]发现,随着反应溶液中H2O2浓度的增加,溶液中苯酚的光解速率呈现先增加后减小的趋势,当H2O2浓度为100 mmol/L时,苯酚的光解速率最快。康春莉等[23]通过室内模拟试验,采用125 W高压汞灯作为光源,发现冰相中苯酚的光解速率随着光强和初始浓度的增加而加快,随着苯酚初始浓度的增加而减慢。
3.2 扁藻和新月菱形藻EOM与Fe(Ⅲ)、Cu(Ⅱ)对苯酚光解的影响
本研究结果表明,海水中扁藻和新月菱形藻EOM对苯酚光解的抑制作用可因Fe(Ⅲ)的加入而减弱,而Fe(Ⅲ)的加入对微藻EOM中苯酚的光解过程有促进作用,此外,在新月菱形藻EOM中Fe(Ⅲ)的促进作用强于扁藻EOM。高甲友[24]研究表明,苯酚的光解速率随Fe(Ⅲ)-草酸配合物浓度的增加而增大。已有的研究结果证实,水环境中Fe(Ⅲ)可以光还原生成Fe(II),Fe(II)可以被水中存在的氧化剂重新氧化生成Fe(Ⅲ)[16]。在Fe(Ⅲ)/Fe(II)的光化学循环过程中,·OH是其主要生成产物之一[17-18],由于·OH具有极强的氧化作用,绝大部分有机化合物都能与其发生反应而降解,因此,水环境中Fe(Ⅲ)的存在会对有机污染物的光解过程产生影响[25]。Maruthamuthu 等[26]研究了在Fe(Ⅲ)溶液中氟代乙酸的光解情况,发现0.1 mmol/L Fe(Ⅲ)可加快二氟乙酸的光解速率;于春艳等[16]在500 W氙灯 (λ>290)光照条件下,发现2,4-D在含有Fe(Ⅲ)的溶液中光解速率加快;刘慧[27]研究了含有Fe(Ⅲ)的双酚A溶液的光解,发现与未加入Fe(Ⅲ)的双酚A溶液相比,其光解速率明显加快;孙霞[18]发现,Fe(Ⅲ)的存在可促进水中阿特拉津的光解,随着Fe(Ⅲ)浓度的增大,促进作用也增强;Larson等[28]考察了三嗪类污染物在Fe(Ⅲ)溶液中的光解,发现加入Fe(Ⅲ)后,三嗪类除草剂的光解速率加快。
除Fe(Ⅲ)外,在扁藻和新月菱形藻EOM溶液中加入Cu(Ⅱ)后,溶液中苯酚的光解速率常数也增大。Cu(Ⅱ)是水环境中一种常见的过渡金属元素,研究表明,Cu(Ⅱ)有着与芬顿反应类似的光化学活性。Cu(Ⅱ)在吸收太阳光后,可以发生类芬顿反应,也会产生一定量的·OH[29]。水中阿特拉津在有Cu(Ⅱ)存在时,其光解反应速度会加快[18]。Bergamini等[30]研究了水中铜的配合物对苯酚光解影响,发现苯酚-Cu-乙腈体系中苯酚的光解速率加快。王平立[31]发现,Cu(Ⅱ)的存在明显促进了氯氰菊酯的光解。
本研究中还发现,当微藻 EOM、Fe(Ⅲ)、Cu(Ⅱ)三者共存时,溶液中苯酚的光解速率常数高于微藻EOM与Fe(Ⅲ)或Cu(Ⅱ)两者共存时的光解速率常数,这可能是在本试验条件下,Fe(Ⅲ)和Cu(Ⅱ)共存时生成的·OH量高于Fe(Ⅲ)或Cu(Ⅱ)单独存在时·OH的生成量。因此,微藻EOM与Fe(Ⅲ)和Cu(Ⅱ)共存对苯酚的光解促进作用增强。此外,当Fe(Ⅲ)和Cu(Ⅱ)共存于微藻EOM溶液中时,苯酚的光解受扁藻和新月菱形藻EOM的影响也存在一定差异。在新月菱形藻EOM体系中苯酚的光解速率常数要高于扁藻EOM体系,说明不同种类微藻EOM会影响苯酚的光解过程。
[1]Peuravuori J,Pihlaja K.Preliminary study of lake dissolved organic matter in light of nanoscale supramolecular assembly[J].Environmental Science & Technology,2004,38(22):5958-5967.
[2]展漫军,杨曦,杨洪生,等.天然水体腐殖质对双酚A光降解影响的研究[J].环境科学学报,2005,25(6):816-820.
[3]欧晓霞.腐殖酸及其不同级分和铁的络合物对阿特拉津光降解的影响[D].大连:大连理工大学,2008.
[4]Yu C Y,Quan X,Ou X X,et al.Effects of humic acid fractions with different polarities on photodegradation of 2,4-D in aqueous environments[J].Frontiers of Environmental Science and Engineering in China,2008,2(3):291-296.
[5]Murthy N B K,Moza P N,Hustert K,et al.Photolysis of thiabendazole in aqueous solution and in the presence of fulvic and humic acids[J].Chemosphere,1996,33(10):1915-1920.
[6]路艳君,姜爱莉,窦柏蕊,等.Cd(Ⅱ)、Zn(Ⅱ)对新月菱形藻生长及生化成分的影响[J].大连海洋大学学报,2010,25(2):178-182.
[7]Qu F S,Liang H,He J G,et al.Characterization of dissolved extracellular organic matter(dEOM)and bound extracellular organic matter(bEOM)of Microcystis aeruginosa and their impacts on UF membrane fouling[J].Water Research,2012,46(9):2881-2890.
[8]Ikawa M,Sasner J J,Haney J F.Inhibition of Chlorella growth by degradation and related products of linoleic and linolenic acids and the possible significance of polyunsaturated fatty acids in phyto-plankton ecology[J].Hydrobiologia,1997,356(1):143-148.
[9]Chiang Y R,Huang W Y,Jiunn T W.Allelochemicals of Botryococcus braunii(Chlorophyceace)[J].Journal of Phycology,2004,40:474-480.
[10]颜天,周名江,傅萌,等.赤潮异弯藻毒性及毒性来源的初步研究[J].海洋与湖沼,2003,34(1):50-55.
[11]Tsuneo H.Growth potential of Chattonella marina(Raphidophyceae)collected in Gokasho Bay,Central Japan[J].Bulletin of Plankton Society of Japan,1997,34(2):119-124.
[12]Dhananjaya P,Singh M B,Tyagi A K,et al.Antialgal activity of a hepatotoxin-producing cyanobacterium,Microcystis aeruginosa[J].World Journal of Microbiology & Biotechnology,2001,17:15-22.
[13]Fistarol G O,Legrand C,Graneli E.Allelopathic effect of Prymnesium parvum on a natural plankton community[J].Marine Ecology Progress Series,2003,255:115-125.
[14]刘萱,王华,于春艳,等.两种微藻胞外分泌物与NO-2、NO-3对2,4-D 光解的影响[J].环境科学学报,2014,34(4):944-949.
[15]张莉,杨桂朋.海洋中铁、锰、铜等过渡金属元素的光化学研究进展[J].海洋科学,2000,24(10):33-36.
[16]于春艳,赵慧敏,陈硕,等.水体中腐殖酸与Fe(Ⅲ)的络合物对 2,4-D 光解的作用[J].环境科学,2010,31(2):379-384.
[17]Liu H,Zhao H M,Chen S,et al.Photochlorination of bisphenol a by UV-Vis light irradiation in saline solution:effects of iron,nitrate and citric acid[J].Environmental Chemistry,2010,7:548-553.
[18]孙霞.铜、铁对水体中阿特拉津的光解作用[D].大连:大连理工大学,2010.
[19]杜浩,危起伟,刘鉴毅,等.苯酚、Cu2+、亚硝酸盐和总氨氮对中华鲟稚鱼的急性毒性[J].大连海洋大学学报,2007,22(2):118-122.
[20]Poulopoulos S G,Arvanitakis F,Philippopoulos C J.Photochemical treatment of phenol aqueous solution using ultraviolet radiation and hydrogen peroxide[J].Journal of Hazardous Materials,2006,129(12):64-68.
[21]张燕.天然水体中pH对酚类污染物光解的影响[D].大连:大连理工大学,2009.
[22]张昕.典型有机污染物的光降解动力学及机理研究[D].呼和浩特:内蒙古师范大学,2012.
[23]康春莉,唐晓剑,郭平,等.硝酸根存在下冰相中苯酚的光转化[J].高等学校化学学报,2009,30(4):757-761.
[24]高甲友.Fe(Ⅲ)-草酸配合物光分解降解苯酚的研究[J].合肥工业大学学报,2004,27(7):792-796.
[25]Sedlak D L,Hoigné J.The role of copper and oxalate in the redox cycling of iron in atmospheric waters[J].Atmosphere Environment,1993,27A:2173-2185.
[26]Maruthamuthu P,Huie R E.Ferric ion assisted photooxidation of haloacetates[J].Chemosphere,1995,30(11):2199-2207.
[27]刘慧.水环境中卤代酚类有机污染物的光化学形成过程[D].大连:大连理工大学,2011.
[28]Larson R A,Schlauch M B,Marley K A.Ferric ion promoted photodecomposition of triazines[J].Journal of Agricultural and Food Chemistry,1991,39(11):2057-2062.
[29]Lam S W,Chiang K,Lim T M,et al.Effect of charge trapping species of cupric ions on the photocatalytic oxidation of resorcinol[J].Applied Catalysis B-Environmental,2005,55:123-132.
[30]Bergamini P,Maldotti A,Sostero S,et al.Photochemical redox reactivity in chlorocopper(II)complexes[J].Inorganica Chimica Acta,1984,85:L15-L17.
[31]王平立.铜和腐植酸对水中功夫菊酯和氯氰菊酯光解的影响[D].镇江:江苏大学,2012.
