超声波诱导钙黄绿素脂质体缓释特性评价
2015-02-17陈国明刘盛平罗亚芳
陈国明,刘盛平,罗亚芳
(重庆理工大学 a.药学与生物工程学院; b.化学化工学院,重庆 400054)
超声波诱导钙黄绿素脂质体缓释特性评价
陈国明a,刘盛平a,罗亚芳b
(重庆理工大学 a.药学与生物工程学院; b.化学化工学院,重庆 400054)
在脂质体药物缓释研究中,超声波因其无创、易控制等优点而备受关注。采用去离子水制备聚乙二醇修饰的钙黄绿素脂质体,并用负染色法对超声波作用前后的脂质体外观形态进行了透射电镜观测。同时采用阻抗分析法测定脂质体溶液的阻抗变化,以评价超声波作用后脂质体内包药物的释放特性。结果表明:超声波可促进多层脂质体膜的融合形成单层膜结构,最终将脂质体破坏成微小胶束,并且可通过调整超声波的作用时间和功率,控制药物的释放速率。
脂质体;超声波;阻抗;药物缓释
脂质体(liposome)药物缓释系统是目前最先进的第4代靶向给药系统,被喻为“生物导弹”。它是直径几十纳米到几十微米不等的类似于细胞的微小球状物,可以包裹各种类型的药物,具有优良的生物相容性和仿生性,能有效提高药物的靶向性,降低药物毒副作用,提高生物利用度,是提高药物疗效的重要途径。自1971年 Gregoriadis G等[1]首次将脂质体作为药物载体进行研究以来,脂质体一直都是缓释药物研究的主要热点之一。
脂质体作为靶向给药载体,目前有基于pH值、温度、光、电场、磁场、超声波等敏感原理控制其内药物缓释[2-7]的方式。其中由于超声波能在体内聚焦,为非侵入式方式,且可方便地通过调整其频率、功率、作用时间等进行控制,因此尤其受到人们重视。研究者们一般选用医用超声(1~10 MHz)[8-9]和低频超声(20~100 kHz)[10-11]作为药物释放诱因。也有研究者认为低频超声比医用超声更有效[11]。但到目前为止,超声波诱导脂质体药物释放的机理尚未明确。本文采用频率为28 kHz的低频超声波作为外界刺激,研究其对脂质体药物释放的影响。
荧光百分比法[12]是评价脂质体药物释放特性的传统方法,但药物必须具有荧光特性,这就限制了该方法的应用范围。本研究采用阻抗法测量药物释放前后脂质体溶液的阻抗值变化,根据事先测定的药物浓度与阻抗值之间的对应关系,准确、唯一地计算出的药物释放量,进而精确确定脂质体药物释放百分比[13]。
本研究以油酰磷脂酰胆碱(POPC)、二棕榈酰磷脂酰乙醇胺聚乙二醇 (DPPE-PEG2000)以及胆固醇按不同摩尔比混合,采用冷冻溶解法结合微滤膜挤出法制备了聚乙二醇(PEG)修饰的钙黄绿素脂质体。采用低频超声波(28 kHz)作为外界刺激,用透射电子显微镜观察了超声波作用前后的形貌变化,并使用阻抗法评价钙黄绿素脂质体的释放特性。
1. 试剂与方法
1.1 试剂
油酰磷脂酰胆碱(POPC)和二棕榈酰磷脂酰乙醇胺聚乙二醇(DPPE-PEG2000)均购自AVT公司。胆固醇,黄绿素(3,3’-双(甲亚胺二乙酸)荧光素),氢氧化钠,丙酮,乙醇,乙醚,氯仿,钼酸铵,磷脂酶C均购自日本和光纯药株式会社。Formvar(粉末)购自SPI公司,琼脂糖凝胶4B(Sephadex 4B)购自Sigma。由于钙黄绿素难溶于水,故将其以1:4的摩尔比溶解于NaOH溶液配得100 mM的钙黄绿素钠后再将其包覆于脂质体内。
1.2 脂质体的制备
本研究所用脂质体样本采用冷冻溶解-微滤膜挤出法制得[13]。脂膜组分POPC、DPPE-PEG2000和胆固醇的摩尔百分比为9∶1∶10。所加钙黄绿素溶液浓度为100 mM,尺寸调整用聚碳纤维膜的孔径为100 nm。所得脂质体溶液用去离子水经琼脂糖凝胶(Sephadex 4B)滤除未包入的钙黄绿素,最后用胆碱氧化酶·DAOS法检测脂质体的浓度。
1.3 透射电子显微镜观测
将脂质体样品滴加到亲水化处理后的电镜专用铜网(覆有fomvar膜和碳膜)表面,再经2%的钼酸铵水溶液于铜网上进行负染色,在空气中干燥后放进透射电子显微镜(Tecnai G2 Spirit BioTWIN, FEI, USA)中对脂质体粒径大小和形态进行观测并拍照[13]。透射电镜加速电压为120 kV。
1.4 阻抗测试与评价
采用安捷伦4292A阻抗分析仪(安捷伦,日本)进行脂质体的阻抗测试分析。所用电极为2个不锈钢电极(CUY560, Nepa Gene,日本),电极间距为5 mm,其在溶液中的位置如图1所示。由于阻抗对样本温度敏感,因此整个阻抗测量均在恒温器(IN602W, 大和科学株式会社,日本)中进行,设定温度为25 ℃。
脂质体的释放率的阻抗评价采用浓度百分比法[14],如式(1)所示。
(1)
式(1)中:R(t)是百分比释放率;Mt为t时刻释放出的药物浓度;Mini为初始药物浓度;Mfin是脂质体内药物完全释放时的药物浓度,此处为脂质体内加入足量Triton X-100后将脂质体完全破坏后得到的浓度。

图1 阻抗测试装置示意图

图2 阻抗与钙黄绿素溶液浓度关系曲线
为了根据所测得的阻抗值确定相应的药物浓度,本文在使用阻抗评价之前,建立了阻抗与药物浓度之间的对应关系,如图2所示。虽然药物浓度与阻抗为非线性关系,但通过该曲线仍可唯一确定脂质体释放药物的浓度。
1.5 温度对脂质体稳定性影响评价
本文研究了温度对制备聚乙二醇修饰的钙黄绿素脂质体释放特性的影响。将脂质体样品温度从25 ℃升高至35 ℃,恒温10 min,然后冷却到25℃,恒温10 min;接着将温度升高至45 ℃恒温10 min,又重新降温至25℃并保持10 min;然后将温度升至55 ℃,恒温保持10 min后冷却至25 ℃;10 min后继续升温至65 ℃,恒温10 min,最后冷却至25 ℃并恒定10 min。整个过程中实时连续检测其阻抗值,评价温度(35,45,55,65 ℃)对其钙黄绿素释放率的影响。
1.6 超声波诱导药物释放
本研究使用超声破碎机(UR-20P, TOMY精工株式会社,日本),额定频率为28 kHz, 作为加速脂质体样品内包钙黄绿素的释放速率的外界因素,实验操作示意图如图3(a)所示。圆底试管中盛有3 mL脂质体溶液,超声探头垂直插入脂质体溶液中,探头顶端位于液面下4 mm处,超声波的功率为18 W(约366.7 W/cm2)。为了抑制溶液温度的持续上升,超声处理在恒温器(IN602W, 大和科学株式会社,日本)中进行,其温度设定在25 ℃,且超声波以1/2的占空比施加,即超声施加1 min,停2 min,施加方式如图3(b)所示。本文中所指的超声时间是指实际的施加超声时间,不包括停顿休息的时间。经激光温度计(TEMPERRATURE HiTESTER 3445, HIOKI,日本)检测,溶液温度值最高未超过60 ℃。阻抗测量为脂质体样本溶液温度恢复到25 ℃时进行的。

图3 超声波处理装置
2 结果与讨论
透射电子显微镜(TEM)可看到光学显微镜下无法看清的纳米级微细结构。图4为超声波作用前的脂质体TEM照片。该图表明所制备的脂质体为粒径范围约80~200 nm的球形或椭球形。右上角放大图可清晰地看到其多层膜结构,且膜厚度约为4~5 nm。图5为超声波作用10 min后的脂质体TEM照片。图中可见直径约200~400 nm的脂质体,而之前80~200 nm的脂质体数量几乎不可见。可能是由于多层膜脂质体在超声波作用下,脂质体膜层相互融合,从而形成较大直径的单层膜脂质体。图6为超声波作用20 min后的脂质体TEM照片。图中可见大量长度约30 nm以下的细长棒状物,表明在超声波的进一步作用下,大尺寸脂质体被破坏并形成小脂质体或胶束。该结果表明:当脂质体为多层膜结构时,超声波可促进-膜间相互融合,形成层数更少,甚至是单层膜的结构。而当脂质体为单层膜结构时,超声波则表现为破碎作用,将脂质体破碎为更小的脂质体或胶束。

图4 超声波作用前的脂质体,bar=200 nm

图5 超声波作用10 min后的脂质体TEM照片,bar=200 nm

图6 超声波作用20 min后的脂质体TEM照片,bar=50 nm
温度对脂质体膜的通透性有重要的影响。一般说来,温度越高,膜的流动性就越高,就越有利于脂质体内部药物的释出。为确认究竟是超声波的机械效应还是热效应引起的药物释放,本研究对所配置的脂质体释放特性的温度影响进行了评价。将脂质体样本依次在25,35,45,55,65 ℃条件下保持10 min,再将样本温度恢复到25 ℃,通过阻抗测量实时监测整个反复升温降温的过程。如图7所示,标有1~5的水平段,为25 ℃时的阻抗值,从图中可以发现,随着温度升高,脂质体的阻抗值明显降低,但当温度恢复到25 ℃时,阻抗值亦基本恢复到最初25 ℃时的大小,未发生显著变化。
本研究所用脂质体为POPC、DPPE-PEG2000和胆固醇构成(分子结构见图8),其中POPC是构成脂质体双分子层膜的主要成分,它构成了脂质体膜的骨架,可在其上进一步镶嵌各种功能物质,从而达到调整脂质体膜特性目的。DPPE-PEG2000的双链端镶嵌于脂质体膜内,其具有的较长碳链端则伸向溶液中,在脂质体表面形成一层类似于细胞表面“糖被”的结构,增加了脂质体相互凝聚融合的难度,且可避免脂质体被人体免疫系统识别,延长脂质体的血液循环时间[15]。而胆固醇则是镶嵌在脂质体膜中的另一种重要物质。在较高温度时,胆固醇分子限制脂质分子脂酰链末端的甲基运动,减少qauch构象,降低膜流动性[16]。通过调整膜中胆固醇的配比,可改变脂质体膜的相变温度与流动性。本文所用脂质体为POPC、DPPE-PEG2000和胆固醇按摩尔比9∶1∶10配置,胆固醇含量达50%,极大地提高了相变温度。实验表明在65 ℃以下时,温度对胆固醇含量为50%的脂质体膜的通透性并无显著影响。实验结果同时表明,运用阻抗法可实现连续在线实时监测脂质体的释放特性。为了限制脂质体温度升高,研究中采用图3(b)所示的PWM波控制超声波的施加。经激光温度计实时检测,脂质体样本的最高温度小于60 ℃。即超声波作用所引起的温度提升不足以引起脂质体内药物的有效释放,可进一步认为超声波作用下药物释放均是由超声波的机械效应所引起。

图7 温度对脂质体释放特性影响的阻抗图
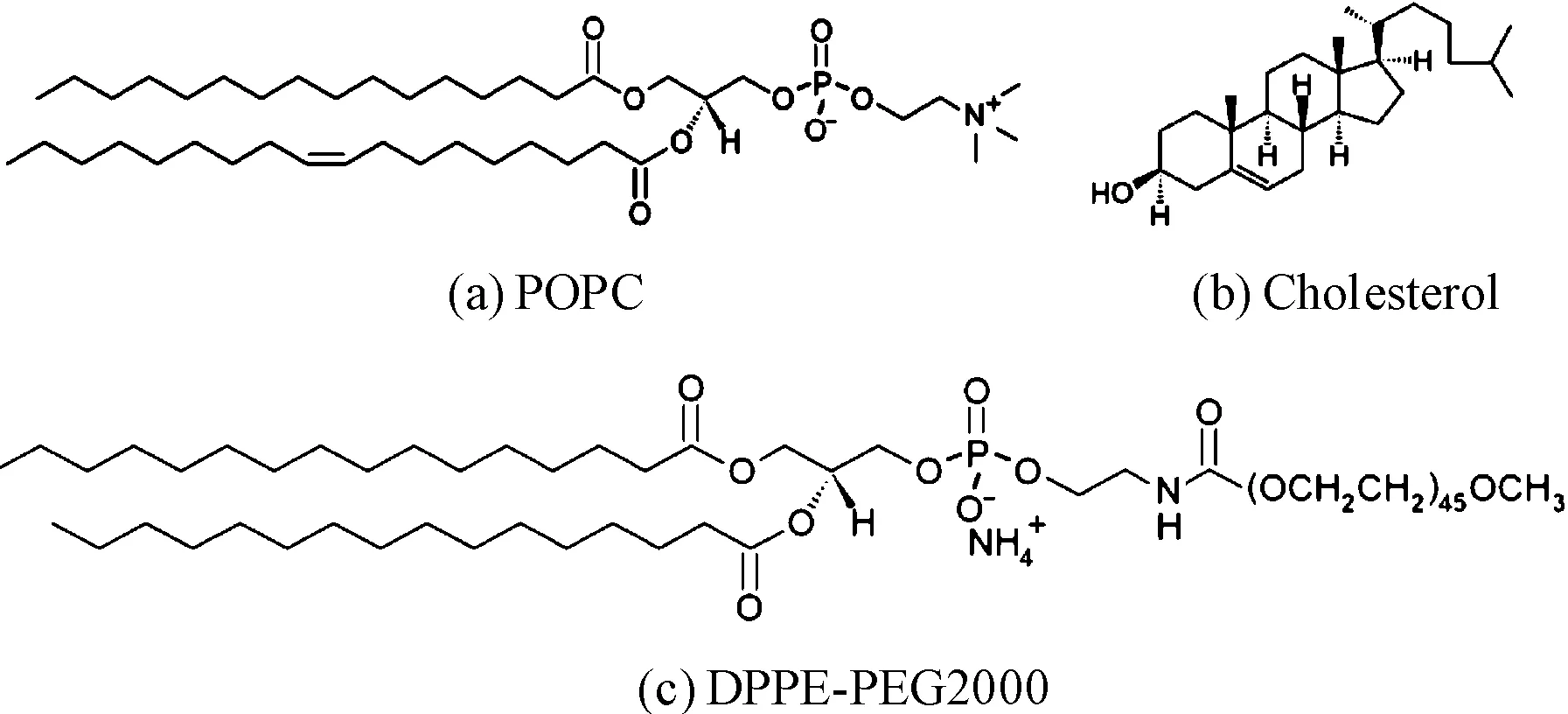
图8 脂质体膜主要组分POPC、DPPE-PEG2000,胆固醇的分子结构式
机械效应是超声波的原发效应,不管何种强度的超声波均产生该效应。在超声波作用下,各质点受到交替变化的压缩和伸张,产生正压和负压,由此得到巨大的加速度。脂质体在此作用力作用下,则可能在脂膜上打开临时通道,使得其内包药物释放到脂质体外液相环境中。图9是脂质体分别在超声波发生器(额定工作频率28 kHz)输出功率为10 W, 14 W, 18 W时钙黄绿素的释放特性的阻抗评价曲线。由图9可见,未施加超声波时的释放曲线近似为一水平直线,表明脂质体内的钙黄绿素几乎没有释放。在受到超声波刺激时,脂质体内所包覆的钙黄绿素快速释出,其释放速率随超声波功率呈正相关,功率越大,释放速率越快。随着超生作用时间的延长,脂质体内包药物率呈负指数增长。而当释放率在60%以下时,释放率和超生时间可近似为线性关系。由此可见,施加超声波可促进脂质体内所包裹药物的释放,并可通过调整超声波的功率以及作用时间可以控制药物释放速率。

图9 不同功率超声波(28 kHz)作用下钙黄绿素脂质体的释放特性曲线
3 结束语
本文对低频超声波(28 kHz)作用前后的脂质体形貌进行了电子显微镜观察。结果表明,低频超声波能促进多层膜脂质体融合称为单层膜脂质体,并可进一步将单层脂质体破碎成胶束。通过调整超声波的功率和作用时间以控制脂质体内药物释放速率。
[1] Gregoriadis G,Leathwood P D,Ryman B E. Enzyme entrapment in liposomes[J]. FEBS Lett,1971(14):95-99.
[2] Xin Liu,Guihua Huang,Formation strategies,mechanism of intracellular delivery and potential clinical applications of pH-sensitive[J].Asian Journal of Pharmaceutical Sciences,2013,8(6): 319-328.
[3] López-Noriega A,Ruiz-Hernández E,Quinlan E,et al.Thermally triggered release of a pro-osteogenic peptide from a functionalized collagen-based scaffold using thermosensitive liposomes[J]. Journal of Controlled Release,2014,187: 158-166.
[4] MinHui Wang,Jin-Chul Kim. Light- and temperature-responsive liposomes incorporating cinnamoyl Pluronic F127[J].International Journal of Pharmaceutics,2014,468(1/2):243-249.
[5] Zhi-Wei Liu,Xin-An Zeng,Da-Wen Sun,et al. Effects of pulsed electric fields on the permeabilization of calcein-filled soybean lecithin vesicles[J].Journal of Food Engineering,2014,131: 26-32.
[6] Oliveira H,Pérez-Andrés E,Thevenot J,et al. Magnetic field triggered drug release from polymersomes for cancer therapeutics[J]. Journal of Controlled Release, 2013,169(3): 165-170.
[7] Ninomiya K,Yamashita T,Kawabata S,et al. Targeted and ultrasound-triggered drug delivery using liposomes co-modified with cancer cell-targeting aptamers and a thermosensitive polymer[J]. Ultrasonics Sonochemistry,2014,21(4): 1482-1488.
[8] Ninomiya K,Yamashita T,Kawabata S,et al. Targeted and ultrasound-triggered drug delivery using liposomes co-modified with cancer cell-targeting aptamers and a thermosensitive polymer[J]. Ultrasonics Sonochemistry,2014,21(4):1482-1488.
[9] Denise A B,Vaidya S S,Kopechek J A,et al. Ultrasound-Triggered Release of Recombinant Tissue-Type Plasminogen Activator from Echogenic Liposomes[J]. Ultrasound in Medicine & Biology,2010,36 (1): 145-157.
[10]Evjen T J,Nilssen E A,Barnert S,et al. Ultrasound-mediated destabilization and drug release from liposomes comprising dioleoylphosphatidylethanolamine[J]. European Journal of Pharmaceutical Sciences,2011,42(4): 380-386.
[11]Pong M,Umchid S,Guarino A J,et al.In vitro ultrasound-mediated leakage from phospholipid vesicles[J].Ultrasonics,2006,45(1): 133-145.
[12]Aleandri S,Bombelli C,Bonicelli M G,et al. Fusion of gemini based cationic liposomes with cell membrane models: implications for their biological activity[J]. Biochimica et Biophysica Acta (BBA)-Biomembranes,2013,1828(2): 382-390.
[13]陈国明,江钟伟,罗亚芳,等.聚乙二醇修饰的钙黄绿素脂质体的制备与评价[J].中国医院药学杂志,2011,31(5): 1-4.
[14]Guoming Chen,Zhongwei Jiang,Yoshimotob M,et al. Electric impedance method for evaluation of the release property ofcalcein-encapsulated liposomes,Colloids and Surfaces B[J]. Biointerfaces,2009,74: 32-36.
[15]Daleke D L,Hong K,Papahadjopoulos D. Endocytosis of liposomesby macrophages: binding,acidification and leakage of liposomesmonitored by a new fluorescent assay[J]. Biochim Biophys Acta-1024,1990,352-66.
[16]王冰.胆固醇对生物膜流动性的影响,广西医科大学学报[J].1997,14(1): 34-36.
(责任编辑 何杰玲)
Ultrasound Induced Release Property Evaluation of Calcein Encapsulated Liposome
CHEN Guo-minga, LIU Sheng-pinga, LUO Ya-fangb
(a.College of Pharmacy and Biological Engineering; b.College of Chemistry and Chemical Engineering, Chongqing University of Technology, Chongqing 400054, China)
In the study of liposome controlled release, ultrasound has been attracted great interests because of its merits of non-invasive and easily to be controlled. Calcein trapped PEG-liposome was prepared with de-ionized water and morphology of the liposomes before and after ultrasonication were studied by transmission electron microscopy (TEM) with negative staining method. An impedance evaluation method was employed to monitor the impedance change of liposomes thus to evaluate the liposome’s release property. Results show that ultrasound could accelerate membrane fuse of liposome’s multilayer and would destroy liposomes into micelles finally. By adjusting ultrasound power and ultrasonication time, the release rate could be well controlled.
liposome; ultrasound; impedance; controlled drug release
2015-01-20 基金项目:重庆市自然科学基金资助项目(CSTC,2011BB5111)
陈国明(1979—),男,浙江衢州人,副教授,主要从事药物缓释控制研究。
陈国明,刘盛平,罗亚芳.超声波诱导钙黄绿素脂质体缓释特性评价[J].重庆理工大学学报:自然科学版,2015(3):52-57.
format:CHEN Guo-ming, LIU Sheng-ping, LUO Ya-fang.Ultrasound Induced Release Property Evaluation of Calcein Encapsulated Liposome[J].Journal of Chongqing University of Technology:Natural Science,2015(3):52-57.
10.3969/j.issn.1674-8425(z).2015.03.011
R944.9
A
1674-8425(2015)03-0052-06
