常温等离子体诱变选育高效耐镉硫酸盐还原菌
2015-02-16朱晓丽张建霞徐雅雅董立萍
朱晓丽,张建霞,徐雅雅,姚 倩,李 梦,董立萍
(西北大学 城市与环境学院, 陕西 西安 710127)
·环境科学·
常温等离子体诱变选育高效耐镉硫酸盐还原菌
朱晓丽,张建霞,徐雅雅,姚 倩,李 梦,董立萍
(西北大学 城市与环境学院, 陕西 西安 710127)
从镉污染土壤中分离出35株硫酸盐还原菌(SRB),采用优化的硫酸钡沉淀法测定其硫酸盐还原活性,筛选出3株在缺氧和有氧条件下硫酸盐还原活性均较高的菌株,采用常温等离子体诱变技术对筛选的菌株进行诱变处理,筛选出一株硫酸盐还原活性高且耐受Cd生长能力强的诱变株WK 2-5-2,该菌株在液体培养基中能够耐受100mg/L Cd2+生长,菌数达到4.12×107CFU/mL,比其原始菌株WK 2-5的数量增加了约100倍。该菌株在缺氧和有氧条件下的硫酸盐还原活性分别为99.17%和78.37%,比其相应的原始菌株WK 2-5的硫酸盐还原活性分别增加了1.49%和43.88%。通过测定WK 2-5-2的16S rRNA序列,该菌株与路德维希肠杆菌(Enterobacter ludwigii EN-119)同源性达到100%,初步鉴定该菌株为路德维希肠杆菌。该菌株具有应用于镉污染土壤或水体修复的潜力。
硫酸盐还原菌;镉污染土壤;等离子体诱变
硫酸盐还原菌(Sulfate-Reducing Bacteria, 简称SRB)是一类形态各异、营养类型多样,能够利用硫酸盐或者其他氧化态硫化物作为电子受体来氧化有机物的细菌或古菌[1]。
SRB能够将环境中的SO42-转化为S2-,S2-与金属离子相互作用生成沉淀,从而达到固定重金属的目的[2]。SRB修复重金属污染的原理包括[3]:① SRB代谢过程产生的S2-与废水中的重金属离子反应,促进形成硫化物重金属沉淀可用下面的式(1)、式(2)和式(3)表示,其中CH2O代表有机质,Me2+代表二价金属阳离子;② SO42-转化为S2-而使被处理废水的pH提高[4],有利于重金属离子形成氢氧化物沉淀;③ SRB代谢过程中生成CO2,部分重金属还可以和CO32-反应生成不溶性的碳酸盐而去除[5]。
SO42-+2CH2O→S2-+2CO2+2H2O,
(1)
S2-+2CO2+2H2O→H2S+2HCO3,
(2)
Me2++H2S→MeS ↓+2H+。
(3)
目前,SRB已被广泛应用于酸性重金属废水的治理[6-7],而利用SRB治理土壤重金属污染的相关报道甚少。因此,研究SRB用于土壤重金属污染的修复具有十分重要的意义。
在所有Cd的化合物中,CdS的溶解度最低,其次是Cd3(PO4)2[8],因此,目前采用形成CdS沉淀修复Cd污染已逐渐取代了之前采用形成Cd(OH)2或CdCO3修复Cd污染的方法。但是,自然界野生的硫酸盐还原菌抗重金属生长能力较弱。吕琴等的研究表明:重金属污染对土壤中硫酸盐还原菌的种群数量和硫酸盐还原活性具有明显的抑制作用,随着重金属污染量的增加,抑制作用越强;当加入的Cd2+为1.5mg/kg时,不同稻田土壤SRB种群数量和硫酸盐还原活性分别下降32%~45%和15%~30%[9]。范文宏等采用从大庆油田采油驱注水中分离的一株SRB固定土壤中的Cd,土壤中可交换态Cd和碳酸盐结合态Cd的含高,但当土壤中Cd的总量达到40 mg/kg时,SRB的生长和硫酸盐还原活性明显降低[10],另外,由于表层土壤和植物根际土壤氧的浓度较高,而较深层土壤为缺氧环境,因此,用于土壤修复的SRB在有氧和缺氧条件下均需具有较高的硫酸盐还原活性,从而才能够达到有效固定土壤Cd污染的目的。由此可见,筛选出在有氧和缺氧条件下均需具有较高的硫酸盐还原活性且耐高浓度镉生长的SRB菌株,对其应用于镉污染土壤的修复具有重要的意义。
本研究拟采用常温等离子体诱变技术对分离的SRB进行诱变选育,筛选出具有较高抗镉生长能力的和在缺氧、有氧环境下具有较高硫酸盐还原能力的诱变菌株,以期用于镉污染土壤或水体的修复治理。
1 实验材料与方法
1.1 样品来源
用于分离SRB菌株的土样采自陕西宝鸡某铅锌矿尾矿山下,长期受尾矿淋溶水污染的土壤,取样土层为0~20cm表层土或尾矿山下植物根际土,从尾矿山下采集4份土样,其编号分别为WK1,WK2,WK3,WK4;尾矿山下绿蒿根际土样,编号分别为LH1,LH1;尾矿山下白菜根际土样,编号分别为BC1,BC2;尾矿山下玉米根际土样,编号分别为YM1,YM2。
1.2 培养基成分及其配制方法
SRB富集培养基组成为:K2HPO40.5 g,(NH4)2SO42.5 g,NaHCO30.5 g,CaCl20.2 g,MgSO41.0 g,酵母膏 1.5 g,乳酸钠 2.0 mL,蒸馏水1 000 mL。pH 7.0~7.2,121℃灭菌20 min。(NH4)2Fe(SO4)2,L-半胱氨酸盐分别用无菌蒸馏水配制为10 mg/mL和50 mg/mL,用0.25 μm的无菌过滤器过滤后,临用前分别以5 mL/100 mL和1 mL/100 mL的比例加入已灭菌的培养基中。
1.3 SRB的分离纯化
将所采土样分别按照2%的比例加入装有100 mL SRB液体培养基的150mL三角瓶中,用液体石蜡封面,35℃静置培养2~3d,培养瓶中出现大量黑色沉淀且具有臭鸡蛋气味,即为富集好的SRB菌液。采用稀释涂布双皿夹层法分离纯化SRB,35℃,培养3~4d。挑选平板上较大的黑色单菌落接入SRB液体富集培养基中,培养至对数期,重复以上的操作,直至固体培养基上长出的为纯菌落。
1.4 SRB硫酸盐还原活性的测定
分别测定SRB在缺氧和有氧条件下的硫酸盐还原活性。将上述分离得到的SRB分别加入SRB富集液体培养基中,共分为2组,一组用液体石蜡封面,另一组不用液体石蜡封面,静置于生化培养箱中,35℃,培养7d后,采用优化的硫酸钡比浊法[11]。
1.5 DBD诱变选育高效耐镉SRB
分别配制不加(NH4)2Fe(SO4)2的SRB富集液体和固体培养基,加入50mg/L和100mg/L的镉(以氯化镉的形式加入)。采用DBD诱变处理上述筛选的SRB,选育高效耐镉SRB[12]。将诱变后的菌株接种于含Cd2+的上述SRB液体培养基中,采用混合平板叠皿法计数,在缺氧和有氧条件下测定其硫酸盐还原活性。筛选出在缺氧和有氧条件下硫酸盐还原活性和耐镉生长能力最强的菌株。
1.6 SRB的初步鉴定
将上述筛选的菌株接种在SRB富集液体培养基中,35℃静置培养至对数期,6 000 r/min离心收集菌体,用Biospin Bacteria Genomic DNA Extraction Kit 试剂盒分离纯化基因组DNA,采用16S rRNA序列分析法鉴定其种属。采用通用引物27FP1(5′-AGAGTTTGATCCTGGCTCAG-3)和1429R(5′-GGTTACCTTGTTACGACT T-3′)。目标条带送北京三博远志公司测序。通过美国国家生物技术信息中心 NCBI 数据库http://ncbi.nlm.nih.gov/blast进行核酸序列的在线比对,采用Mega4.0软件构建系统发育树。
2 结果与讨论
2.1 硫酸盐还原菌的分离纯化结果
土壤悬液富集培养24h后,培养瓶中出现大量黑色沉淀且具有臭鸡蛋气味,将富集培养液进行涂布叠皿夹层培养, 36~48h后培养基上长出大小不同的黑色圆形菌落(如图1),按照其大小、生长形态等特征从平皿中分离纯化出35株SRB。
2.2 SRB硫酸盐活性测定
分离的35株SRB在缺氧和好氧条件下硫酸盐还原活性见表1。
从表1可以看出,在缺氧条件下,除WK 3-6,WK 2-7和LH1-2这3株菌的硫酸盐还原能力较低外(硫酸盐还原率<90%),其他32株SRB的硫酸盐还原率均>90%。在有氧条件下,SRB的硫酸盐还原活性明显降低,WK 2-5,SW3-3,WK 3-7的硫酸盐还原活性较强,其硫酸盐还原活性均>45%。因此,选择这3株菌进行下一步的诱变处理。
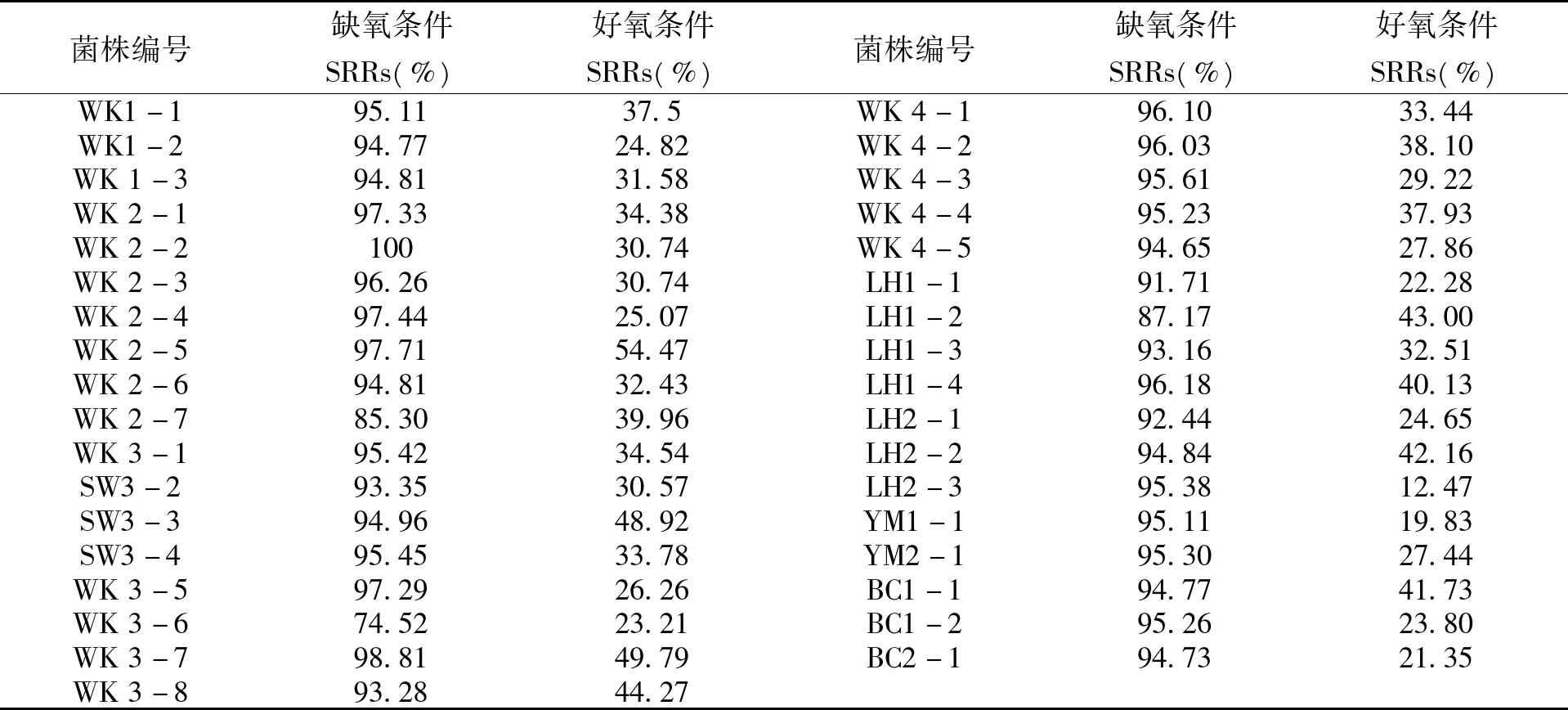
表1 SRB硫酸盐还原活性Tab.1 Sulfate-reducing activity of SRB
2.3 DBD诱变选育高效耐镉SRB
WK 2-5 ,SW3-3和WK 3-7经DBD诱变处理后,从含Cd2+的固体平板上挑选出9株菌落较大的菌株,其在液体培养基中耐镉生长能力和硫酸盐还原活性见表2。从表2可以看出,诱变菌株与其相应的原始菌株相比,其抗镉生长能力增强,仅有个别菌株耐受能力下降。其中,WK 2-5-2在含Cd2+的液体培养基中生长最佳,在含50 mg/L Cd2+和100 mg/L Cd2+的液体培养基中菌数分别达到8.1×108CFU/mL和4.2×107CFU/mL,与其相应的原始菌株WK 2-5相比,其抗镉生长能力显著增强。WK2-5-2在有氧条件下硫酸盐还原率为78.37%,比原始菌株WK2-5的硫酸盐还原活性提高了43.88%,且在含较高浓度Cd2+的培养中生长良好。因此,选出WK2-5-2进行下一步的鉴定。
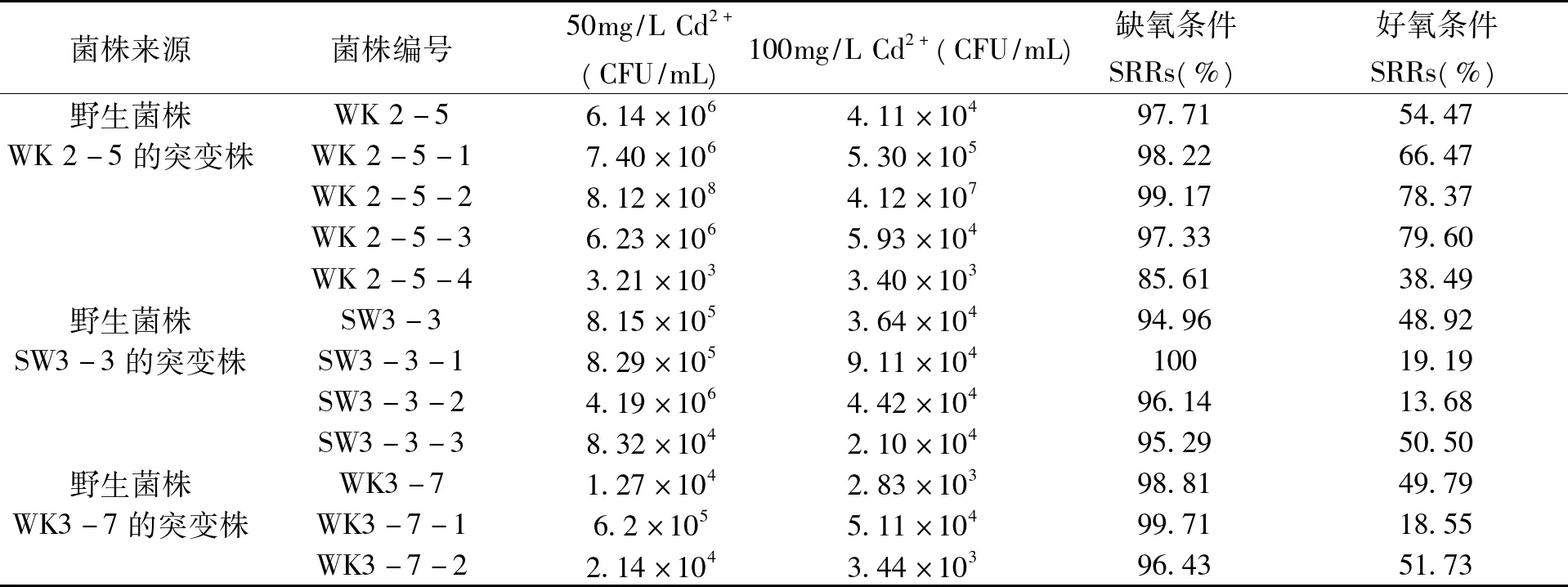
表2 诱变和野生菌株镉耐受及其硫酸盐还原活性Tab.2 Cd-tolerant ability and sulfate reducing activity of mutants and theirs related wild strains
2.4 菌株的初步鉴定
根据NCBI的比对结果,Accession No. JQ308612菌株WK 2-5-2与路德维希肠杆菌 (Enterobacter ludwigii EN-119)同源性达到99%,因此,确定菌株SW2-1-5为路德维希肠杆菌。菌株WK 2-5-2的系统发育树如图2所示。
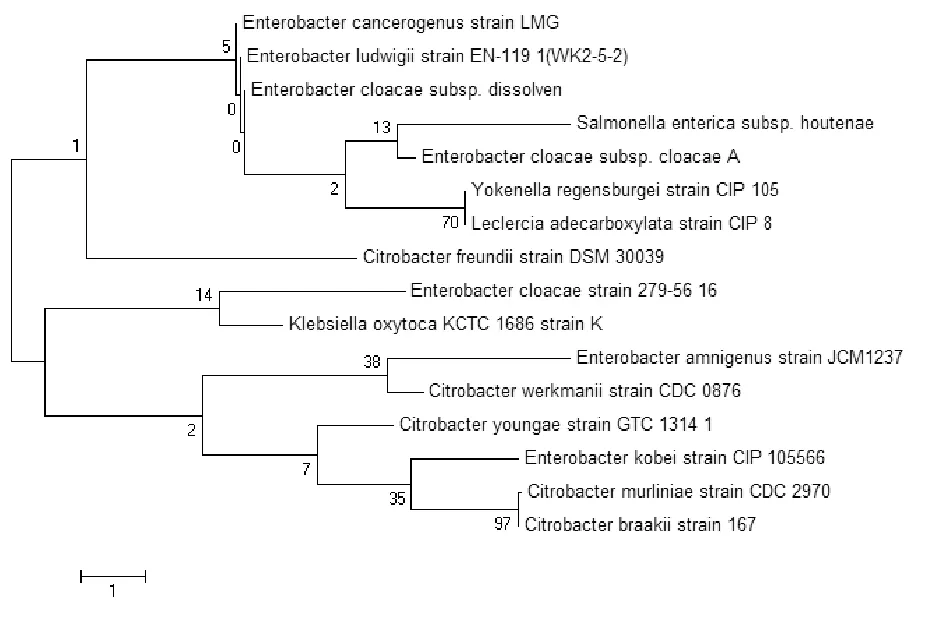
图2 SW2-1-5的系统发育树Fig.2 The phylogenetic tree of SW2-1-5
3 结果和讨论
自然界的野生菌株在生产实践中往往存在生长缓慢、效率低、不能长期保存等诸多缺陷[13],而且在污染环境中,野生菌株的生长常受到抑制,不能满足污染修复的需要。为此,需要采用多种方法来打破菌种的正常代谢,提高其生长能力和抗性能力等,要达到此目的,主要措施就是需要进行菌种的诱变选育,如进行物理和化学诱变等。但物理诱变和化学药剂诱变对人体基本上都有致癌、致突变和致畸等远期效应,因此这些传统的理化诱变方法在其制备、运输等实际应用中存在诸多不便。
等离子体诱变技术是一种设备简单、安全无污染的新型物理诱变技术。Farr[14]等和Marnett[15]认为等离子体放电过程中产生的活性物质,如活性氧分子和羟基自由基,能与DNA分子中的碱基和戊糖发生反应引起DNA分子链的断裂,DNA分子的改变是生物体产生诱变体的前提。
本文采用介质阻挡等离子体诱变技术对筛选的3株SRB进行诱变处理,筛选出一株硫酸盐还原活性高且耐镉生长能力强的菌株WK 2-5-2与原始菌株相比,其抗镉生长能力显著增强,在含50mg/L Cd2+和100mg/L Cd2+的液体培养基中菌数比其他野生菌株分别增加了100~1 000倍。此外,WK2-5-2在有氧和缺氧条件下硫酸盐还原率达到78.37%和99.17%,比原始菌株WK2-5的硫酸盐还原活性分别提高了43.88%和1.49%。因此,WK2-5-2具有应用于镉污染土壤或水体修复的潜力。诱变菌株硫酸盐还原性能的提高,其原因可能是诱变改变了与APS还原酶和亚硫酸盐还原酶相关的某些基因,促进APS还原酶和亚硫酸盐还原酶活性提高,使其更容易还原硫酸盐,也有可能是由于等离子体诱变对硫酸盐还原菌的细胞膜产生了一定的破坏作用,使得细胞膜的通透性有所增加,更易从外界环境吸收营养物质,进而提高了APS还原酶和亚硫酸盐还原酶活性,但其抗Cd生长能力和硫酸盐还原活性增强的确切原因尚需进一步研究。
致谢:本研究得到了陕西省教育厅(编号:08JK453)陕西省榆林市省市联合资助项目,榆林市科技局产学研项目,国家大学生创新实验计划项目(编号:201210697005,201310697025)资助。在此一并表示感谢。
[1] 潘嘉川, 邵宗泽, 曹宏斌, 等. 硫酸盐还原菌的分离纯化方法[J].微生物学杂志, 2007, 2(5): 79-83.
[2] SHEORAN A S, SHEORAN V, CHOUDHARY R P. Bioremediation of acid-rock drainage by sulphate-reducing prokaryotes: A review[J].Minerals Engineering, 2010, 23: 1073-1100.
[3] MCMOHAN M J L, DAUGULIS A J. Enhancement of biogenic sulphides production in a packed-bed bioreactor via critical inoculum design and carrier material selection[J].Biotechnology and Bioengineering, 2008,100 (5), 855-863.
[4] 陈野. 硫酸盐还原菌腐蚀的影响因素及其防治方法[D].山东:大连理工大学,2004.
[5] DRURY W J. Treatment of acid mine drainage with anaerobic solid substrate reactors[J].Water Environment Research, 1999, 71: 1244-1250.
[6] ALVAREZ M T, CRESPO C, MATTIASSON B. Precipitation of Zn(II), Cu(II) and Pb(II) at bench-scale using biogenic hydrogen sulfide from the utilization of volatile fatty acids[J].Chemosphere,2007,66:1677-1683.
[7] GALLEGOS-GARCIA M, CELIS L B, RANGEL-MÉNDEZ R. Precipitation and recovery of metal sulfides from metal containing acidic wastewater in a sulfidogenic down-flow fluidized bed reactor[J].Biotechnol. Bioeng., 2009,102:91-99.
[8] BAI H J, ZHANG Z M, YANG G E, et al. Bioremediation of cadmium by growing Rhodobacter sphaeroides:Kinetic characteristic and mechanism studies[J].Bioresource Technology, 2008, 99:7716-7722.
[9] 吕琴,陈中云,闵航. 重金属污染对水稻田土壤硫酸盐还原菌种群数量及其活性的影响[J].植物营养与肥料学报, 2005,11(3):399-405.
[10] 范文宏, 姜维, 王宁. 硫酸盐还原菌修复污染土壤过程中镉的地球化学形态分布变化[J].环境科学学报,2008, 28(11): 2291-2298.
[11] kOLMERT A, WIKSTROM P, HALLBERG K B. A fast and simple turbidimetric method for the determination of sulfate in sulfate-reducing bacteria culture[J].Journal of Microbiological Methods, 2000, 41 (3): 179-184.
[12] ZHU X L, DONG L P, LIU J Q, et al. Screening and mutation induction by DBD Plasma of Potassium-solubilizing bacteria[J].Advanced Materials Research, 2014 (884-885):516-521.
[13] 李荣杰. 微生物诱变育种方法研究进展[J].河北农业科学, 2009, 13(10):73-76,78.
[14] FARR S B, KOGOMA T. Oxidative stress responses in Escherichia coli and Salmonella typhimurium[J].Microbiology and Molecular Biology Reviews, 1991, 55:561-585.
[15] MARNETT L J. Oxyradicals and DNA damage[J].Carcinogenesis, 2000, 21:361-370.
(编 辑徐象平)
Screening of sulfur efficient and Cd-tolerant sulfate reducing bacteria by DBD Plasma mutation
ZHU Xiao-li, ZHANG Jian-xia, XU Ya-ya, YAO Qian, LI Meng, DONG Li-Ping
(College of Urban and Environmental Sciences, Northwest University, Xi′an 710127, China)
From Cd-contaminated soil, 35 Sulfate reducing bacteria were separated and purified. The Sulfate reducing activity of these strains were determined using a modified barium Sulfate precipitation method. Three strains were selected by their high Sulfate reducing activities under anaerobic and aerobic environment. The three strains were treated with Dielectric barrier discharge (DBD) plasma mutation. A strain named WK 2-5-2 with high Sulfate reducing activity and ability of Cd-tolerance was selected. WK 2-5-2 could grow well and its number reached up to 4.12×107CFU/ml in liquid medium containing 100mg/l Cd2+.The sulfate reducing activity of WK 2-5-2 was 99.17% and 78.37% under anaerobic and aerobic environment respectively and was increased by 1.49% and 43.88% than its original strain WK 2-5.Then 16S rRNA sequence of the strain was detected and identified asEnterobacterLudwigiiby its 100% sequence homology withEnterobacterLudwigiiEN-119. WK 2-5-2 could be used in bioremediation of Cd-contaminated soil or wastewater.
Sulfate reducing bacteria; Cadmium contaminated soil; dielectric barrier discharge (DBD) plasma mutation
2014-04-11
国家自然科学基金资助项目(31200083);陕西省科技计划基金资助项目(2011JY015);国家科技部惠民基金资助项目(2012GS610203)
朱晓丽,女,陕西西安人,西北大学副教授,从事土壤修复领域的研究。
S151.9+4
:ADOI:10.16152/j.cnki.xdxbzr.2015-02-024
