孤立性纤维瘤的影像学分析
2015-02-15陈建初李子平刘红艳黄奕妆王承光黄海连赖碧玉
陈建初 李子平 刘红艳 黄奕妆 王承光 黄海连 赖碧玉
孤立性纤维瘤(solitary fibrous tumors,SFT)是一种少见的中间性(交界性)梭形细胞间叶肿瘤。发病率较低,多发生于胸膜腔,但近年来胸膜外的孤立性纤维瘤频频报道。SFT在影像上尤其在CT/MR表现上尚缺乏较统一意见的特征性表现,误诊率很高。现收集了经病理证实的10例SFT的影像学资料,分析其影像表现,以提高诊断符合率,报道如下。
1 资料与方法
1.1 一般资料 选择2007年5月~2013年8月在清远市人民医院经手术及病理确诊的10例SFT患者为研究对象,其中男6例,女4例。年龄31~78岁,中位年龄(54.5±23.5)岁。胸膜来源的8例SFT患者中,其中1例表现为症状性低血糖,1例表现为咳嗽伴血丝痰,其余6例无明显临床症状,为其他原因检查发现。2例胸膜外SFT中,1例颈部肿块较明显,另1例表现为胸闷、气促、上腹部胀痛。
1.2 螺旋CT及MR扫描方法 使用GE lightspeed 16层螺旋CT或Toshiba Aquilion one 320层螺旋CT扫描,使用螺旋(容积)扫描。重建层厚7mm,层距7mm,所有患者行MPR重建,层厚及层距为5mm,增强扫描使用自动触发模式,阈值设为180Hu。对比剂使用碘帕醇370或优维显370,肘静脉团注,总量70mL,流速3.0mL/s,45s扫描静脉期。MRI扫描使用GE HDx 3.0T磁共振成像仪。体部相控阵线圈及头颈线圈,体部序列:T1WI、SSFSE、FS-T2WI及LAVA平扫并增强;头颈部序列:T1WI、T2WI、DWI(b=1000)、颈部T1WI、T2WI、IDEAL序列及增强扫描;对比剂为钆喷酸葡胺注射液(Gd-DTPA),0.1~0.2mL/kg,肘静脉团注,速率 2mL/s。
1.3 病理检查 标本经甲醛液固定后,4μm切片,苏木精-伊红(HE)染色,光镜观察。免疫组化项目:Vimentin、CD34、CD99、Bcl-2、CK、S-100、CD68 及 EMA。
2 结果
2.1 胸膜来源的SFT的MSCT表现(见图1) 本组8例胸膜来源的SFT中,5例位于后下胸膜,3例位于侧胸膜,肿块直径5.0~14.5cm。胸部平扫示胸膜腔内团片状软组织密度影,CT值约25~35Hu,肿块常推压邻近肺组织至其含气不全;肿块与正常胸膜间夹角常为钝角,角度大于100°。增强扫描SFT表现为明显不均匀强化,呈“地图样”或“分层样”,CT值约80~95Hu。其中有1例患者有少量胸水。
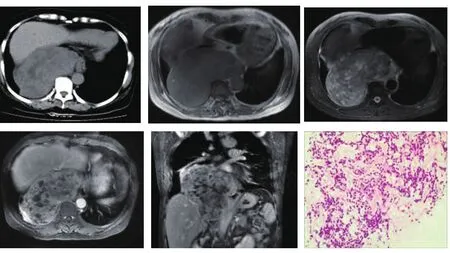
图1 男,78Y,反复低血糖,餐后1h血糖(Glu)9.03mmol/L,胰岛素24.7uU/mL,C肽1.47nmol/L,餐后4H血糖(Glu)骤降至1.5mmol/L,胰岛素0.8uU/mL,C肽0.349nmol/L。CT平扫表现为胸腔内低密度非均质性肿块,左下肺受压含气不全;增强扫描呈地图样强化,镜下细胞排列呈簇状、漩涡状,细胞密集区余疏松区交替出现。免疫组化:CD34(+)、CD99(+)、Bcl-2(+)。(HE 染色,×100 倍)
2.2 胸膜外SFT的CT/MR表现(见图2~3) 本组病例中,1例位于纵隔内,CT平扫表现为巨大软组织肿块,内部可见斑片状低密度灶;MR表现为骑跨胸腹部的巨大肿块,最大径为14cm,T1WI呈低信号,T2WI呈不均质高、稍高信号,增强扫描呈不均匀、较明显强化,病灶轮廓清晰,占位效应明显,大部分位于膈上,局部与膈肌界限不清,右膈肌明显受压下移;向前推压肝实质及下腔静脉,向左内侧心脏与主动脉间隙生长,推压食管、脊椎,椎体略变形。另1例位于头颈部及颅内,右侧后颅窝内可见1个不规则形巨大肿块影,表面凹凸不平,呈多结节状突起,T1WI呈等低信号,T2WI呈高低混信号影,DWI呈等低信号,肿块最大径为15cm。肿块经颅底颈静脉孔、右侧舌下神经管向颈部蔓延,突入右侧咽旁间隙及颈动脉鞘区,肿块边界清楚,周围组织受压推移,咽腔受压变形,右侧腮腺受压向体表隆起,颈动脉受压,明显前移,Gd-DTPA增强扫描明显较均匀强化。

图 2女,58Y,上腹部胀痛 2年,术中见后下纵隔一巨大肿物,大小约18cm×12cm×10cm,质脆,边界不清,与周围组织粘连,侵犯右下肺及食道下段。CT平扫表现为不均质肿块,边界尚清;MR扫描T1WI呈等信号,T2WI呈混杂高信号,增强扫描明显不均匀强化,可见不强化区。镜检见肿瘤组织形态结构多样,部分区细胞丰富,部分区细胞疏松,并可见多灶坏死,瘤组织呈编织状、片状或多结节状排列,瘤细胞短梭形,部分细胞圆形呈上皮样改变,核梭形或卵圆形,局部区域细胞密度明显增加,细胞核大、深染,核分裂像易见(20个/10HPF)。免疫组化:瘤细胞 CD34(+)、CD99(+)、Bcl-2(+),Vimentin(+),Actin[平]弱(+)。(HE染色,×100倍)

图3 女,78Y,颈部肿块。术中发现肿块经颅底颈静脉孔、右侧舌下神经管向颈部蔓延,质地较韧,与周围组织粘连,与后组颅神经、面神经粘连紧密,无法分离。T1WI呈等信号,T2WI呈混杂高信号,增强扫描肿块明显强化,内见不规则低强化区。镜检肿瘤组织主要由梭形细胞构成,可见细胞丰富区及细胞稀疏区,瘤细胞呈短梭形或卵圆形,胞质少。免疫组化:CD34(+)、CD99(+)、Bcl-2(+),Vimentin(+)。(HE 染色,×50 倍)
3 讨论
孤立性纤维瘤(SFT)是一种少见的间叶源性肿瘤[1,3-4],首先由Wagner于1870年报道,Klemperer及Rabin于1931年报道胸膜来源SFT的病理学特点,并将其列为一种独立的疾病。2002年WHO把SFT归类为少见梭形细胞间叶源性肿瘤,可能来源于纤维母细胞,有明显的血管外皮瘤样结构[2]。SFT最初发现于胸膜[3],但近年来越来越多报道[5,7,9-10]SFT发生于胸膜外部位,如肝、前列腺、皮肤、腮腺、甲状腺、膀胱、鼻腔和鼻窦、舌头、脑膜、乳房、纵隔、阴道等。SFT被认为是一种交界性肿瘤,大部分为良性,相当一部分(10%~15%[5],20%~36%[8]、大于 53%[9])发生于胸或胸外不典型或恶性病例已被证实。SFT临床上通常无明显症状,无固定好发年龄,中位年龄约50岁,胸膜腔大多数肿瘤生长缓慢,对周围组织结构以推压为主,当肿瘤较大时,可直接侵犯邻近组织(如:肺及胸壁、肋骨);而胸膜腔外肿瘤被发现时往往较大,常常在肌肉间隙或相对薄弱区域之间生长,形成软组织肿块,推压周围组织。
胸膜腔内SFT表现为缓慢生长无症状肿块,男女比例无特殊,本组病例中有1例表现为症状性低血糖,其余均无特征性的临床表现。某些胸膜外的SFT位置比较表浅,可直接触及,如腹壁、颈部。位置较深的SFT往往体检或邻近组织受累及时才被发现。部分患者可出现症状性低血糖,是由于产生了胰岛素样生长因子[1,8]所致。
在胸部X线片上,较小的SFT表现为宽基底附于胸膜的软组织肿块,边界较清;较大的SFT表现为巨大软组织肿块,邻近肺组织受压含气不全或不张,胸片往往提示肺癌或胸膜恶性肿瘤的诊断。也可表现为类圆形肿块,酷似神经源性肿瘤表现。CT扫描在肿块定位更精准。薄层及MPR重建显示病灶与胸膜的关系,往往表现为宽基底附于胸膜,夹角为钝角,邻近肺组织受压萎陷或不张,但支气管无明显中断表现。CT增强扫描SFT表现为斑片状、地图样强化,强化程度约为45~100Hu,并表现为延迟强化,提示血管非常丰富(见图1)。胸膜来源的SFT极少见纵隔、肺门淋巴结肿大[6]。本组病例中的8例胸膜来源SFT均未见纵隔、肺门、腋窝淋巴结肿大。本组病例中的SFT均发生于侧胸膜及后下胸膜,提示该部位或为好发部位。较小的SFT瘤内常无坏死及出血,较大(大于10cm)常可见不规则坏死灶,均未见出血灶。本组病例中MRI无用于胸膜腔的检查。胸膜来源的SFT需要与胸膜间皮瘤、神经源性肿瘤、支气管肺癌、胸膜转移瘤及胸壁肿瘤鉴别。临床病史有助于鉴别:胸膜间皮瘤有石棉接触史;神经源性肿瘤常伴神经孔的扩大;支气管肺癌表现为恶性肿瘤体质伴有咯血及其他呼吸道症状;转移瘤常有原发肿瘤病史,肺癌最常见。
本组2例患者MRI检查中,SFT均表现为巨大肿块(大于10cm),表现为勾通性或骑跨性生长。T1WI呈等低信号,T2WI呈混杂高信号,DWI呈等低信号(弥散无受限),在相对薄弱间隙(本组病例中为颈动脉鞘周围、心膈角及食道裂孔上)生长,对周围组织推压为主,但这2例SFT均侵犯了邻近组织。MRI增强,2例胸膜外SFT均表现为显著强化,并表现为持续强化。术中可见纵隔SFT(见图2)侵犯了右下肺及食道下段,头颈部SFT(见图3)与后组颅神经、面神经粘连,影像图像上无法分辨。病理提示2例均为恶性SFT,其光镜表现为组织形态结构多样、部分区域细胞疏松,可见多灶性坏死,组织呈编织状、片状或多结节状排列,瘤细胞呈短梭形,细胞密度明显增加,细胞核大、深染,核分裂象易见(大于 20 个/10HPF)。免疫组化:CD34(+),Bcl-2(+),CD99(+),Vimentin(+)。纵隔、头颈部SFT需与神经源性肿瘤[7]鉴别,纵隔SFT还需与纵隔旁的胸膜间皮瘤鉴别。
总之,胸膜SFT常常表现为孤立的软组织肿块,宽基底、界线较清楚、邻近肺组织受推压、富血供,无肺门、纵隔、腋窝淋巴结肿大;胸膜外的SFT表现为巨大软组织肿块,极易误诊为神经源性肿瘤[9-10],在肌间隙或薄弱区域生长,血供丰富,MRI表现为呈长T1、混杂T2信号,DWI肿瘤组织无受限;CT/MR增强扫描动脉期明显强化,并表现为持续强化;均需考虑到SFT可能。病灶大于10cm、强化不均匀(伴坏死)、侵犯周围组织提示恶性可能。CT/MR对SFT能精准定位,明确肿瘤与邻近组织的关系,能较好帮助制定治疗方案和指导手术,确诊需要借助病理学[4,10]检查,免疫组化 CD34(+)、Bcl-2(+)、CD99(+)有助于明确诊断。
[1] 陆洁莉,赵咏桔,王颖,等.胰岛素样生长因子II表达异常与胸膜孤立性纤维瘤致低血糖[J].中华内分泌代谢杂志,2005,21(6):533-534.
[2] Fletcher CDM,Unni KK,mertens F,et al.Pathology and Genetics of Tumors of Soft Tissue and bone[R].World Health Organization Classification of Tumors,Lyon:IARC Press,2002.
[3] 周海榆,陈刚,罗东兰,等.胸膜孤立性纤维瘤的形态学特征分析[J].解剖学研究,2011,33(3):215-218.
[4] 姚海泉,胡智斌,史河水,等.胸内孤立性纤维瘤3例报告并文献复习[J].临床放射学杂志,2012,31(4):602-605.
[5] K.shanbhogue,R.Prasad,Takahashi,et al.Somatic and visceral solitary fibrous tumors in the abdomen and pelvis:cross-sectional imaging spectrum[J].RadioGraphics,2011,31:393-408.
[6] 相世峰,邱乾德.胸膜孤立性纤维性肿瘤的CT表现[J].实用放射学杂志,2008,24(5):617-619.
[7] 舒仁义,叶孟,周浩杰.腹部孤立性纤维瘤的CT、 MRI诊断[J].实用放射学杂志,2012,28:304-305,310.
[8] Ryo Okabe,Makoto Sonobe,Toru Bando,et al.Large solitary fibrous tumor with overexpression of insulin-like growth factor-2[J].Interactive CardioVascular and Thoracic Surgery,2010(11):688-690.
[9] Vallat-Decouvelaere AV, Dry SM, Fletcher CD. Atypical and malignant solitary ibrous tumors in extrathoracic locations:evidence of their comparability to intra-thoracic tumors[J].AmJ Surg Pathol,1998,22(12):1501-1511.
[10] Cranshaw IM,Gikas PD,Fisher C,et al.Clinical outcomes of extrathoracic solitary fibrous tumours[J].Eur J Surg Oncol,2009,35(9):994-998.
