同浓度NaHA 溶液中HA-离子浓度大小比较
2015-02-15李彪
李 彪
(浙江省长兴县太湖高级中学)
近几年高考对于弱酸的酸式盐中离子浓度考查和判断是重点,在高中化学教学中,溶液中离子浓度的大小判断既是教学的重点也是难点,很容易出错。对于相同浓度的NaHCO3和NaHSO3溶液而言,C(HCO3-)和C(HSO3-)的相对大小,是难以判断的,但确有大小之分,从电离或水解两方面同时考虑平衡状态,都难以轻易得出结论,原因在于两者的常数大小无定量的确定关系,若进行复杂的计算能得出两者溶液中的HA-离子浓度,但对学生来说不切实际,操作性也不强。
一、问题提出
在相同浓度中的NaHCO3和NaHSO3溶液中,C(HCO3-)和C(HSO3-)相对大小如何比较?仅从定性方面考虑,似乎难以解决。
原因如下:
对于NaHA 而言,存在如下电离和水解两个平衡:
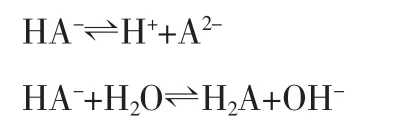
对于具体的NaHCO3和NaHSO3溶液而言,由于电离和水解程度不一样,难以简单地认为以水解为主还是电离为主来思考问题。
我们经常对学生讲NaHSO3溶液显酸性,一般认为以电离为主,其电离常数为K2(亚硫酸)=6.3×10-8。NaHCO3溶液为碱性,一般认为以水解为主,其水解常数为Kh=KW/K1(碳酸)=2.22×10-8
假如以上述常数大小为依据,得出NaHSO3溶液中的C(HSO3-)小于相同浓度的NaHCO3的C(HCO3-)的结论,显然是鲁莽和草率的。
因为这里并没有同时考虑两种溶液中的电离和水解,只是考虑了其中主要的电离和水解,这里也许会出现“误差”,而得到相反的结论。
查有关资料
碳酸的K1=4.30×10-7K2=5.61×10-11
亚硫酸的K1=1.54×l0-2K2=1.02×l0-7
通过纯粹的有关计算得到:0.1mol/L 的NaHCO3中的C(HCO3-)=0.0977666,0.1mol/L 的NaHSO3中的C(HSO3-)=0.0994866。
显然,和以上讨论矛盾。
(以上计算基于Wolfram Mathematica 8 平台,计算方法如下)
附:计算方法
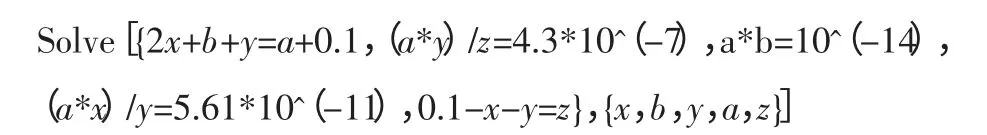
其中设碳酸氢钠为0.1mol/L,x 为碳酸根离子浓度、a 为氢离子浓度、b 为氢氧根离子浓度、钠离子浓度为0.1,碳酸氢根离子浓度为y,碳酸浓度为z。
同样可以计算NaHSO3各粒子浓度大小。
二、分析和解决问题
那么到底应该怎样去比较相同浓度中的NaHCO3和NaHSO3溶液中C(HCO3-)和C(HSO3-)大小。
显然,我们必须同时考虑其电离和水解,但复杂的计算,采用计算机辅助计算也是不现实、不切实际的。
水解的本质是弱酸的阴离子或弱碱的阳离子结合了水电离出来的H+或OH-,在NaHA 溶液中,HA-离子实际上不但可以去结合水电离出来的H+,也可以去结合HA-本身电离出来的H+,由于HA-的电离程度远远大于水的电离常数(在稀溶液中,水的电离常数实际上只有10-14/55.6=1.8×10-16,远远小于一般二元弱酸的二级电离常数,如碳酸的K2=5.61×10-11,两者比较,相差5 个数量级),所以,HA-更“愿意”也更“喜欢”去结合本身电离出来的H+。
故考虑HA-离子的自偶电离更为合理,情景如下:
HA-+HA-⇌H2A+A2-(同时忽略HA-+H2O⇌H2A+OH-的水解平衡)
当我们考虑HA-+HA-=H2A+A2-时,就忽略了水的电离,从误差理论分析上看,以上的处理方式方法是合理的,可信的。
鉴于此,研究NaHCO3和NaHSO3溶液中,C(HCO3-)和C(HSO3-)大小就转变为研究以下转化程度的大小:
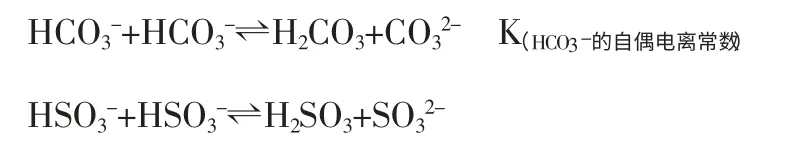
显然K(自偶)=K2/K1,则

比较结果,HCO3-溶液的自偶电离常数大于HSO3-的自偶电离常数,因此相同浓度中的NaHCO3和NaHSO3溶液中,C(HCO3-) 若H2A 的电离常数分别为K1、K2,H2B 的电离常数分别为K1*、K2*, 则对于NaHA 的中的HA-自偶常数为KA=K2/K1,则对于NaHB中的HB-自偶常数为KB=K2*/K1*。 显然: (1)K2×K1*=K1×K2*时,则C(HA-)=C(HB-) (2)K2×K1*>K1×K2*时,则C(HA-)>C(HB-) (3)K2×K1* 当然,对于NaHSO4溶液来说,高中阶段就简单认为HSO4-是完全电离的,大家“公认”C(HSO4-)约为0。 通过代入不同的二元酸的电离常数反复计算其相应的NaHA溶液中的HA-浓度,并实测相应酸式盐溶液的酸碱性,证明其是正确的,以上结论可以用于判断NaHA 溶液中HA-离子浓度的相对大小。 [1]武汉大学.分析化学[M].北京:高等教育出版社,2000:39-41. [2]李俊生.碳酸氢钠溶液在开放体系中离子浓度相对大小的研究[J].河北理科教学研究,2007(03):69. [3]周鲁.物理化学教程.北京:科学出版社,2002.三、讨论和结论
