强直性脊柱炎患者外周血单核细胞TLR2和TLR4表达及其临床价值
2015-02-09王卫远李俊芳李志军王涛
王卫远 李俊芳 李志军 王涛
(1.邯郸市中心医院免疫科,河北 邯郸 056001;2.蚌埠医学院第一附属医院风湿免疫科,安徽 蚌埠 233004)
强直性脊柱炎(Ankylosing spondylitis,AS)是临床免疫科最常见的疾病之一[1-4]。强直性脊柱炎是以脊柱和骶髂部关节及其周围组织炎症为主要症状的自身免疫性疾病[3-6]。流行病学和临床研究发现全球强直性脊柱炎的发病率约为0.07%~0.5%左右[3-6]。目前认为,强直性脊柱炎的发病与遗传、感染等多种因素密切相 关[3-6]。Toll样受体(Toll-like receptor,TLR)属于病原微生物模式识别受体(pattern recognition receptor,PRR)家族[7-10]。目前发现的TLR 包括1到10 共十种,其主要分布于不同的免疫细胞表面[7-10]。近期研究证 实类风湿关节炎(rheumatoid arthritis,RA)等自身免疫性疾病患者外周血单核细胞(peripheral blood monouclear cell,PBMC)表面包括TLR2和TLR4在内的多种TLR 表达均有显著异常[11-13]。故本研究旨在探讨强直性脊柱炎患者与健康患者外周血单核细胞(PBMC)表面的TLR2 和TLR4表达差异及临床意义。
1 对象和方法
1.1 一般资料 根据1984年纽约强直性脊柱炎断诊标准选取2013年10月至2015年1月我院收治的初次诊断为强直性脊柱炎患者40例(AS患者组),及门诊体检的健康患者40 例进行研究(健康对照组)[14]。同时排除患有严重细菌和病毒感染;肝肾功能不全;严重心肺功能不全;其他结蹄组织疾病和血液系统疾病等疾病,以及不愿配合和参加的患者。其中健康对照组40例,男29例,女11例,年龄(44.2±15.1)岁。AS患者组40例,男31例,女9例,年龄(42.2±16.6)岁。两组患者性别和年龄等经统计学处理,差异无显著性,具有可比性(P 均>0.05)。本临床研究经医院伦理委员会批准并经受试者签署知情同意书。
1.2 红细胞沉降率(ESR)在首次就诊时使用红细胞沉降率自动化分析仪检测样本的ESR。
1.3 血浆C-反应蛋白(CRP)在首次就诊时使用免疫比浊法对患者血浆中的CRP水平进行检测。
1.4 外周血单核细胞(PBMC)的采集 在系统治疗前,于晨间采取患者的静脉血5ml。并使用Ficoll Pague PLUS试剂盒(GE Healthcare Life Sciences)分离和纯化患者外周血单核细胞(PBMC)。
1.5 外周血单核细胞(PBMC)TLR2和TLR4mRNA 的检测采 用qPCR 法检测PBMC TLR2 和TLR4mRNA 表达水平。根据试剂盒说明书提取细胞的总RNA 并合成cDNA。并进行荧光定量PCR扩增,反应体系为25μl,使用β-actin作为内参照。引物序列如下:TLR2 正 义5′-GCC AAA GTC TTG ATT GAT TGG-3′,反 义5′-TTG AAG TTC TCC AGC TCC TG-3′;TLR4 正 义5′-TGG ATA CGT TTC CTT ATA AG-3′,反 义5′-GAA ATG GAG GCA CCC CTT C-3′;β-actin:正 义:5′-CCCAG CACAATGA AGATCAAGA TCAT-3′,反 义:5′-ATCTG CTGGAAGGT GGACAGCGA-3′。使 用2-ΔΔCt法对MCP-1和HMGB1mRNA 表达水平进行测定,ΔΔCt =(Ct,目标-Ct,β-actin)AS 患者组-(Ct,目标-Ct,β-actin)健康对照组[15]。
1.6 Western blot法检测PBMC 中TLR2和TLR4蛋白表达水平 按照试剂盒操作要求,首先提取PBMC 中总蛋白,并进行聚丙烯酰胺凝胶电泳(SDSPAGE),然后转移至硝酸纤维素滤膜上,用脱脂奶粉封闭1h,分别加入鼠抗人抗体TLR2(1∶1000)、TLR4(1∶1000)和β-actin(1∶1200),4℃孵育过夜,洗膜后加入相应的辣根过氧化物酶标记的二抗(1∶1000),用ECL进行显色,用凝胶成像分析系统进行扫描。
1.7 统计分析 计量资料以均数±标准差表示。采用SPSS 17.0进行单因素方差分析,两样本均数多重比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 红细胞沉降率(ESR)和血浆C-反应蛋白(CRP)检测 对2组患者红细胞沉降率(ESR)和血浆C-反应蛋白(CRP)检测分析后发现首次诊断未给予系统治疗的AS患者组ESR 和CRP较健康对照组患者显著升高,差异均有显著统计学意义(P 均<0.05),见表1。
表1 患者红细胞沉降率(ESR)和血浆C-反应蛋白(CRP)比较(,n=40)Table 1 Comparison of erythrocyte sedimentation rate and the serum level of C-reaction protein between the two groups

表1 患者红细胞沉降率(ESR)和血浆C-反应蛋白(CRP)比较(,n=40)Table 1 Comparison of erythrocyte sedimentation rate and the serum level of C-reaction protein between the two groups
注:与健康对照组相比较①P<0.05。
2.2 外周血单核细胞(PBMC)TLR2表达水平 对2组患者外周血单核细胞(PBMC)TLR2 mRNA 和蛋白表达水平进行分析后发现。首次诊断未给予系统治疗的AS患者组TLR2 mRNA 和蛋白表达水平较健康对照组患者显著升高,差异均有显著统计学意义(P 均<0.05),见表2和图1。
表2 外周血单核细胞TLR2和TLR4mRNA 和蛋白的表达水平(,n=40)Table 2 The mRNA and protein expression of TLR2and TLR4in PBMC in the two groups

表2 外周血单核细胞TLR2和TLR4mRNA 和蛋白的表达水平(,n=40)Table 2 The mRNA and protein expression of TLR2and TLR4in PBMC in the two groups
注:与健康对照组相比较①P<0.05

图1 TLR2蛋白的表达western blot结果Figure 1 The western blot results of TLR2in the two groups
2.3 外周血单核细胞(PBMC)TLR4表达水平 对2组患者外周血单核细胞(PBMC)TLR4 mRNA 和蛋白表达水平进行分析后发现。首次诊断未给予系统治疗的AS患者组TLR4 mRNA 和蛋白表达水平较健康对照组患者显著升高,差异均有显著统计学意义(P 均<0.05),见表2和图2。
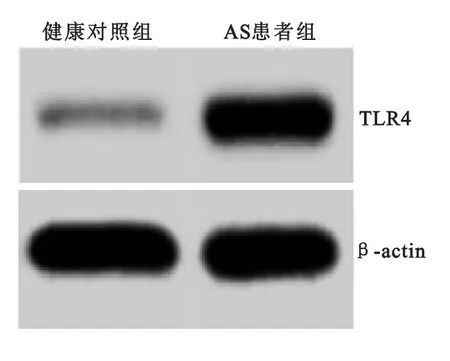
图2 TLR4蛋白的表达western blot结果Figure 2 The western blot results of TLR2in two groups
3 讨论
强直性脊柱炎(Ankylosing spondylitis,AS)作为临床免疫科最常见的疾病之一,其全球发病率为0.07%至0.5%[1-4,16,17]。研究发现强直性脊柱炎是以脊柱和骶髂部关节及其周围组织复发性非特异性炎症反应为主要特点的自身免疫性疾病,其中以男性患者多见,男女比例约为3∶1[1-4,16,17]。大 于3 个月的慢性持续性背部疼痛是强直性脊柱炎最常见的临床表现。同时其他还包括脊柱和骶髂关节晨僵以及脊柱活动度限制等临床症状[1-4,16,17]。目前研究发现大部分的强直性脊柱炎患者存在显著的免疫紊乱。强直性脊柱炎患者HLA-B27阳性率高达90%以上,而普通人群HLA-B27阳性率仅为4%至9%;同时,HLA-B27阳性者强直性脊柱炎患病率约为10%至20%,而普通人群患病率仅为0.1%至0.2%;HLAB27已成为诊断和鉴别诊断强直性脊柱炎的重要指标[18]。
近年来的研究发现TNF-α、IL-1 和IL-6 等炎症介质在强直性脊柱炎、系统性红斑狼疮和类风湿关节炎等自身免疫性疾病的发生和发展过程中扮演着重要的角色[11-13]。TNF-α可以有效促进单核巨噬细胞和中性粒细胞的活化和趋化,导致巨噬细胞等炎症细胞进一步的释放MCP-1等炎症因子,同时还可以导致炎症组织中血管内皮细胞的激活,促进炎症细胞的粘附加重局部的炎症反应[11-13]。目前抗TNF-α治疗如英夫利昔单抗已广泛应用于克罗恩病、类风湿性关节炎(rheumatoid arthritis,RA)以及强直性脊柱炎的临床治疗,并取得了肯定的疗效[19]。同时进一步的研究发现TNF-α、IL-1和IL-6等炎症介质的释放主要受到TLR 信号通路的调控[10,15]。TLR 属于病原 微生物模式识别受体(pattern recognition receptor,PRR)家族,其可以通过与病原体相关分子模式(pathogen-associated molecular patterns,PAMP)结合诱导如NF-κB 和ERK 等下游的信号分子的活化,促进炎症介质的释放以及免疫细胞的激活[10,15]。近年来临床研究也发现TLR 特别是TLR2和TLR4与类风湿性关节炎和莱姆关节炎(lyme arthritis)和骨性关节炎(osteoarthritis)等疾病的发生有密切的联系[20-23]。Ultaigh SN 等的研究证实抗TLR2 治疗可以有效抑制类风湿性关节炎患者滑膜组织TNF-α、IL-1β、IL-6、IFN-γ 和IL-8 等炎症介质的释放,提 示TLR2过度激活和表达在类风湿性关节炎的发生过程中扮演着重要的角色[20]。Lee EY 等的研究发现TLR2的基因多态性与类风湿性关节炎密切相关[21]。同时Menghini R 等的研究显示TLR4/NF-κB信号通路诱导的血管内皮细胞过度活化是导致类风湿性关节关节损伤的重要原因之一[22]。Dhaouadi T 等的研究也发现TLR4 的基因多态性与类风湿性关节炎的发生有密切联系[23]。在本临床研究中我们首先发现强直性脊柱炎患者红细胞沉降率(ESR)和血浆C-反应蛋白(CRP)较对照组明显升高,差异均有显著统计学意义(P 均<0.05)。该结果表明强直性脊柱炎患者全身炎症反应水平处于较高的水平。
同时我们提取患者外周血单核细胞(PBMC)进行分析后发现强直性脊柱炎患者PBMC TLR2和TLR4 mRNA 和蛋白表达水平较健康体检患者显著增加,差异均有显著统计学意义(P 均<0.05)。该结果提示过度表达的TLR2 和TLR4很可能参与了强直性脊柱炎的发生和发展。并有可能是导致强直性脊柱炎患者体内TNF-α、IL-1和IL-6等炎症介质过度释放的重要原因。
4 结论
TLR2和TLR4在强直性脊柱炎患者外周血单核细胞表面的表达水平呈显著性升高,提示TLR2 和TLR4与强直性脊柱炎发病可能存在密切的相关性。同时我们的结果提示TLR2 和TLR4表达水平有作为诊断强直性脊柱炎的潜在价值,但仍需进一步的研究证实。
[1]周溯.补阳还五汤合黄芪桂枝五物汤治疗强直性脊柱炎的疗效观察[J].西部医学,2012,24(11):2192-2194.
[2]瞿晓春.强直性脊柱炎46例X 线CT 诊断分析[J].西部医学,2011,23(04):729-731.
[3]Smith JA.Update on ankylosing spondylitis:current concepts in pathogenesis[J].Curr Allergy Asthma Rep,2015,15(1):489.
[4]朱静,杨南萍.风湿性疾病伴发周围神经病的临床分析[J].西部医学,2006,18(02):171-172.
[5]Sveaas SH,Berg IJ,Provan SA,et al.Circulating levels of inflammatory cytokines and cytokine receptors in patients with ankylosing spondylitis:a cross-sectional comparative study [J].Scand J Rheumatol,2015,44(2):118-124.
[6]Golder V,Schachna L.Ankylosing spondylitis:an update[J].Aust Fam Physician,2013,42(11):780-784.
[7]张伟义,朱涛.脂多糖LPS对糖尿病大鼠肺泡巨噬细胞RBD-2表达的影响[J].西部医学,2011,23(09):1629-1633.
[8]Reuven EM,Fink A,Shai Y.Regulation of innate immune responses by transmembrane interactions:lessons from the TLR family[J].Biochim Biophys Acta,2014,1838(6):1586-1593.
[9]Clark K.Protein kinase networks that limit TLR signaling[J].Biochem Soc Trans,2014,42(1):11-24.
[10]Zhu T,Wang DX,Zhang W,et al.Andrographolide protects against LPS-induced acute lung injury by inactivation of NF-κB[J].PLoS One,2013,8(2):e56407.
[11]Hu F,Li Y,Zheng L,et al.Toll-like receptors expressed by synovial fibroblasts perpetuate Th1and th17cell responses in rheumatoid arthritis[J].PLoS One,2014,9(6):e100266.
[12]de Aquino SG,Abdollahi-Roodsaz S,Koenders MI,et al.Periodontal pathogens directly promote autoimmune experimental arthritis by inducing a TLR2-and IL-1-driven Th17response[J].J Immunol,2014,192(9):4103-4111.
[13]Liu Y,Yin H,Zhao M,et al.TLR2and TLR4in autoimmune diseases:a comprehensive review[J].Clin Rev Allergy Immunol,2014,47(2):136-147.
[14]van der Linden S,Valkenburg HA,Cats A.Evaluation of diagnostic criteria for ankylosing spondylitis.A proposal for modification of the New York criteria[J].Arthritis Rheum,1984,27(4):361-368.
[15]Xiao M,Zhu T,Zhang W,et al.Emodin ameliorates LPS-induced acute lung injury,involving the inactivation of NF-κB in mice[J].Int J Mol Sci,2014,15(11):19355-19368.
[16]Lawrence RC,Felson DT,Helmick CG,et al.Estimates of the Prevalence of Arthritis and Other Rheumatic Conditions in the United States,Part II[J].Arthritis and Rheumatism,2008,58(1):26-35.
[17]Dean LE,Jones GT,MacDonald AG,et al.Global prevalence of ankylosing spondylitis[J].Rheumatology(Oxford),2014,53(4):650-657.
[18]Colbert RA,Tran TM,Layh-Schmitt G.HLA-B27misfolding and ankylosing spondylitis[J].Mol Immunol,2014,57(1):44-51.
[19]Radner H,Aletaha D.Anti-TNF in rheumatoid arthritis:an overview[J].Wien Med Wochenschr,2015,165(1-2):3-9.
[20]Ultaigh SN,Saber TP,McCormick J,et al.Blockade of Tolllike receptor 2prevents spontaneous cytokine release from rheumatoid arthritis ex vivo synovial explant cultures[J].Arthritis Res Ther,2011,13(1):R33.
[21]Lee EY,Yim JJ,Lee HS,et al.Dinucleotide repeat polymorphism in intron II of human Toll-like receptor 2gene and susceptibility to rheumatoid arthritis[J].Int J Immunogenet,2006,33(3):211-215.
[22]Menghini R,Campia U,Tesauro M,et al.Toll-like receptor 4 mediates endothelial cell activation through NF-κB but is not associated with endothelial dysfunction in patients with rheumatoid arthritis[J].PLoS One,2014,9(6):e99053.
[23]Dhaouadi T,Sfar I,Haouami Y,et al.Polymorphisms of Tolllike receptor-4and CD14in systemic lupus erythematosus and rheumatoid arthritis[J].Biomark Res,2013,1(1):20.
