噬菌体33D生物学特性及其潜在抗耐药结核的实验研究*
2015-02-09邬亭亭刘平郭述良罗永艾
邬亭亭 刘平 郭述良 罗永艾
(1.成都市第三人民医院 呼吸内科,四川 成都 610031;2.重庆市长寿区人民医院 呼吸内科,重庆 401220;3.重庆医科大学附属第一医院呼吸内科,重庆 400016)
噬菌体是一种可以裂解细菌的病毒,利用这一特性可以将其应用于抗菌治疗。在抗生素发现并广泛应用之前,研究人员已经开始尝试应用噬菌体防治细菌感染,并取得了大量成果。最近,由于各种耐药性病原菌的出现,以及新型抗生素研发越来越困难,噬菌体治疗细菌感染重新得到人们的重视。目前全球结核病耐药形势严峻,耐多药结核病和泛耐药结核病的出现使患者陷入无药可治的境地。噬菌体治疗其它耐药菌属获得成功[1]的报道提示,可以裂解结核分枝杆菌(Mycobacterium tuberculosis,MTB)的分枝杆菌噬菌体具有治疗结核病的潜在价值。20世纪70年代研究者就利用分枝杆菌噬菌体33D 能够裂MTB的特点对分枝杆菌进行分型[2]。本文通过研究噬菌体33D 基本生物学特征以及与宿主菌之间的作用规律,筛选能裂解耐药MTB的宽噬噬菌体,为分枝杆菌噬菌体鸡尾酒疗法抗耐药结核研究奠定基础。
1 材料与方法
1.1 噬菌体及其宿主菌 噬菌体33D、Legendre、Leo、DNAⅢ、BO4、Sedeg、Clark由加拿大拉瓦尔大学Félix d'Hérelle噬菌体中心提供,噬菌体TM4由美国匹兹堡大学Hatfull教授赠送,噬菌体D29和耻垢分枝杆菌(Mycobacterium smegmatis,MS)mc2155 均由中国食品药品检定研究院王国治教授惠赠,MTB H37Rv由重庆市肺科医院提供,其余分枝杆菌临床株自行从重庆医科大学附属第一医院结核病人痰中分离(2010年5月-2011年4月),比例法检测药敏。所有与分枝杆菌相关的实验均在重庆医科大学附属第一医院生物安全二级实验室进行。
1.2 实验动物 新西兰大耳白兔,雄性,2.0~2.5 kg,由重庆医科大学实验动物中心提供,符合伦理要求。
1.3 主要试剂 7H9培养基(美国BD 公司),7H10培养基(美国BD 公司),罗氏培养基(珠海贝索公司),OADC增菌液(美国sigma公司),福氏完全佐剂(美国sigma公司)。
1.4 噬菌体的培养与噬菌斑观察 采用双层琼脂平板培养法。参照文献[3]的方法,37℃过夜培养,次日即可见长出大量噬斑。
1.5 噬菌体的电镜观察 参照文献[4]中λ噬菌体颗粒提取方法,略加改动,提取噬菌体33D 颗粒。取纯化的33D 颗粒20μl滴于铜网上,待其自然沉淀15 min,用滤纸从侧面吸走多余液体,加1滴20g/L磷钨酸(pH7.0)于铜网上,染色10 min,用滤纸从侧面吸去染液,干燥后用电镜观察20个视野以上。
1.6 最佳感染复数的测定 参照Lu等的方法[5],每个感染复数(muitiplicity of infection,MOI)值做双份复管取平均值,同时以不加噬菌体的宿主菌和不加宿主菌的噬菌体为对照,实验重复3 次,以产生最高噬菌体滴度的MOI为33D 最佳MOI,以噬菌体感染MS 24h后全部宿主菌被裂解的最小MOI为33D 最低MOI。
1.7 一步生长曲线的绘制 参照Lu和weiss等的方法[5,6],略有改动。加入噬菌体33D 及宿主菌MS使MOI=0.1,37℃温育15min后13 000g离心1min,弃上清,7H9液洗涤2次,稀释104倍,用5ml预热的7H9液混悬沉淀并充分混匀,迅速置于37℃大振幅摇床中培养(160r/min),开始计时,于0时刻和每隔15 min取样50μl,13 000g离心1min,吸取上清测定噬菌体滴度,各时间点均作双份复管取平均值,同时以不加噬菌体的宿主菌和不加宿主菌的噬菌体为对照,实验重复3次。最后以感染时间为横坐标,感染体系中噬菌体的滴度为纵坐标,绘制一步生长曲线,得出33D 的潜伏期、爆发期和爆发量。
1.8 噬菌体理化稳定性实验
1.8.1 噬菌体的热稳定性测定实验 将33D 原液稀释至1010pfu/ml,分别于37℃、60℃、70℃保温1h,每隔15min取样,样品立即置入冰浴中冷却,经适当稀释后,测定噬菌体效价。
1.8.2 噬菌体紫外线稳定性实验 将8 ml噬菌体33D 稀释液加至直径7.0cm 的平皿中,暴露于生物安全柜中紫外灯(30w,40cm)下进行照射,在不同处理时间分别取样,经适当稀释后,测定噬菌体效价,并计算噬菌体的存活率。
1.8.3 噬菌体75%酒精稳定性实验 将10μl噬菌体33D 原液加入990μl 75%酒精中,在不同的时间分别取样,经适当稀释后,测定噬菌体效价,并计算噬菌体的存活率。
1.8.4 噬菌体的pH 稳定性测定实验 略有改变。分别取不同pH 值的7H9液4.5ml加入到内径为12 mm 试管中,置于25℃的恒温水浴中,待温度平衡后加入0.5ml的33D 原液,恒温保存1h后,经适当稀释,测定噬菌体效价[7]。噬菌体裂解能力的pH 值稳定性实验 将D29原液按一定比例稀释,吸取10μl稀释液加入到0.2ml对数生长期的宿主菌MS中,混匀,室温放置15min。分别用pH 为5和7.4的双层琼脂平板培养法培养。次日观察不同pH 值的培养板形成噬菌斑的情况。
1.8.5 噬菌体氯仿稳定性实验 将噬菌体D29(滴度:1×109pfu/ml)与等体积氯仿混匀,作用20min后10 000g离心10min,收集上层水相,经适当稀释后,测定噬菌体效价。
1.9 噬菌体宽噬实验 分别以各分枝杆菌临床分离株为宿主菌,用噬菌体33D 进行双层平板噬菌斑实验。将稀释的各宿主菌在双层培养基上分别制成均匀的菌苔。将33D 样液(滴度:1×109pfu/ml)20μl滴加到菌苔上,待液滴干燥后倒置于37℃孵育,6wk后观察结果[3]。
1.10 抗噬菌体血清制备及中和和交叉中和试验1.10.1 33D 抗血清制备 将纯化的33D 噬菌体过滤除菌后加福氏佐剂皮下注射免疫纯种新西兰兔,制备抗血清。每周免疫注射两次,分别于免疫6-8wk后试血。试血以1∶100稀释的抗噬菌体血清能在5min内中和90%以上的噬菌体时,即可心脏采血。
1.1 0.2 血清中和实验 按方法[8]进行血清中和试验并利用公式测定抗噬菌体血清K 值。
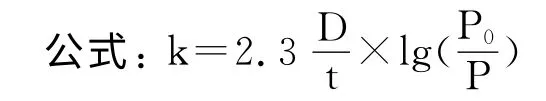
式中P0为未加抗血清时测定的噬菌体滴度,P 为经t分钟后测定的噬菌体滴度,本实验中t=5,D 是抗血清稀释度。
1.1 0.3 血清交叉中和实验 以噬菌体33D 的抗血清分别与D29、Legendre、Leo、DNAⅢ、TM4、BO4、Sedeg、Clark噬菌体进行交叉中和试验,方法同上测定它们的交叉中和反应速率K。
1.11 噬菌体核酸提取与鉴定 噬菌体33D 核酸提取使用λ噬菌体基因组DNA 快速提取试剂盒(北京艾比根生物技术有限公司,中国)。33D DNA 溶解定量后用限制性核酸内切酶HindⅢ、BamHⅢ和EcoRⅠ酶切33D 基因组核酸。根据酶切图谱鉴定其核酸类型。
2 结果
2.1 噬菌体33D 噬菌斑及噬菌体颗粒形态分析
2.1.1 噬菌斑形态分析 噬菌体33D 感染MS所形成的噬菌斑形态(图1-A):噬菌斑形态稳定、均一,直径约为2 mm,圆形透明,边缘清晰,呈现出典型的裂解性噬菌体的噬斑特征。
2.1.2 噬菌体颗粒形态学分析 噬菌体33D 粒子经磷钨酸负染后观察其形态结构(图1-B):噬菌体33D有一个长多面体立体对称的头部,头长径(L)约65nm,头横径(W)约55nm,L/W =1.18,尾长约201nm。

图1 噬菌体33D感染MS所形成的噬菌斑形态(A)及33D 粒子电镜照片(B)Fig.1 Plaques produced by phage 33Dinfecting MS(A)and electron micrograph of 33D(B)
2.2 噬菌体33D 最佳MOI的测定 噬菌体33D 和宿主菌MS培养24h后,加入噬菌体缓冲液2 ml于37℃培养箱孵育1h,收集各平皿上清分别测定噬菌体滴度,结果见表1。可见对于33D M0I为0.000 01时,产生子代噬菌体数量最多,因此噬菌体33D 感染其宿主菌MS 的最佳MOI数为0.000 01;噬菌体和宿主菌培养24h后,噬菌体33D 的M0I分别为l0、1、0.1、0.01和0.001时,培养板均呈完全透明,所有宿主菌被裂解完全,因此噬菌体33D 感染其宿主菌MS最低MOI为0.001。
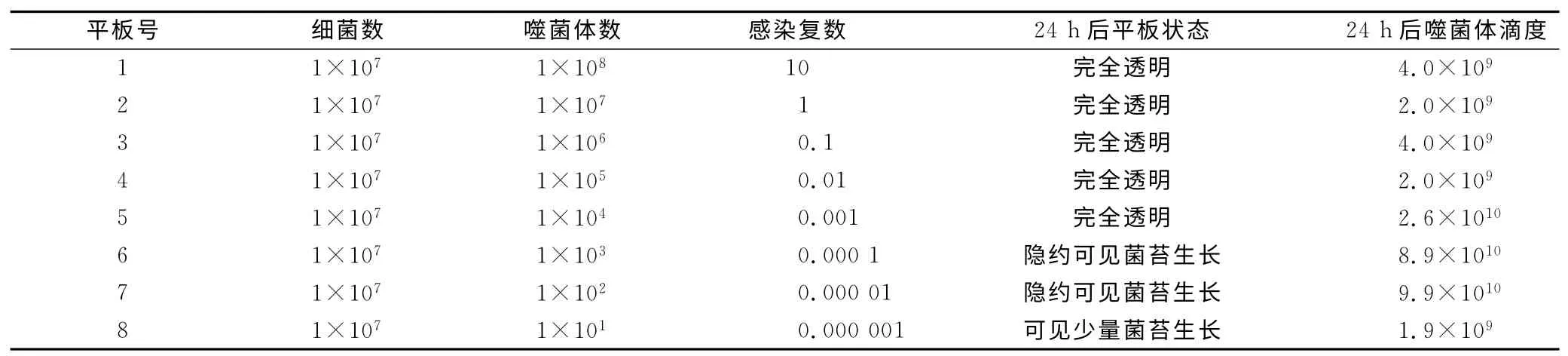
表1 噬菌体33D最佳感染复数的测定Table 1 Determination of optional multiplicity of infection
2.3 噬菌体33D 一步生长曲线 从曲线可以清晰地看出33D 感染宿主菌MS的潜伏时间约为150 min,爆发时间约为120min(图2)。根据裂解量计算公式:裂解量=爆发末期噬菌体滴度/感染初期噬菌体滴度,得出33D 感染宿主菌MS的裂解量为:24。
2.4 噬菌体理化稳定性实验
2.4.1 噬菌体33D 热稳定性实验 图3A 显示噬菌体33D 在37℃条件下非常稳定,随时间延长滴度几乎没有明显变化;60℃处理60 min后33D 的存活率仅为0.5%;70℃处理15min后33D 几乎全部失活。
2.4.2 噬菌体33D 紫外线稳定性实验 在暴露在紫外线下的最初2min内噬菌体33D 绝大多数失活,失活率达99%以上,此后延长照射时间到16 min依然有噬菌体存活。
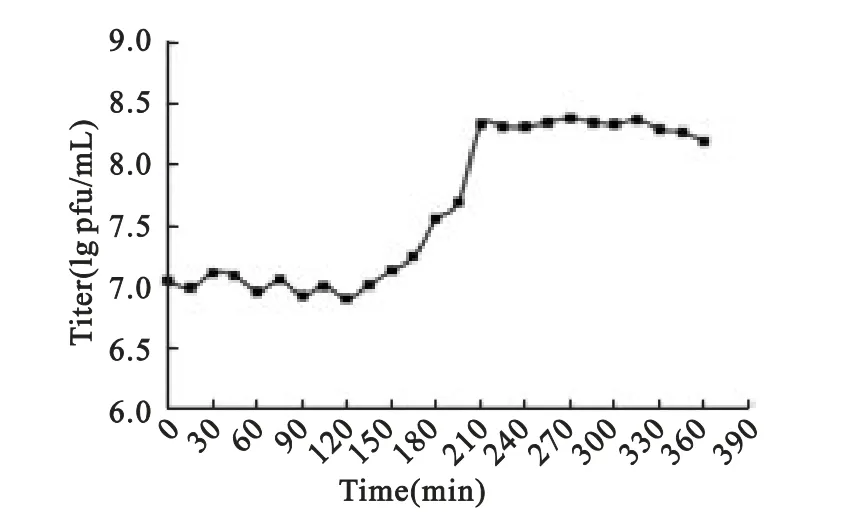
图2 分枝杆菌噬菌体33D一步生长曲线Fig.2 One-step growth curve for phage 33D
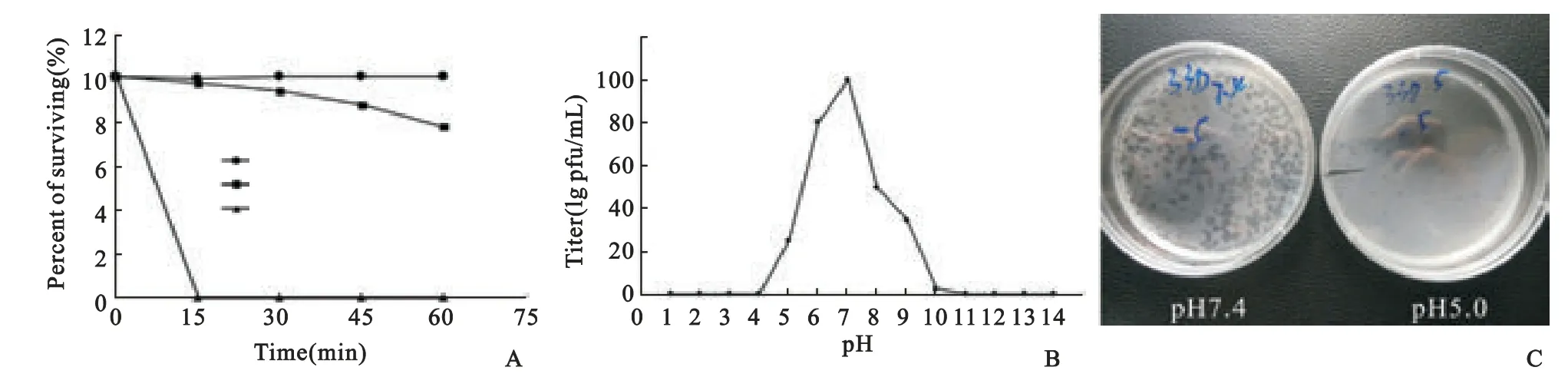
图3 温度(A)、pH 值(B,C)对噬菌体33D活力的影响Fig.3 Effects of temperature(A)and pH(B,C)on livability of phage 33D
2.4.3 噬菌体酒精稳定性实验 噬菌体33D 在75%的酒精中10min全部失活。
2.4.4 噬菌体33DpH 稳定性实验 pH 值对噬菌体33D 稳定性具有显著影响(图3-B):在pH6.0~8.0的范围内33D 的存活率在50%以上,在酸性和碱性环境下33D 的存活率明显降低,pH4.0时和pH11.0时33D 的存活率均小于0.001%。
2.4.5 噬菌体裂解能力的pH 稳定性实验 与pH值为7.4培养基比较pH 值为5 的培养基严重影响33D 裂解宿主菌的能力,但是依然有部分噬菌体能裂解宿主菌(图3-C)。
2.4.6 噬菌体氯仿稳定性试验 用等体积的氯仿处理20min后,噬菌体33D 滴度由处理前的1.1×109pfu/ml降低为1.0×106pfu/ml,99%以上的噬菌体失活。
2.5 噬菌体33D 宽噬实验 采用斑点法分别观察噬菌体33D 与分枝杆菌分离株的宽噬效应(表2),证实33D 除了能裂解mc2155、H37Rv,还能有效裂解分枝杆菌临床分离株,裂解率高达93.8%。噬菌体33D 对耐药MTB的裂解率高达95.65%。噬菌体33D 是宽噬噬菌体,对MTB的噬菌谱广。
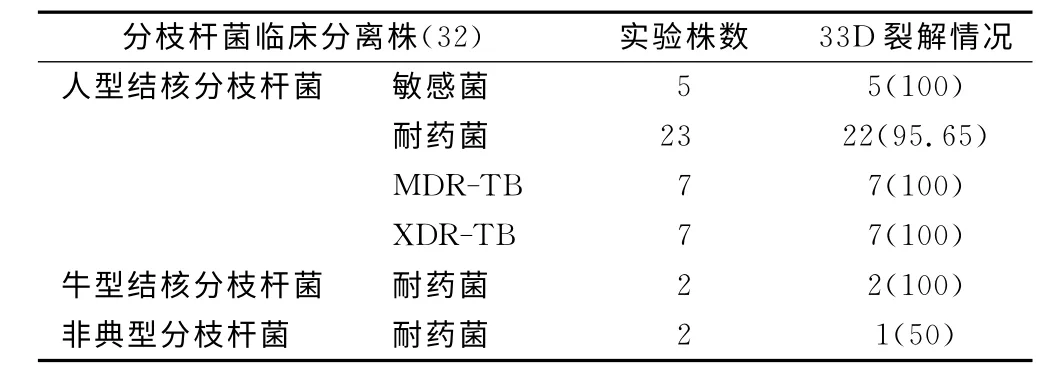
表2 噬菌体33D宽噬实验[n(×10-2)]Table 2 Broad lysing experiment of phage 33D
2.6 吸附常数的测定及交叉吸附常数的测定 将9株噬菌体与33D 的抗血清分别做中和试验和交叉中和试验,将测定结果代入公式得出相应的K 值,见表3。

表3 噬菌体33D抗血清与9株噬菌体的中和实验和交叉中和实验Table 3 Neutralization test and cross neutralization test of phage 33D
从表3中可见,抗33D 血清稀释1000倍后仍能有效中和33D 对宿主菌的吸附与感染(K=703.80),但只稀释10倍时才能中和DNAⅢ,Clark和Leo对宿主菌的吸附与感染,K 值分别是4.65,5.61和4.97;原液才能有效中和Legendre,TM4 和Sedge对宿主菌的吸附与感染,K 值分别为0.47,0.83,0.47;33D 抗血清即使不稀释也无法有效中和BO4和D29对宿主菌的吸附与感染。
2.7 噬菌体33D 基因组特性的研究 用限制性内切酶对噬菌体33D 的基因组进行酶切分析的结果如图4所示。33D 基因组核酸能被BamHⅢ切开,而BamHⅢ为双链DNA 内切酶,表明该基因组为双链DNA。用kDNA/HindⅢ酶切片段作为分子质量标准,结合HindⅢ、BamHⅢ和EcoRⅠ酶切结果,初步测得噬菌体33D 的基因组大小为43.2kb。

图4 噬菌体33D基因组酶切电泳图Fig.4 Electrophoresis of 33Dgenome digested with EcoRⅠwith,HindⅢand BamHⅢ
3 讨论
噬菌体作为一种抗菌剂,具有特异性强、自我增殖快、来源广等一些其它抗菌剂无法比拟的优点[9,10]。国内已有关于分枝杆菌噬菌体D29治疗结核病的报道[11,12],但是D29已被注册专利,且前期研究发现存在分枝杆菌耐D29现象。在本实验中,我们研究33D基本生物学特征以及与宿主菌之间的作用规律,筛选宿主谱宽,与其它分枝杆菌噬菌体无交叉吸附表位的噬菌体,为分枝杆菌噬菌体鸡尾酒疗法抗耐药结核研究奠定基础[2]。
噬菌体分为烈性噬菌体和温和噬菌体。噬菌体33D 形成的透明噬斑具有烈性噬菌体的噬斑特征。烈性噬菌体为天然的杀菌物质。噬菌体33D 尾长约201 nm,依据国际病毒分类委员会2000年颁布的分类标准33D 属于长尾噬菌体科(Siphoviridae),具有长尾的噬菌体能裂解MTB休眠菌。休眠菌是结核病复发和恶化的重要原因[13,14]。33D 有望成为杀灭休眠菌,减少结核病复发的新手段。
MOI是指初始感染时加入噬菌体的数量与宿主菌数量的比值,也称感染倍数。不同的噬菌体具有不同的最佳MOI,本研究测得噬菌体33D 对其宿主菌MS的最低MOI为0.001,33D 对宿主菌MS极度易感[15]。
本实验测得噬菌体33D 感染宿主菌的潜伏期是150min,爆发期为120 min,较以往报道过的铜绿假单胞菌噬菌体PaP3和大肠杆菌噬菌体的一步生长周期长[16,17]。MS增殖速度慢可能是导致其噬菌体潜伏期和爆发期长的原因。理论上噬菌体侵染同一宿主菌时,若吸附快、潜伏期短,则溶菌周期短,因此通常认为潜伏时间短的噬菌体具有较好的临床应用前景。关于噬菌体爆发量对裂解能力的影响目前存在争议,有学者认为爆发量大的噬菌体,会有效地对未裂解细胞进行感染,溶菌效率相应提高,噬菌体表现出较强的裂解能力[15]。爆发量小的噬菌体因其产生较少的子代就能导致宿主菌裂解[16]。因此,其裂解能力较强。但有待进一步研究。
噬菌体33D 对温度,紫外线,酒精均敏感。可用以上方法对噬菌体33D 造成的实验环境和器具污染进行消毒。噬菌体33D 在储存液中最适的pH 值为7,人体血液的PH 值(7.35-7.45)不会影响33D 存活和杀菌活力。虽然在PH 值为5 的环境中33D 裂解宿主菌的能力严重受损,但是依然有部分噬菌体能裂解宿主菌。鉴于人巨噬细胞内吞体和溶酶体的pH 值为5左右[18,19],我们推测33D 有可能具有杀灭胞内菌的潜质。氯仿对噬菌体有很强的杀灭能力,鉴于噬菌体33D 对氯仿敏感,我们有理由推测33D 的衣壳蛋白富含脂质,33D 在制备过程中不能像其他噬菌体一样用氯仿进行抽提[4]。
噬菌体宿主识别的特异性在为微生物的鉴定和分型等方面做出贡献的同时,也给利用噬菌体进行抗菌治疗和环境消毒等制造了麻烦。然而多价噬菌体的发现打破了特异性的束缚,为噬菌体的广泛应用奠定了基础。噬菌体33D 除了能够裂解MS mc2155、MTB H37Rv,对于32 株分枝杆菌临床分离株,33D可以裂解30株,宽噬率高达93.8%。而且33D 还对MDR-TB和XDR-TB株有很强的裂解能力。33D 对耐药MTB的高裂解率,使得33D 对于治疗耐药结核具有很好的临床运用前景。
噬菌体感染宿主的首要步骤是吸附于菌细胞表面,而吸附过程可被相应的抗血清抑制,抗血清K 值的高低与其噬菌体的抗原性密切相关,K 值越高抗原性越强[8]。33D 的K 值 为703.80,比D29 的K 值(1069.50)低,说明33D 抗原性较低,更不易被机体清除。噬菌体33D 的抗血清不能交叉中和我室从国外引进的其余8株分枝杆菌噬菌体,这表明33D 与其余8株噬菌体在血清学上相关很小,它们之间不存在交叉吸附表位。即使9株噬菌体能感染同一宿主菌,它们的吸附表位也不一样,各自通过不同的特异性吸附表位与宿主菌相互作用而感染宿主菌。噬菌体33D可与其他分枝杆菌噬菌体组合作为治疗耐药结核的“噬菌体鸡尾酒疗法”配方。与大多数有尾噬菌体一样,噬菌体33D 的基因组为双链DNA 分子,基因组DNA 大小约为43kb。该基因组的实际大小只有在完成测序之后才能最终确定,而基因组大小的估计是预计测序工作量的重要依据。基因测序将为进一步分析33D 是否含有毒力基因,耐药基因提供依据。
4 结论
33D 尾长201nm,最佳MOI为10-5,感染宿主菌的潜伏期约为150min,裂解量为24;33D 对紫外线、酸碱、酒精、氯仿、温度敏感;33D 能裂解多数分枝杆菌临床耐药株;33D 抗血清反应吸附常数K 值为703.80。33D 属于长尾噬菌体科(siphoviridae),抗原性较低,裂解谱广,具有抗耐药结核潜力。
[1]Harper DR,Enright MC.Bacteriophages for the treatment of Pseudomonas aeruginosa infections [J].J Appl Microbiol,2011,111(1):1-7.
[2]J WD Jr.Differentiation of known strains of BCG from isolates of mycobacterium bovis and Mycobacterium tuberculosis by using mycobacteriophage 33D.J Clin Microbiol,1975,1(4):391-392.
[3]Rybniker J,Kramme S,Small PL.Host range of 14mycobacteriophages in Mycobacterium ulcerans and seven other mycobacteria including Mycobacterium tuberculosis-application for identi?cation and susceptibility testing[J].J Med Microbiol,2006,55(Pt 1):37-42.
[4]萨姆布鲁克J.分子克隆实验指南[M].北京:科学出版社,1996:136-137.
[5]Lu Z,Breidt F J,Fleming H P,et al.Isolation and characterization of a Lactobacillus plantarum bacteriophage phiJL-1,from a cucumber fermentation[J].Int J Food Microbiol,2003,84(2):225-235.
[6]Weiss BD,Capage MA,Kessel M,et al.Isolation and characterization of a generalized transducing phage for Xanthomonas campestris pv.Campestris[J].J Bacteriol,1994,176(11):3354-3359.
[7]邱德全,蔺红苹,谭龙艳.一株副溶血弧菌噬茵体生理特性的研究[J].微生物学通报,2007,34(4)735-739.
[8]余茂,司稺东.噬菌体实验技术[M].北京:科学出版社,1991,27-33.
[9]A lisky J,K Iczkowski,A Rapoport,et al.Bacteriophages show promise as antimicrob-ial agent[J].J Infect,1998,36(1):5-15.
[10]Sulakvelidze A,Alavidze Z,Moms JG Jr.Bacteriophage therapy[J].Antimicrobial Agents and Chemotherapy,2001,45(3):649-659.
[11]Peng Li,Chen Bao-wen,Luo Yong-ai,et al.Effect of mycobacteaiophage to intr-acellular mycobateriainvitro[J].Chin Med J,2006,119(8):692-695.
[12]彭丽.噬菌体D29在结核病诊断和治疗中的应用[D].重庆医科大学博士论文,2006.
[13]Piuri M,Hatfull GF.A peptidoglycan hydrolase motif within the mycobacteriophage TM4tape measure protein promotes efficient infection of stationary phase cells[J].Mol Microbiol,2006,62(6):1569-85.
[14]Ackermann H W.Bacteriophage observations and evolution[J].Res Microbiology,2003,154:245-251.
[15]牛冬燕.应用噬菌体控制牛及其饲养环境中大肠杆菌O157:H7的研究[D].大连理工大学博士论文,2009.
[16]周莹冰,申晓冬,李明,等.铜绿假单胞菌噬菌体PaP3生物学特性的研究[J].解放军医学杂志,2006,31(10):999-1001.
[17]于龙,王洁,赵建军,等.两株大肠杆菌烈性噬菌体的分离与生物学特征研究[J].军事医学科学院院刊,2008,32(5):432-435.
[18]Tycko B,Keith C H,Max field F R.Rapid acidification of endocytic vesicles containing asialoglycoprotein in cells of a human hepatoma line[J].J Cell Biol,1983,97(6):1762-1776.
[19]朴英杰,乔东访,胡雯,等.刀豆素A 诱导巨噬细胞受体介导内吞及溶酶体过程[J].电子显微镜学报,1997,16(3):347-353.
