壮肝逐瘀煎对肝纤维化大鼠血清Fas/FasL表达的影响
2015-02-09林寿宁陈思羽朱永苹
林寿宁,陈思羽,程 臣,朱永苹
(1. 广西中医药大学附属瑞康医院,广西 南宁 530011;2. 广西中医药大学第一附属医院,广西 南宁 530023)
壮肝逐瘀煎对肝纤维化大鼠血清Fas/FasL表达的影响
林寿宁1,陈思羽1,程 臣2,朱永苹1
(1. 广西中医药大学附属瑞康医院,广西 南宁 530011;2. 广西中医药大学第一附属医院,广西 南宁 530023)

目的观察壮肝逐瘀煎对肝纤维化大鼠血清Fas/FasL表达的影响,探讨该组方抗肝纤维化的作用机制。方法将SD大鼠随机分为空白组、模型组和治疗组,除空白组外其余大鼠均采用CCl4复合因素法制作肝纤维化大鼠模型,模型制作成功后,治疗组给予壮肝逐瘀煎灌胃,空白组及模型组仅予等容量生理盐水灌胃。10周末所有大鼠经股静脉采血后处死并获取肝组织,HE染色光镜观察肝组织结构变化,ELISA法测定血清Fas、FasL水平。结果光镜观察空白组肝小叶完整、结构正常,造模组肝纤维化程度明显,治疗组肝纤维化程度较轻;ELISA测定显示治疗组大鼠血清Fas和FasL水平显著低于模型组(P均<0.05)。结论壮肝逐瘀煎可有效治疗大鼠肝纤维化,其作用可能是通过下调Fas、FasL的表达,抑制肝星状细胞凋亡而实现的。
壮肝逐瘀煎;肝纤维化;Fas;FasL;大鼠
近年研究发现,肝星状细胞(HSC)的激活导致了细胞外基质(ECM)的过度沉积,是肝纤维化发生、发展的关键因素[1]。此前实验已证实,壮肝逐瘀煎可以抑制肝纤维化大鼠肝星状细胞的活化及增殖[2]。为了进一步研究壮肝逐瘀煎抗肝纤维化的作用机制,笔者观察了该方对肝纤维化大鼠血清Fas、FasL表达的影响,现将结果报道如下。
1 实验资料
1.1动物与药物 清洁级SD大鼠38只,雌雄各半,体质量220~250 g,由广西食品药品检验所实验动物中心提供[许可证号:SCXK(桂)-2014-0001]。壮肝逐瘀煎免煎颗粒(黄芪20 g、灵芝20 g、当归10 g、绞股蓝20 g、炒鳖甲20 g、地鳖虫10 g、虎杖15 g、田七5 g)由广西中医药大学附属瑞康医院药剂科提供;秋水仙碱购自西双版纳药业有限责任公司(批号:H53021369);四氯化碳(CCl4)购自天津市富宇精细化工有限公司;Fas、FasL酶联免疫试剂盒购自武汉博士德生物公司。
1.2分组与造模 随机取14只大鼠作为空白组,正常饲养。剩余大鼠采用改进的CCl4复合因素法[3]制作大鼠肝纤维化模型,即采用高脂低蛋白食物(以玉米面为饲料,加0.5%胆固醇)饲养,10%乙醇为唯一饮料[11], 第1次皮下注射CCl45 mL/kg,以后每隔3 d皮下注射CCl4油剂(40%棉籽油溶液)[12]3 mL/kg。于第4周末随机处死空白组及造模大鼠各4只,病理检测证实造模大鼠肝纤维化形成。将造模成功大鼠随机分为模型组和治疗组,每组10只。然后治疗组予壮肝逐瘀煎灌胃1次/d,实验剂量相当于成人日用量的40倍,模型组、空白组仅给予等容量生理盐水灌胃。为了防止肝脏自然修复对实验结果的影响,除空白组外,其他2组于造模结束后仍每周注射40%CCl4油剂3 mL/kg 1次。
1.3取材与检测 于用药治疗6 周末,所有大鼠在完成最后一次灌胃后禁食12 h,使用1%戊巴比妥钠皮下麻醉,经股静脉采血,2 000 r/min离心15 min,收集血清,-70 ℃储存待测。血清Fas、FasL水平采用ELISA测定,严格按照试剂盒说明书操作。采血后将大鼠处死,立即剖取肝脏,在每片肝右叶的大致相同部位取一小块肝组织,用10%福尔马林液固定,做常规石蜡切片。肝组织HE 染色后光镜下观察肝组织结构变化。
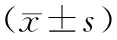
2 结 果
2.1各组大鼠肝脏组织的病理学表现 光镜下,空白组肝小叶完整、结构清晰,细胞以静脉为中心呈条索状向四周放射状排列,见图1。模型组肝小叶结构紊乱,较多粗大胶原纤维分割、包绕肝小叶,肝细胞水肿明显,脂肪变性广泛,部分有坏死,纤维隔内炎性细胞浸润,见图2。治疗组与模型组比较肝小叶结构较清楚,胶原纤维增生较少,纤维疏松变窄,肝细胞水肿及变性不明显,炎细胞浸润较少,见图3。
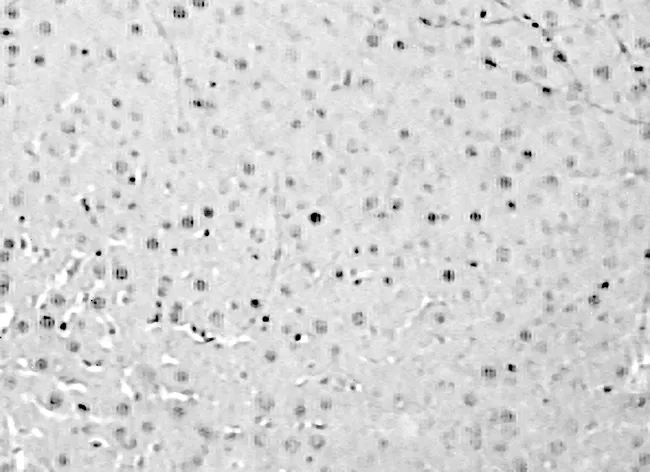
图1 空白组肝脏组织病理学表现(HE,×100)
2.2各组大鼠血清Fas、FasL水平比较 模型组血清Fas、FasL水平明显高于空白组(P均<0.05), 治疗组血清Fas、FasL水平较模型组明显降低(P均<0.05)。见表1。
3 讨 论
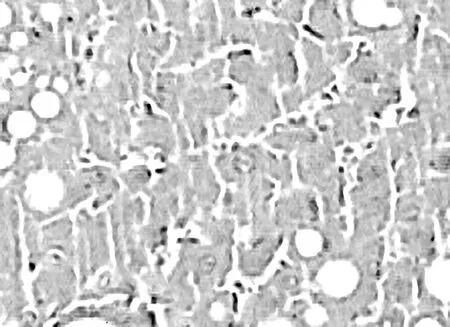
图2 模型组肝脏组织病理学表现(HE,×100)
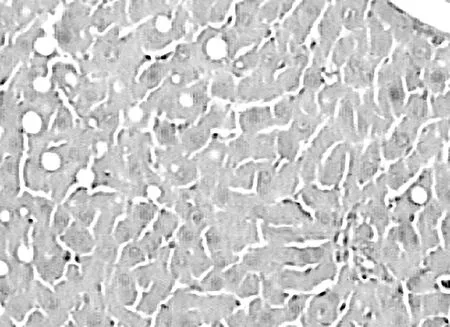
图3 治疗组肝脏组织病理学表现(HE,×100)

表1 各组大鼠血清Fas、FasL水平比较
注:①与对照组比较,P<0.05;②与模型组比较,P<0.05。
肝纤维化是多种慢性肝病病情发展的共同病理基础,是各种致病因素导致肝内弥散性细胞外基质过度沉积的病理过程,其实质是肝细胞外间质的结缔组织增生。肝脏细胞外基质特别是胶原物质过度活化,主要以活化的肝星状细胞转化为肌成纤维细胞样细胞为主。随着病理反应的持续进行,由激活的肝星状细胞转化的肌成纤维细胞样细胞日益增多,致使细胞外基质生成逐渐远超其降解负荷,过多细胞外基质因无力降解而在肝脏内沉积,最终导致肝纤维化形成。在这一过程中,部分肝细胞在损伤因素的作用下死亡而发生变性而释放凋亡小体,肝星状细胞及库否细胞吞噬凋亡小体后可刺激肝星状细胞转化为肌成纤维细胞样细胞,导致胶原生成增加,肝纤维化形成[1]。虽然肝纤维化的形成是多种细胞共同作用下的结果,但激活的肝星状细胞是导致细胞外基质过度沉积的来源[4],是肝纤维化产生与发展的重要因素。
Fas又称Apo-1或CD95分子,与肿瘤坏死因子(TNF)受体和神经生长因子(NGF)受体等皆属于TNF和NGF受体超家族,是一种富含319个氨基酸的死亡受体。FasL又名CD178分子,属于TNF配体超家族,是一种具有三聚体结构的Fas天然配体,可特异性地与Fas相结合。Fas、FasL因子参与了调控细胞凋亡,这一严密而完整的机制包含了一系列的环节及各自相关的信号传导作用[5]。Fas /FasL 结合后,需要Fas 蛋白的胞内区通过其C末端死亡区(DD)与Fas相关的死亡域蛋白(FADD) 结合,而FADD 羟基末端与Fas蛋白的胞内区结合后,其氨基末端则是引起死亡信号转导的必需成分,称为死亡效应(DED)。FADD通过DED 区直接与Caspase-8 结合使后者活化,进一步启动Caspase 级联反应,导致肝细胞凋亡的发生[6]。另一方面,Fas/FasL还可使鞘磷酸酯酶活化,使鞘磷酸分解生成神经酰胺,然后通过丝/苏氨酸蛋白磷酸激酶的作用诱导IP3、DAG等第二信使的活化,使胞内Ca2+/Mg2+值升高,从而激活相关核酸酶,导致DNA断裂和固缩,刺激谷氨酰胺转移酶使胞浆内蛋白分子交联,从而导致细胞凋亡的发生[7]。Gong等[8]研究发现,只有存在于活化肝星状细胞表面的Fas才对FasL敏感,凋亡机制才能启动。可见,探讨Fas/FasL诱导活化的肝星状细胞凋亡是研究抗肝纤维化药物作用机制的重要内容。
壮肝逐瘀煎是基于肝纤维化正虚瘀结的基本病机而设。壮肝之意在于养护肝之阴血为主,兼顾健脾益肾之法。逐瘀之意在于驱除瘀毒之邪,法以活血化瘀、清热解毒为主。方中当归、灵芝以养肝阴益肝血,黄芪以补脾气、扶正气,鳖甲、地鳖虫以活血逐瘀、消除癥瘕,绞股蓝兼以扶正气、解邪毒,田七活血止血,虎杖解毒化湿、活血破结[9]。综观全方,可活血化瘀,清热解毒,同时养肝护阴,健脾益肾,用于肝纤维化切合病机,故本研究治疗组取得了较好疗效。
综上,壮肝逐瘀煎不仅有较好的抗肝纤维化作用,而且能显著降低肝纤维化大鼠血清Fas、FasL水平。通过调控Fas/FasL的表达,抑制肝星状细胞的凋亡可能是壮肝逐瘀煎抗肝纤维化的重要机制。
[1] Guicciardi ME,Gores GJ.Apoptosis:a mechanism of acute and chronic liver injury[J]. Gut,2005,54(7):1024-1033
[2] 黄贵华,林寿宁,王振常. 壮肝逐瘀煎对大鼠肝星状细胞活化的影响[J]. 北京中医药大学学报,2004,27(5):36-38
[3] 韩德五,马学惠,赵元昌. 肝硬化动物模型的研究[J]. 山西医药杂志,1979(4):1-3
[4] Wang LH,Batey TG,George J. Role of ethanol in the regulation of hepatic stellate cell function[J]. World J Gastroenterol,2006,12(43):6926-6932
[5] Sail B,Matthes N,Knittel T,et al. Transform in growth factor β and tumor necrosis factor α inhibit both apoptosis and proliferation of activated rat hepatic stellate cells[J]. Hepatology,1999,30(1):196-202
[6] Fuentes-Prior P,Salvesen GS. The protein structuresthat shape caspase activity,specificity,activation and inhibition[J]. Biochem J,2004,384(Pt2):201
[7] Iwase M,Kondo G,Watanabe H,et al. Regulation of fas-mediated apoptosis in neutrophils after surgery induced acute inflammation[J]. J Surg Res,2006,134(1):114-123
[8] Gong WR,Pecci A,Roth S,et al. Transformation-dependent susceptibility of rat hepatic stellate cells to apoptosis induced by soluble fas ligand[J]. Hepatology,1998,28(2):492-502
[9] 林寿宁. 林沛湘学术经验集[M]. 北京:科学出版社,2012:4-22
Effect of Zhuanggan Zhuyu Decoction on serum Fas/FasL expression in rats with liver fibrosis
LIN Shouning1, CHEN Siyu1, CHENG Chen2, ZHU Yongping1
Objective It is to observe the influence of Zhuanggan Zhuyu Decoction on serum Fas/FasL expression in rats with liver fibrosis, and explore the action mechanism of anti-liver fibrosis. Methods The SD rats were divided into blank group, model group and treatment group, the rats model of liver fibrosis except blank group were established with CCl4 composite factor method. After the models were successfully, the rats were treated with Zhuanggan Zhuyu Decoction by gavage in treatment group, and with same amount of normal saline in the blank group and model group. At the end of the 10th week the blood were collected through the femoral vein in all rats, then the animals were sacrificed to obtain liver tissue, the structural changes in liver tissue were observed by HE staining and light microscope, and the Fas, FasL expression of the blood were detected by ELISA. Results Light microscopy showed that blank group with normal hepatic lobe and complete structure, modle group with significantly liver fibrosis, and treatment group with mild liver fibrosis; ELISA determination results showed that the serum Fas, FasL expression in treatment gorup were singificantly lower than that in model group (allP<0.01). Conclusion Zhuanggan Zhuyu Decoction is effective in the treatment of liver fibrosis in rats, and its mechanism may be through reduce the expression of Fas, FasL, and inhibit hepatic stellate cells apoptosis.
Zhuanggan Zhuyu Decoction; liver fibrosis; Fas; FasL; rat
林寿宁,男,主任医师,主要从事消化系统疾病中医研究工作。
陈思羽,E-mail:yuyushun1124@yahoo.com.cn
国家自然科学基金资助项目(81260533)
10.3969/j.issn.1008-8849.2015.36.002
R-332
A
1008-8849(2015)36-3994-03
2015-03-17
(1. Ruikang Hospital Affiliated to Guangxi University of Chinese Medicine, Nanning 530011, Guangxi, Chian; 2. The First Affiliated Hospital of Guangxi Medical University, Nanning 530023, Guangxi, China)
