乳腺浸润性导管癌组织中p-AKT、VEGF-C的表达及其与侵袭、转移的关系
2015-02-08黄凤德胡晋太岳明全
刘 君,黄凤德,胡晋太,岳明全
(四川绵阳四O四医院,四川 绵阳 621000)
乳腺浸润性导管癌组织中p-AKT、VEGF-C的表达及其与侵袭、转移的关系
刘 君,黄凤德,胡晋太,岳明全
(四川绵阳四O四医院,四川 绵阳 621000)

目的探讨乳腺浸润性导管癌(IDC)组织磷酸化蛋白激酶B(p-AKT)、血管内皮细胞生长因子-C(VEGF-C)表达水平,及其与淋巴结侵袭转移的关系。方法应用免疫组织化学法检测72例乳腺IDC组织及30例乳腺腺瘤组织中p-AKT、VEGF-C的表达水平,分析p-AKT与血管生成的关系。结果乳腺IDC组织中VEGF、p-AKT蛋白的阳性表达率分别为59%和67%,均显著高于乳腺腺瘤组织中20%和17%的阳性表达率(2=13.39,21.21,P<0.05);与有淋巴结转移者比较,无淋巴结转移的乳腺IDC 组织VEGF-C、p-AKT蛋白阳性表达率显著降低(2=11.10,5.51,P<0.05);乳腺IDC组织VEGF-C、p-AKT蛋白表达水平呈显著正相关(r=0.823,P<0.05)。结论乳腺IDC组织中VEGF-C、p-AKT呈过度表达状态,共同参与淋巴结的侵袭与转移,阻断PI3K/AKT通路有望为乳腺IDC的靶向治疗提供一种新的思路。
乳腺浸润性导管癌;血管内皮细胞生长因子-C;磷酸化蛋白激酶B;淋巴结转移
乳腺浸润性导管癌(IDC)是乳腺癌中最常见的病理类型,约占所有乳腺癌的70%。由于乳腺组织富含淋巴管网,早期即可出现淋巴道转移,故与乳腺癌侵袭、转移相关的因子成为近年来研究的重点。血管内皮细胞生长因子-C(VEGF-C)是人类发现的第一种促淋巴管生成因子,参与乳腺癌淋巴结转移的调控[1]。同时研究发现,乳腺癌组织的PI3K/AKT通路存在异常活化[2-3],促进血管生成、肿瘤细胞转移。磷酸化蛋白激酶B(p-AKT)作为是一种原癌基因,其与VEGF-C的异常表达对IDC侵袭、转移的影响研究较少。本实验采用免疫组化法检测乳腺癌组织及乳腺腺瘤组织中p-AKT与VEGF-C蛋白的表达,旨在分析二者与乳腺IDC侵袭转移的相关性。
1 临床资料
1.1一般资料 选择2009年1月—2012年12月在我院接受手术切除的72例IDC患者的乳腺组织作为观察组。患者均为女性,均经手术及组织病理学确诊,排除术前接受放化疗及合并心肝肾等严重器质性疾病者。年龄43~77(53.5±7.1)岁;美国癌症联合委员会(AJCC)分期Ⅰ期15例,Ⅱ期21例,Ⅲ期31例,Ⅳ期5例;肿瘤直径<3 cm 34例,≥3 cm 38例。选择同期收治的30例乳腺腺瘤患者的乳腺组织作为对照组,年龄41~79(51.62±5.9)岁。2组患者基本情况比较差异无统计学意义(P均>0.05)。
1.2检测方法 采用免疫组织化学三步法,将标本组织通过10%甲醛固定、石蜡包埋, 4 μm厚连续切片后进行SP染色。每例标本组织均取相连的3张切片,常规脱蜡、水化、0.01枸橼酸盐缓冲液(pH 6.0)抗原热修复。兔抗人p-AKT多克隆抗体购自美国Cell Signaling生物技术公司,兔抗人VEGF-C免疫组化多克隆抗体、兔免疫组化S-P法试剂盒均购自福州迈新生物技术开发公司,均采用试剂盒已知阳性组织作为阳性对照,以PBS代替一抗体作为阴性对照,染色步骤按产品说明书进行。
1.3判定标准 VEGF-C为细胞质着色,p-AKT为细胞核染色,均呈棕黄色或棕褐色颗粒状分布。分别选择5个有代表性的区域,以高倍镜视野(×400)观察其中10个视野,共计1 000个肿瘤细胞,采用许良中等[5]的计分方法,即无着色计为0分,浅黄色计为1分,棕黄色计为2分,棕褐色计为3分;着色的阳性细胞数百分比≤5%计为0分,6%~25%计为1分,26%~50%计为2分,≥51%计为3分。两项积分乘积≥3分为阳性,否则为阴性。
1.4统计学方法 采用SAS 8.2软件包进行统计分析。计数资料比较采用2检验;计量资料采用表示,组间比较采用t检验,相关性分析采用Spearman秩相关分析。P<0.05视为差异有统计学意义。
2 结 果
2.1VEGF-C和p-AKT蛋白在乳腺IDC及乳腺腺瘤组织中的表达 VEGF阳性表达以细胞质为主,而p-AKT阳性表达则以细胞核为主,尤以肿瘤组织周边部位及坏死区域周围细胞表达较强。乳腺IDC组织中VEGF、p-AKT蛋白的阳性表达率均显著高于乳腺腺瘤组织中的阳性表达率(P均<0.05)。见表1。

表1 VEGF-C和p-AKT蛋白在IDC及乳腺腺瘤组织中的表达比较
2.2淋巴结转移与VEGF-C、p-AKT蛋白表达的关系 与有淋巴结转移者比较,无淋巴结转移者的乳腺IDC组织中VEGF-C、p-AKT蛋白阳性表达率均显著降低(P均<0.05)。见表2。

表2 淋巴结转移与VEGF-C、p-AKT蛋白表达的关系
2.3乳腺IDC组织VEGF-C、p-AKT蛋白表达的相关性分析 经Spearman秩相关分析,乳腺IDC组织VEGF-C、p-AKT蛋白表达水平呈显著正相关(r=0.823,P<0.05)。见表3。
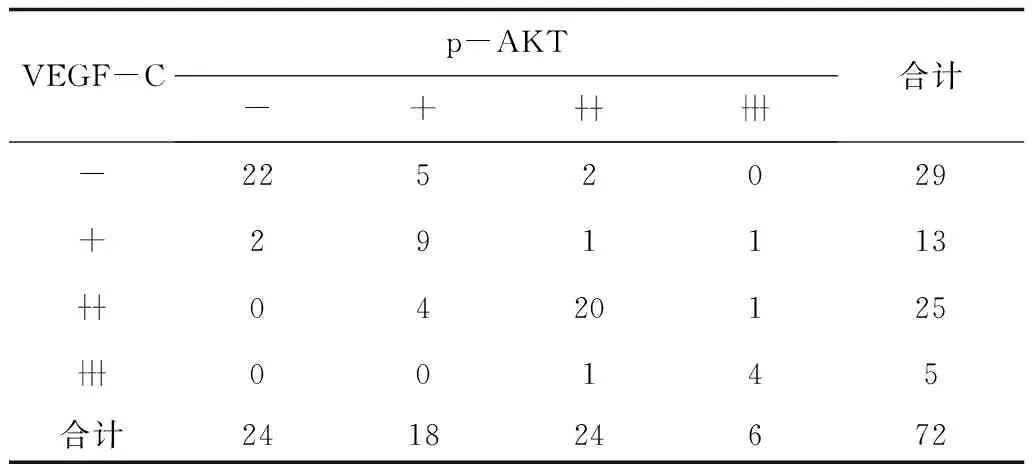
表3 乳腺IDC组织VEGF-C、p-AKT蛋白表达的相关性分析 例
3 讨 论
乳腺IDC是一种涉及多种基因的激活与抑癌基因的失活的基因疾病,基因的突变、缺失与信号蛋白的异常表达在乳腺癌的发生、侵袭转移发挥重要的作用。PI3K/AKT作为调节细胞增殖的重要细胞信号通路,可激活生存信号,保持细胞活性,从而有效控制正常血管生长与肿瘤血管形成[5]。AKT是该通路的关键环节,可被PI3K激活为具有磷酸激酶活性的p-AKT,通过激活或抑制caspase-9、NF-κB、mTOR等下游靶蛋白,发挥抗凋亡作用[6]。VEGF-C是VEGF家族的一员,可诱导淋巴管内皮细胞增殖、迁徙,影响多种肿瘤淋巴管的形成。目前关于p-AKT、VEGF-C的表达与乳腺IDC的相关性鲜有报道,且在IDC中 p-AKT与VEGF-C的关系国内也尚未见报道。
本研究结果显示,乳腺IDC组织中VEGF、p-AKT蛋白的阳性表达率分别为均显著高于乳腺腺瘤组织中的阳性表达率(P<0.05)。而在表达阳性强度方面,趋向于癌强度越强,着色越深。提示VEGF、p-AKT蛋白主要由肿瘤细胞分泌,可作为乳腺IDC的标志物。进一步分析发现,与淋巴结转移比较,无淋巴结转移的乳腺IDC 组织VEGF-C、p-AKT蛋白阳性表达率显著降低(P<0.05)。以上说明VEGF-C、p-AKT表达可促进恶性肿瘤的生长、浸润和转移。其可能机制是VEGF-C、p-AKT通过抑制凋亡使淋巴管增生,管径增加,并增加血管的通透性,加速肿瘤细胞游离进入淋巴结,发生淋巴结转移,并向全身扩张[7]。有研究指出,利用miRNA技术抑制肿瘤细胞VEGF-C、p-AKT表达可减少淋巴结转移率[8]。因此,笔者认为探讨乳腺癌抗淋巴管作用机制及治疗方法将是以后靶向研究的重点。
有研究发现,胃癌细胞经AKT 抑制剂LY294002 处理后,VEGF蛋白的表达显著下降,且胃癌组织中VEGF的高表达与p-AKT密切相关[9]。Mehnert等[10]认为,p-AKT可激活NO合酶诱导新生血管形成,促进VEGF诱导的内皮细胞迁移。但未见对乳腺IDC组织p-AKT和血管生成关系的研究。本研究发现,乳腺IDC组织VEGF-C、p-AKT蛋白表达水平呈显著正相关,说明p-AKT的高表达可能促进了乳腺IDC新生血管的形成。笔者推测,在IDC中可能存在AKT/VEGF通路,一方面促进细胞的增殖,抑制细胞的凋亡;另一方面可增加VEGF-C的表达,导致肿瘤新血管的生成。二者相互协调共同促进乳腺IDC早期发生浸润转移。
总之,乳腺IDC组织中VEGF、p-AKT呈过度表达状态,在淋巴结转移的早期阶段起关键作用,而针对性的阻断PI3K/AKT 通路或者抑制AKT 的活化可能抑制新生血管的生成,从而抑制肿瘤的侵袭和转移,有望为乳腺IDC的治疗提供新的思路。
[1] 栾宁, 王雪峰. VEGF-C与肿瘤转移的研究进展[J]. 现代肿瘤医学,2009,17(9):1805-1807
[2] Tsutsui S,Matsuyama A,Yamamoto M,et al. The Akt expression correlates with the VEGF-A and-C expression as well as the microvessel and lymphatic vessel density in breast cancer[J]. Oncol,2010,23(3):621-630
[3] Goo CK,Lim HY,Ho QS,et al. PTEN/Akt signaling controls mitochondrial respiratory capacity through 4EBP1[J]. PLoS One,2012,7(9):e45806
[4] 许良中,杨文涛. 免疫组化反应结果的判定[J]. 中国癌症杂志,1996,6(4):229-231
[5] Hamada K,Sasaki T,Koni PA,et al. The PTEN/P13K pathway governs normal vascular development and tumor angiogenesis[J]. Genes Dev,2005,19(17):2054-2065
[6] Capodanno A,Camerini A,Orlandini C,et al. Dysregulated PI3K/Akt/PTEN pathway is a marker of a short disease-free survival in node-negative breast carcinoma[J]. Hum Pathol,2009,40:1408-1417
[7] Karar J,Maity A. PI3K/AKT/m TOR pathway in angiogenesis[J]. Front Mol Neurosci,2011,4(51):3389-3392
[8] Ye J,Wu X,Wu D,et al. miRNA-27b targets vascular endothelial growth factor C to inhibit tumor progression and angiogenesis in colorectal cancer[J]. PLoS One,2011,8(4):e60687
[9] KobayashiI,Semba S,Matsuda Y,et al. Significance of AKT phosphorylation on tumor growth and vascular endothelial growth factor expression in human gastriccar cinoma[J]. Patho Biol,2006,73(1):8-13
[10] Mehnert JM,Mc-Carthy MM,Jilaveanu L,et al. Quantitative expression of VEGF, VEGF-R1, VEGF-R2, and VEGF-R3 in melanoma tissue microarrays[J]. Hum Pathol,2010,41(3):375-384
Study on the relation of expression of p-AKT, VEGF-C with the lymph node invasion and metastasis of breast invasive ductal carcinoma
LIU Jun, HUANG Fengde, HU Jintai, YUE Mingquan
(Sichuang Mianyang 404 Hospital, Mianyang 621000, Sichuan, China)
Objective It is to investigate the expression of vascular endothelial growth factor (VEGF), protein kinase B (P-AKT) in breast invasive ductal carcinoma (IDC), and its relation with lymph node invasion and metastasis. Methods The expression of p-AKT, VEGF-C in the tissue of 72 cases of breast IDC and 30 cases of breast fibroadenoma were detected by immunohistochemical staining, the correlation between p-AKT and angiogenesis were analyzed. Results The positive expression rate of p-AKT, VEGF-C protein in breast IDC was 59% and 67% respectively, which was significantly higher than that in breast fibroadenoma of 20% and 17% respectively (2=13.39, 21.21, allP<0.05). The expressions of p-AKT, VEGF-C in breast IDC with lymphnode metastasis were higher than those without lymphnode metastasis (2=11.10, 5.51, allP<0.05). The positive expression rate of VEGF-C had significant positive correlation with that of p-AKT (r=0.823,P<0.05). Conclusion The expression of p-AKT, VEGF-C in breast IDC is over-expressive, and participate the lymphnode invasion and metastasis. Inhibition of PI3K/AKT signal transduction pathway can be expected to provide a new method for the target therapy of breast IDC.
breast invasive ductal carcinoma; vascular endothelial growth factor; protein kinase B; lymphnode metastasis
刘君,女,主治医师,从事乳腺外科临床科研及教学工作。
10.3969/j.issn.1008-8849.2015.27.002
R737.9
A
1008-8849(2015)27-2968-03
2014-06-30
