围生期甲状腺功能减退对新生仔鼠心肌细胞自噬的影响
2015-02-08毛姗姗沈珏邱芸香
毛姗姗 沈珏 邱芸香
围生期甲状腺功能减退对新生仔鼠心肌细胞自噬的影响
毛姗姗 沈珏 邱芸香
目的 探讨心肌细胞自噬在仔鼠围生期甲状腺功能减退(简称甲减)致心功能损害中的作用,并观察左旋甲状腺素(L-T4)替代治疗后自噬指标的改变。方法 SD孕鼠自孕15d起每日予丙基硫氧嘧啶(PTU)50mg/d灌胃至仔鼠出生并持续整个哺乳期,制成围生期甲减模型,出生仔鼠为甲减组,其余孕鼠每日予0.9%氯化钠溶液灌胃,出生仔鼠为对照组,部分甲减仔鼠自出生当日起予以每日腹腔注射L-T4 2μg/100g,为治疗组,收集甲减组、治疗组及对照组(每组8只)出生7d龄仔鼠的心室肌组织,采用Western b lot法测定并比较心肌组织自噬相关蛋白LC3与cathepsin D的表达,同时测定并比较血清甲状腺激素水平及CK-MB、LDH与AST水平。结果 甲减组仔鼠CK-MB、LDH及AST水平均高于对照组(均P<0.01),治疗组仔鼠3者水平均较甲减组下降(均P<0.01);甲减组仔鼠LC3II/LC3I及cathepsin D表达水平均高于对照组(均P<0.01),治疗组仔鼠2者的表达水平均较甲减组降低(均P<0.01)。结论 心肌细胞自噬在围生期甲减诱发新生仔鼠心功能损害中起重要作用。
甲状腺功能减退症 自噬 微管相关蛋白LC3 新生大鼠
围生期甲状腺激素水平对小儿多个器官的发育、代谢和功能调控起着重要作用,近年来有关先天性甲状腺功能减退症(congenital hypothyroidism,CH)对儿童心血管系统的影响逐渐受到关注,我们前期的研究已证实CH新生儿可出现心脏收缩、舒张功能损害,通过早期左旋甲状腺素(L-T4)替代治疗可逆转受损心功能[1-2]。
自噬性程序性细胞死亡(简称自噬)是指细胞在胞内通过溶酶体降解途径消化其自身成分的过程。近年来越来越多的报道证实,自噬参与了多种原因导致心功能损害的过程[3-4]。我们前期的动物实验发现围生期甲状腺功能减退(简称甲减)可通过改变心肌肌浆网相关的钙转运蛋白如Ca2+-ATP酶(SERCA2a)与磷酸受纳蛋白(PLB)等基因转录,以调控新生仔鼠心功能损害的相关机制[5]。目前围生期甲减致心功能损害的具体方式未知,心肌细胞自噬是否参与该过程尚待进一步明确。本实验通过建立围生期甲减及甲状腺素替代治疗新生仔鼠模型,测定自噬相关蛋白如微管相关蛋白LC3与cathepsin D的表达,旨在探讨心肌细胞自噬在围生期甲减诱发心功能损害中的作用以及甲状腺素替代治疗的反应,现报道如下。
1 材料和方法
1.1 实验动物与主要试剂 清洁级SD怀孕大鼠15只,由浙江省医学科学院实验动物中心提供,体重295~ 342g,喂饲普通饲料,自由饮水和进食,自然节律采光。丙基硫氧嘧啶(PTU)由南通精华制药有限公司生产;L-T4由美国Sigma公司生产;游离三碘甲状腺原氨酸(FT3)、游离甲状腺素(FT4)、促甲状腺激素(TSH)试剂盒由美国DPC公司生产,CK-MB、LDH和AST试剂盒由南京建成生物工程研究所生产;自噬相关蛋白兔抗鼠LC3 Ⅰ、LC3 Ⅱ多克隆抗体由美国Abcam公司生产,兔抗鼠cathepsin D单克隆抗体由美国Abcam公司生产,二抗由美国Santa Cruz公司生产。
1.2 方法
1.2.1 动物模型的制备和分组[6]11只SD孕鼠自孕15d起每日予以PTU(50mg/d)灌胃至仔鼠出生并持续整个哺乳期,出生仔鼠51只为甲减仔鼠,采用随机数字表法抽取27只为甲减组;余24只自出生当日起每日腹腔注射L-T4 2μg/100g,为治疗组。另4只孕鼠每日予0.9%氯化钠溶液灌胃,出生仔鼠21只为对照组。甲减组仔鼠及对照组仔鼠同时予以腹腔注射假手术。饲养7d后每组取8只,称体重后断头处死,并立即开胸取出心脏置于冰0.9%氯化钠溶液中,剪去心房、腱索及脂肪组织,并洗净血液,滤纸吸干水分,称心室净重后立即放至液氮中冻存。
1.2.2 血清甲状腺激素、心肌酶谱水平测定 分离各组仔鼠血清,采用天津德普(生物技术和医学产品有限公司生产的IMMULITE全自动化学发光免疫分析仪及配套试剂盒测定血清FT3、FT4和TSH水平。分离各组仔鼠血清,全自动生化分析仪及配套试剂盒测定血清CKMB、LDH和AST水平。
1.2.3 自噬相关蛋白的检测 采用Western blot法检测心肌组织LC3与cathepsin D的表达。取仔鼠心肌组织,4℃冰上组织匀浆裂解后,14 000r/min离心5 min,取上清液后提取大鼠心肌总蛋白,采用Bradford法进行蛋白定量。经SDSPAGE胶电泳分离蛋白、PVDF膜转膜、5%脱脂牛奶封闭、以1∶1 000加入一抗孵育、4℃过夜,经TBST漂洗后37℃二抗孵育1h,Bio-Rad凝胶成像系统成像,用NIH Scion Image软件分析目的蛋白与内参β-actin之比值的相对灰度值,以表示蛋白的相对表达水平。LC3的表达水平用LC3Ⅱ与LC3Ⅰ的比率(LC3Ⅱ/LC3Ⅰ)表示。
1.3 统计学处理 采用GraphPad Prism 6.0统计软件。计量资料以表示,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验。
2 结果
2.1 各组仔鼠血清甲状腺激素水平的比较 见表1。

表1 各组仔鼠血清甲状腺激素水平的比较
由表1可见,甲减组血清FT4水平接近药盒检测底限(2.8pmol/L),低于对照组(P<0.01),血清FT3水平较对照组降低(P<0.01),血清TSH水平较对照组升高(P<0.01);治疗组血清FT4、FT3水平均较甲减组升高(均P<0.01),而血清TSH水平下降(P<0.01);治疗组与对照组比较差异均无统计学意义(均P>0.05)。
2.2 各组仔鼠血清心肌酶谱水平的比较 见表2。
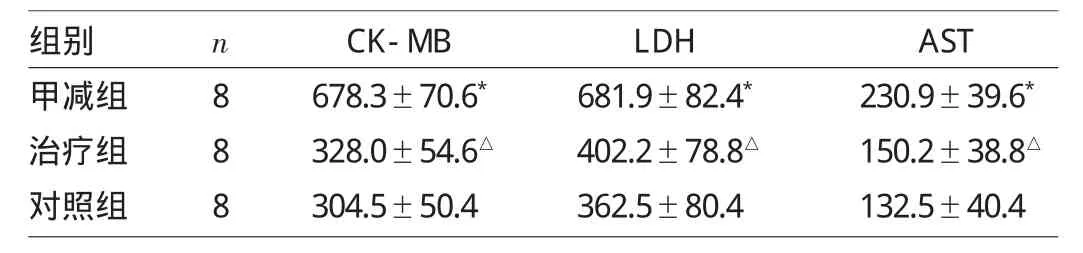
表2 各组仔鼠心肌酶谱水平的比较(U/L)
由表2可见,甲减组血清CK-MB、LDH及AST水平均高于对照组(均P<0.05);治疗组心肌酶谱水平均低于甲减组(均P<0.05);治疗组与对照组比较差异均无统计学意义(均P>0.05)。
2.3 各组仔鼠心肌组织自噬相关蛋白的比较 见表3。

表3 各组仔鼠心肌组织自噬相关蛋白的比较(灰度值)
由表3可见,甲减组仔鼠心肌组织自噬相关蛋白LC3Ⅱ/LC3Ⅰ、cathepsin D均高于对照组(均P<0.01),治疗组仔鼠心肌组织LC3Ⅱ/LC3Ⅰ、cathepsin D较甲减组均降低(均P<0.01),与对照组比较差异均无统计学意义(均P>0.05)。
3 讨论
CH是儿科较常见的一种内分泌疾病,由于其围生期甲状腺激素减少,可对出生患儿的生长和智力发育造成严重影响[7]。围生期甲减是由胎儿甲状腺发育不良或者孕母甲状腺激素缺乏引起,出生患儿即表现为CH。本研究通过孕鼠服用抗甲状腺激素药物PTU制备围生期甲减动物模型,结果发现甲减组仔鼠血清FT3、FT4下降,TSH升高,同时部分出生甲减仔鼠予以L-T4治疗,治疗后仔鼠血清甲状腺激素水平显著上升,替代治疗对恢复甲状腺功能有显著效果,提示模型制备成功。
心脏是甲状腺激素作用的主要靶器官之一,CH患儿在新生儿期即可出现心脏收缩和舒张功能损伤,早期给予甲状腺素替代治疗后受损心功能可得到逆转[1]。本研究结果显示,甲减组新生仔鼠心肌酶谱CK-MB、LDH及AST水平均较对照组显著升高,经早期L-T4治疗后可降至接近正常水平,从而进一步证实围生期甲减所致心功能损害以及早期甲状腺素的有效替代治疗作用。我们之前的研究表明,CH引起以上心功能改变的机制可能与相关钙转运蛋白调控心肌细胞内钙超载相关[5],然而最终导致细胞损伤和细胞死亡的方式尚有待探究。
心肌细胞的功能有赖于在复杂的调控下达到内环境稳定,自噬作为细胞死亡的其中一种调控方式,在维持心肌细胞新陈代谢中起到重要作用。自噬又称自体吞噬,当机体处在病理条件下,如钙超载、缺血缺氧等,细胞可启动自噬以清除受损的线粒体,保证正常细胞的存活,并分解细胞器获得补充能量。然而,大量自噬仍可导致过多的细胞自我消化,造成不可逆的细胞损害与细胞死亡。微管相关蛋白LC3是参与自噬小体膜形成的泛素样调节蛋白,同时也是是哺乳动物细胞中自噬发生的重要标记物。LC3蛋白分为Ⅰ型游离型和Ⅱ型膜结合型,自噬发生时,LC3Ⅰ向LC3Ⅱ型转化,因此LC3Ⅱ/LC3Ⅰ常作为定量分析自噬的重要指标。另一个自噬相关蛋白cathepsin D,也常作为评价细胞自噬激活的程度[8]。cathepsin D是一种水解酶,在溶酶体中降解损坏的蛋白质,参与细胞自噬的过程。我们的研究结果发现围生期甲减新生仔鼠心肌组织LC3Ⅱ/LC3Ⅰ及cathepsin D的表达均显著增强,说明心肌细胞自噬参与围生期甲状腺激素减少致心功能损伤过程。经LT4早期替代治疗后,两者表达均显著下降,提示甲状腺素替代治疗可通过增加甲状腺功能,调控心肌细胞自噬水平,减轻心肌损伤,从而最终改善心功能。结合我们的前期研究,我们推测围生期甲减可下调心肌肌浆网钙转运蛋白活性,造成钙离子转运障碍,导致细胞内钙超载,从而诱导心肌细胞自噬发生。这一系列调控改变可能为CH引起新生儿心脏收缩和舒张功能损害的提供重要分子机制研究。目前,调节该过程的具体分子机制或信号通路尚不清楚,仍需进一步探索,这将是我们下一步研究的方向,为围生期甲减性致心脏损害的病理生理学研究及其预防、治疗方法的改进提供新的思路。
[1] Shanshan Mao,Yanxia Wang,Guoping Jiang,et al.Effects of levothyroxinetherapy on left and right ventricular function in neonates with congenital hypothyroidism:a tissue Doppler echocardiography study[J].Eur J Pediatr,2007,166(12):1261-1265.
[2] ZakiS A,Dolas A.Refractory cardiogenic shock in an infant with congenital hypothyroid ism[J].Indian J Crit Care Med,2012,16(3): 151-153.
[3] Saito T,Sadoshima J.Molecular mechanisms of mitochond rial autophagy/mitophagy in the heart[J].Circ Res,2015,116(8): 1477-1490.
[4] LiS,Wang G,Gao L R,et al.Autophagy is involved in ethanolinduced cardia bifid a during chick cardiogenesis[J].Cell Cycle, 2015,14(20):3306-3317.
[5] 毛姗姗,赵正言.甲状腺功能减退对新生仔鼠心肌肌浆网钙转运蛋白表达的影响[J].中国病理生理杂志,2011,27(4):763-768.
[6] Darbra S,Garau A,Balada F,et al.Perinatal hypothyroidism effects on neuromotor competence,novelty-directed exploratory and anxiety-re lated behaviour and learning in rats[J].Behav Brain Res,2003,143(2):209-215.
[7] Wassner A J,Brown R S.Hypothyroidism in the newborn period [J].Curr Opin Endocrinol Diabetes Obes,2013,20(5):449-454.
[8] Chen L,Li H,Liu W,et al.Olfactom ed in 4 suppresses prostate cancer cell growth and metastasis via negative interaction with cathepsin D and SDF-1[J].Carcinogenesis,2011,32(7):986-994.
Alteration of cardiomyocyte autophagy in neonatal hypothyroid rats
MAO Shanshan,SHEN Jue,QIU Yunxiang.Department of Pediatrics,the Children's Hospital,Zhejiang University School of Medicine,Hangzhou 310003,China
Hypothyroidism Autophagy Microtubule-associated p rotein LC3 Neonatalrat
2014-12-25)
(本文编辑:马雯娜)
浙江省教育厅科研项目(Y201019211);浙江省人口计划生育科研项目(201493583)
310003杭州,浙江大学医学院附属儿童医院儿内科
毛姗姗,E-mail:maoshanshan33@163.com
【 Abstract】 Objective To investigate the alteration of cardiomyocyte autophagy in neonatal hypothyroid rats. Methods Hypothyroidism was induced by gavage of propylthiouracil(PTU,50mg/d)solution from embryonic d15 through the lactational period in pregnant SD rats.The offspring of hypothyroid rats was divided into two groups:in L-T4 treatment group(n=8)the neonatal rats received intraperitoneal injection of levothroxine(L-T4,2μg/100g.d)starting from the day of birth;in hypothyroid group(n=8)the neonatalrats received normal saline instead of L-T4.The offspring of normal pregnant rats served as control group (n=8).Animals were sacrificed at postnatal d 7.Serum thyroid hormone levels and myocadial enzymes CK-MB,LDH and AST were measured;LC3I,LC3II and cathepsin D protein levels were detected by Western blotting. Results Hypothyroid neonatal rats had significant higher myocardial CK-MB,LDH and AST levels than those in control group(P<0.01),while those indicators were significantly decreased in L-T4 treatment group compared to hypothyroid group.Compared with control group,LC3I,LC3IIand cathepsin D p rotein levels were significantly higher(P<0.01)in neonatalhypothyroid group(P<0.01),while L-T4 treatmentg roup showed a significant decrease compared w ith hypothyroid group(P<0.01). Conclusion Cardiomyocyte autophagy may be involved in the pathogenesis ofmyocardialsystolic and diastolic dysfunc tion in hypothyroidism neonatal rats.
