接种土壤微生物对铜胁迫下海州香薷生长及光合生理的影响
2015-02-06李月灵金则新李钧敏郭素民
李月灵, 金则新, 李钧敏, 郭素民, 3, 管 铭
1 上海师范大学生命与环境科学学院, 上海 200234 2 台州学院生态研究所, 台州 318000 3 山西师范大学生命科学学院, 临汾 041004
接种土壤微生物对铜胁迫下海州香薷生长及光合生理的影响
李月灵1, 2, 金则新2,*, 李钧敏2, 郭素民2, 3, 管 铭2
1 上海师范大学生命与环境科学学院, 上海 200234 2 台州学院生态研究所, 台州 318000 3 山西师范大学生命科学学院, 临汾 041004
采用框栽试验方法,模拟Cu胁迫条件下,探讨接种土壤微生物对海州香薷(Elsholtziasplendens)生长和光合生理的影响。结果表明:(1)在Cu胁迫下,海州香薷株数、株高、基径、生物量、茎重比均显著低于对照;与Cu胁迫相比,接种土壤微生物能显著缓解Cu胁迫对海州香薷生长的抑制作用,使植株的株数、株高、生物量、茎重比显著提高。Cu胁迫下,接种土壤微生物均降低了植株体内不同器官Cu含量,茎和叶Cu的累积量显著减少,但对其它器官的Cu含量影响不显著。(2)秋季,各处理的海州香薷的净光合速率(Pn)日变化均呈“单峰”曲线,接种土壤微生物显著提高了Cu胁迫下海州香薷的日均Pn、日均蒸腾速率(Tr),而日均气孔导度(Gs)、日均胞间CO2浓度(Ci)显著降低。(3)Cu胁迫下,接种土壤微生物显著提高了植株的最大净光合速率(Pnmax)、光饱和点(LSP)、表观量子效率(AQY)、最大羧化速率(Vcmax)、最大电子传递速率(Jmax)、磷酸丙糖利用率(TPU),且使光补偿点(LCP)显著降低。表明接种土壤微生物通过提高光能利用率、利用弱光和碳同化能力来增强光合作用能力及有机物的积累,缓解Cu胁迫对海州香薷的毒害。因此,接种土壤微生物可促进Cu胁迫下海州香薷的生长,在重金属污染土壤的植物修复中具有较好的应用潜力。
海州香薷; 土壤微生物; 铜胁迫; 生长; 光合生理
近年来,矿区废弃地等土壤重金属污染日益成为全球环境污染治理的研究热点与难点[1]。我国的重金属尾矿堆存约60—80亿t,且以每年3亿t的数量增加,急需进行生态修复。这些尾矿废弃地保持水肥能力差、重金属浓度过高、营养元素贫瘠、生物不易成活[2]。铜(Cu)作为植物所必需的微量营养元素和许多重要酶、结构蛋白的必要成分,广泛参与植物的各种生理代谢过程。但过量的Cu会对植物产生毒害,在形态上导致植株的存活率和生物量降低、延迟开花和果实成熟时间以及籽粒的发育等,使植物产量下降[3- 4];生理生化方面多表现为损害植物的光合作用[5]、细胞壁代谢[6]、抑制酶活性[7]、造成氧化还原作用失控,影响DNA以及生物膜的完整性[8],最终导致植物退绿、枯萎,甚至死亡。土壤微生物在植物与土壤的相互反馈作用发挥着重要的作用,能响应选择压力而发生快速改变,并进一步反馈影响植物种群[9]。在非生物胁迫方面,一些研究发现很多共生的内生真菌以及根际微生物与植物耐受或抵抗高温、低温、盐渍、干旱等胁迫密切相关[10]。Lau等[11]利用模拟人工进化方法发现土壤微生物可以缓解植物对干旱胁迫的响应,从而改变天然选择对植物种群的影响格局。已有研究表明,丛枝菌根真菌的根内和根外菌丝能产生有机酸、糖蛋白球囊霉素等化学物质,与重金属发生络合反应,帮助宿主植物减少对重金属的吸收[12]。但也有研究发现,本地病原菌的积累可能会抑制优势种后代的生长,从而有利于其它植物幼苗的生长固定[13]。事实上,微生物广泛分布于重金属污染土壤中,有些微生物具有很强的重金属耐受性。这些微生物可通过产生有机配体、释放代谢分子(有机酸、Fe载体)[14- 15]、分泌生长激素(IAA)[16]、促进土壤P、K的可溶性[17- 18]和合成某些酶(ACC脱氢酶)[19]等直接或间接在植物生长生理和对重金属的吸收发挥作用。
海州香薷(Elsholtziasplendens)为唇形科(Labiatae)香薷属(Elsholtzia)一年生草本植物,又名“铜草花”、“铜草”,为常见的Cu矿指示植物[20]。海州香薷野生资源十分丰富,广泛分布于长江中下游地区。其不仅全草入药,有一定的药用价值,而且具有广布性、适应性强、易繁殖等特点[21],是一种有潜力的菌根修复植物[22- 23]。目前对微生物调控海州香薷耐性机制已有报道,主要涉及金属硫蛋白的分泌[20]、促进营养物质的吸收[18]、改变根际微环境[24]等方面。有关灭菌土壤中接种单一或是若干菌株对海州香薷的影响及其机制已有较多的研究,但对接种野外土壤微生物对海州香薷生长和光合生理的影响未见报道。
本研究以无污染区植物海州香薷为材料,分析Cu胁迫下接种野外土壤微生物对海州香薷生长和光合生理参数的影响,试图阐明:(1)Cu胁迫对海州香薷的影响如何?(2)灭菌条件下接种土壤微生物对海州香薷的生长和光合生理影响如何?(3)接种土壤微生物如何改变由Cu胁迫所引起的海州香薷生长和生理响应?以期了解土壤微生物对海州香薷适应重金属胁迫的调节机制,为重金属污染地区的生物修复提供理论依据。
1 材料与方法
1.1 试验材料
供试植物海州香薷种子采自湖北红安县无污染地区(31°30.632′N、114°32.620′E),海拔118 m。野外接种土壤采自湖北阳新县赤马山铜矿(29°59.776′N、115°05.856′E),海拔138 m。取样后立刻将采集的土壤过1 mm筛,以除去土壤中的植物残体、根系、土壤动物及碎石杂质等因素的影响。选取50 cm×40 cm×30 cm的塑料框,内装32.5 kg土壤(干重),供试土壤经过121 ℃灭菌2 h后的基质(黑土∶砂石∶蛭石=6∶3∶1)。供试土壤的基本理化性质见表1。

表1 土壤基本理化性质Table 1 The basic physical and chemical characteristics of soils
1.2 试验设计与处理
试验采用双因素完全随机设计,接种与不接种土壤微生物以及添加与不添加Cu两因素两水平,共4个处理,每个处理6个重复,构建24个试验单元,分别为对照(CK)、添加Cu(Cu胁迫)、接种土壤微生物(SM)、添加Cu+接种土壤微生物(Cu+SM),在温室中随机摆放。土壤微生物接种参考Lau和Lennon[11]和Nie等[25]方法,于2012年5月上旬,采用5%(体积比)野外采集的土壤于95%基质(黑土∶砂石∶蛭石=6∶3∶1)中,混匀后待用;以添加等体积经121 ℃灭菌2 h后的土壤作为不接种土壤微生物处理。接种土壤微生物后进行重金属处理,采用添加CuSO4溶液至浓度1000 mg/kg土壤,以添加等体积的无菌水作为不添加重金属处理。于2012年5月上旬对种子进行杀菌处理后放在48孔穴盘中于温室中萌发,待植物幼苗长出6叶苗龄时,取相似大小的幼苗进行移栽。于2012年6月下旬将幼苗随机栽入基质中,每隔4 cm栽种1株,每个塑料框内共100株,所有植株按常规管理,保持水肥一致,于智能玻璃温室中继续培养。温室培养条件:白天相对湿度为(70±10.5)%,晚上为(57±7.2)%,白天温度为(30.0±5) ℃,夜间为(18.0±2) ℃,自然光照条件。
1.3 测定指标和方法1.3.1 土壤基本理化性质
按土壤农化常规分析法测定[26]。
1.3.2 形态及生物量测定
于2012年12月中旬植株衰老期,每个处理随机选择30个植株,用直尺测每个植物株高,基径测定部位为高于土面2 cm处,每株用游标卡尺交叉测定2次。
植物染毒处理176 d后,统计每个处理植株的存活率,将植株的地上和地下部分分开,用去离子水冲洗干净,之后,将各部分分别放入纸袋中,于105 ℃杀青20 min,在80 ℃下烘干至恒重,每框为一个重复,共6个重复。由于此时叶已脱落,每个处理中仅测定根、茎、花序生物量,计算其干重和茎重比、根重比等参数。
1.3.3 重金属含量测定
将烘干至恒重的每个处理海州香薷根、茎、叶(收集掉落框内的部分叶片)、花序及种子各个部分用粉碎机充分研磨混匀。准确称取0.25 g粉碎样品于消煮管中,用HNO3∶H2O2=3∶1在MARS 240/50 微波消解仪中消解,待完全消解后,蒸发去酸,用双蒸水定容至50 mL。采用电感耦合等离子体发射光谱仪(Perkin Elmer Optima 2100DV, USA)测定Cu含量,每个处理5个重复。
1.3.4 光合参数测定
光合参数于2012年11月上旬进行测定,选择晴朗的天气,利用Li- 6400XT便携式光合作用测定系统(Li-Cor, USA)测定海州香薷叶片的光合指标,从8:00—16:00每2 h测定1次。每个处理随机选取3框,每框测定3株,每株取从上往下的第3对功能叶,取平均值,共3个重复。测定时选取长势相近的健康植株和充分伸展、无病虫害的健康叶。测定参数包括:净光合速率(Pn, μmol m-2s-1)、气孔导度(Gs, mmol m-2s-1)、胞间CO2浓度(Ci, μmol/mol)、蒸腾速率(Tr, mmol m-2s-1)等。
利用Li- 6400XT便携式光合作用测定系统测定植株的光合-光响应曲线。每个处理随机选取3框,每框测定3株,取平均值,共3个重复。使用人工光源进行光诱导和光响应测定,诱导光强约为2000 μmol m-2s-1,诱导时间约为15—30 min。光响应测定条件控制:设置叶室温度为25 ℃,以小钢瓶内液态CO2为气源,设置CO2浓度条件为400 μmol/mol,相对湿度为60%—70%。测定时设置光强梯度由高到低为2000、1500、1200、1000、800、600、400、200、150、100、50、20和0 μmol m-2s-1。
利用Li- 6400XT便携式光合作用测定系统的红蓝光源设定叶室中以接近叶片饱和光强为测定光强1500 μmol m-2s-1,控制条件与光响应相同,以小钢瓶内液态CO2为气源,设置CO2浓度梯度从1500、1200、1000、800、600、400、200、150、120、100、80、50 μmol/mol,每个CO2梯度最大等待时间为300 s。每个处理选取3框,每框测定3株,取平均值,共3个重复。由于海州香薷叶片较小不能完全填满叶室,用扫描仪(Epson 1680)与分析软件(WinFOLIA叶片分析系统)测量出叶片的实际面积,然后将实测叶面积手动输入光合软件重新计算获得光合参数特征值。
1.4 数据分析
光合-光响应曲线采用新型的指数方程拟合[27],表达式如下:
式中α、β、γ为3个与光强无关的系数;P(I)为净光合速率,I为光合有效辐射(μmol m-2s-1),Ic为光补偿点(μmol m-2s-1)。通过该模型利用SPSS非线性回归,得到相应预测值Pv,绘制PAR-Pv曲线,计算出最大净光合速率(Pnmax, μmol m-2s-1)、表观量子效率(AQY, μmol/mol)、光饱和点(LSP, μmol m-2s-1)、光补偿点(LCP, μmol m-2s-1)及暗呼吸速率(Rd, μmol m-2s-1)等光合参数。
光合-CO2响应曲线根据非直角曲线模型拟合,同时用Photosyn Assistant 1.1.2软件对CO2响应曲线进行生化模型拟合,根据Farquhar等[28]、Long和Bernacchi[29]修正后生化模型,计算得到最大羧化速率(Vcmax, μmol m-2s-1)、最大电子传递速率(Jmax, μmol m-2s-1)、磷酸丙糖利用率(TPU, μmol m-2s-1)。
用SPSS 16.0对实验数据进行统计分析,采用单因素方差分析(One-way ANOVA)和LSD多重比较分析4个处理之间单因子对各项指标的差异。用双因素方差分析(Two-way ANOVA)检验添加Cu和接种土壤微生物的交互作用对海州香薷各参数的差异显著性,显著性检验水平均设置为0.05。采用Excell和Origin 7.5对所测数据进行整理和绘图。
2 结果与分析2.1 接种土壤微生物对Cu胁迫下海州香薷生长的影响
Cu胁迫显著抑制了海州香薷植株的生长(图1)。与对照相比,Cu胁迫处理显著降低了植株的株数、株高和基径,分别减少了31.5%、18.1%、12.5%。接种土壤微生物显著提高了海州香薷的株数和株高,与对照相比分别增加了16.4%、13.5%,但对基径的影响不显著。与Cu胁迫相比,胁迫下接种土壤微生物显著提高了植株的株数和株高,分别增加了20%、16.4%。
双因素方差分析结果表明,Cu胁迫处理对海州香薷的株数(F=153.600,P<0.001)、株高(F=24.724,P=0.001)和基径(F=7.680,P=0.024)的影响均达极显著水平,接种土壤微生物处理仅对株高(F=13.729,P=0.006)和株数(F=32.670,P<0.001)有极显著性影响,Cu胁迫和接种土壤微生物的交互作用对各指标均无显著影响。

图1 接种土壤微生物对Cu胁迫下海州香薷生长的影响
2.2 接种土壤微生物对Cu胁迫下海州香薷生物量的影响
不同处理对海州香薷影响的生物量指标见表2。Cu胁迫处理显著降低了植株的根、茎、花序生物量、单株生物量、总生物量以及茎重比,与对照相比分别下降了33.0%、38.5%、34.1%、20.5%、36.5%和9.6%。接种土壤微生物使植株的根、茎、花序生物量、单株生物量、总生物量、茎重比较对照分别增加了22.1%、40.8%、11.4%、11.6%、31.7%和7.0%。而接种土壤微生物使Cu胁迫下植株的根、茎、花序生物量、单株生物量、总生物量、茎重比相对胁迫下显著增加,分别提高了32.2%、38.1%、39.9%、16.7%、37.1%和6.7%。
双因素方差分析结果表明,Cu胁迫处理、接种土壤微生物处理对植株的根、茎、花序生物量、单株生物量、总生物量、茎重比均有极显著性影响,而对根重比没有显著性影响。接种土壤微生物和Cu胁迫交互作用对各个生物量指标均未达显著水平。

表2 接种土壤微生物对Cu胁迫下海州香薷生物量的影响Table 2 Effects of soil microbe inoculation on the biomass of E. splendens under copper stress
2.3 接种土壤微生物对Cu胁迫下海州香薷体内Cu含量分布的影响
由表3可知,海州香薷各部位的Cu含量分布差异变化幅度较大。添加Cu处理中,植物Cu含量在器官含量分别为:根>叶>茎>花序;而在未添加Cu处理中,海州香薷地上部Cu含量均处于正常植物Cu含量范围内(5—20 mg/kg)。与对照相比,Cu胁迫下海州香薷植株各部位的Cu含量均显著增加,其中根、叶、茎、种子分别提高了31.5倍、30.6倍、7.0倍、14.0倍。与对照相比,接种土壤微生物对海州香薷各部分差异不显著。接种土壤微生物显著降低了植株地上部分Cu含量,叶和茎Cu含量分别比Cu胁迫处理降低了50.3%、35.1%,而其对根部含量的差异不显著。
双因素方差分析结果表明,Cu胁迫处理对植株各个器官Cu含量分布均有极显著性影响,接种土壤微生物处理对植株的茎和叶达到极显著水平,而Cu胁迫和接种土壤微生物交互作用对海州香薷的根、茎、叶也有显著性影响。

表3 接种土壤微生物对Cu胁迫下海州香薷体内Cu含量分布的影响Table 3 Effects of soil microbe inoculation on heavy metal contents of E. splendens under copper stress
2.4 接种土壤微生物对Cu胁迫下海州香薷光合作用参数的影响
由图2可看出,不同处理海州香薷的净光合速率(Pn)日变化均呈“单峰型”曲线,且峰值均出现在12:00左右,分别为6.19、4.37、3.80、3.03 μmol m-2s-1。添加Cu处理,在各时间段植株的Pn均显著低于对照;除16:00外,其它时间段接种土壤微生物的Pn均显著高于对照。各处理之间植株的日均Pn值表现为SM>CK>Cu+SM>Cu。双因素方差分析结果表明,接种土壤微生物以及添加Cu处理对植株的日均Pn作用均极显著,但两者的交互作用未达到显著影响。

图2 接种土壤微生物对Cu胁迫下海州香薷叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)日变化的影响
海州香薷的气孔导度(Gs)和蒸腾速率(Tr)的日变化曲线与其Pn日变化基本相似,呈“单峰型”,且峰值均出现在12:00左右(图2)。单一接种土壤微生物后,植株的Gs和Tr在各个时间段显著高于其它3个处理。各处理之间植株的日均Gs值大小顺序为SM>CK>Cu>Cu+SM,而日均Tr为SM>CK>Cu+SM>Cu。双因素方差分析结果表明,接种土壤微生物以及添加Cu处理对植株的日均Gs和日均Tr均达到极显著影响,且两者的交互作用均作用极显著。
各个处理的海州香薷胞间CO2浓度(Ci)日变化见图2,其变化规律与Pn日变化相反,呈“V型”曲线。添加Cu处理的Ci在各个时间段均显著高于对照。各处理之间植株的日均Ci值表现为Cu>SM>Cu+SM>CK。双因素方差分析结果表明,接种土壤微生物以及添加Cu处理对植株的日均Ci均作用显著,且两者的交互作用也达到极显著影响。
2.5 接种土壤微生物对Cu胁迫下海州香薷光合-光响应参数的影响
从海州香薷叶片光合-光响应曲线可以看出(图3),总体上各处理之间曲线变化很相似。随着光合有效辐射的增强,Pn均呈先增加后趋向稳定。
表5为不同处理下海州香薷光合-光响应特征值。Cu胁迫下海州香薷最大净光合速率(Pnmax)、光饱和点(LSP)、表观量子效率(AQY)、暗呼吸速率(Rd)分别比对照下降了57.0%、7.0%、30.6%、18.7%,而光补偿点(LCP)提高了16.1%。而接种土壤微生物条件下Pnmax、LSP、AQY、Rd均有不同程度的提高,与对照相比分别增加了2.8%、19.9%、41.9%、11.1%,而LCP则减少了22.5%。与Cu胁迫相比,胁迫下接种土壤微生物使植株的Pnmax、AQY显著增加,分别提高了84.7%、31.7%,而LCP则下降26.6%,差异显著。

表4 接种土壤微生物对Cu胁迫下海州香薷光合作用参数日均值的影响Table 4 Effects of soil microbe inoculation on the daily mean value of photosynthetic parameters of E. splendens under copper stress

表5 接种土壤微生物对Cu胁迫下海州香薷光合-光响应特征参数的影响Table 5 Effects of soil microbe inoculation on the light response parameters of E. splendens under copper stress
双因素方差分析结果表明,Cu胁迫、接种土壤微生物处理对海州香薷光合-光响应指标均影响显著,而Cu胁迫和接种土壤微生物交互作用仅对Pnmax、LSP影响显著。
2.6 接种土壤微生物对Cu胁迫下海州香薷光合- CO2响应参数的影响
海州香薷叶片的光合- CO2响应如图4所示,植物叶片的Pn均随着胞间CO2浓度的增加而增加。0—200 μmol/mol范围内,4种处理下植株叶片的Pn上升的幅度较小,随着胞间CO2浓度的增加,Pn增加速度上升,几乎呈线性增长。当达到CO2饱和点后,Pn开始趋于稳定。当CO2浓度大于200 μmol/mol时,Pn曲线的大小顺序为:SM>CK>Cu+SM>Cu。
Cu胁迫处理显著降低了植株的CO2响应参数,与对照相比最大羧化速率(Vcmax)、最大电子传递速率(Jmax)、磷酸丙糖利用率(TPU)分别减少了49.9%、46.5%、41.5%。接种土壤微生物使植株的Vcmax、Jmax、TPU较对照分别增加了18.5%、17.6%、19.5%。与Cu胁迫相比,胁迫下接种土壤微生物显著提高了植株的Vcmax、Jmax、TPU,分别增加了47.7%、46.6%、48.3%。
Cu胁迫处理、接种土壤微生物处理对海州香薷光合-CO2响应指标均影响极显著,而Cu胁迫和接种土壤微生物交互作用各个指标均未达到显著影响。
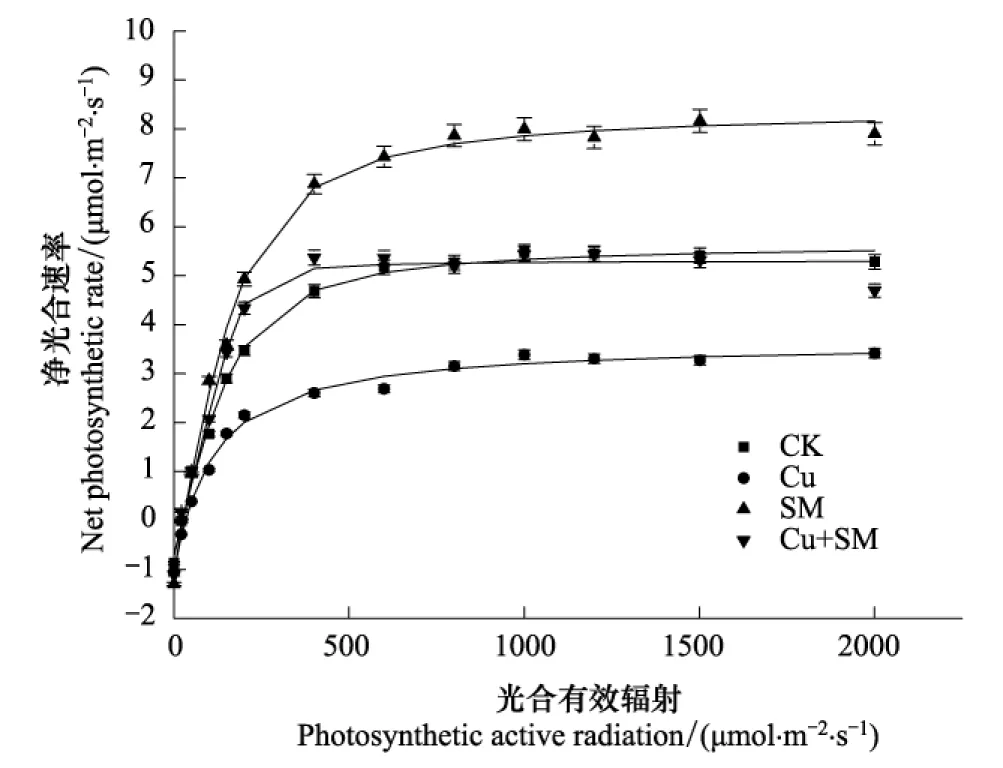
图3 接种土壤微生物对Cu胁迫下海州香薷光合-光响应曲线的影响

图4 接种土壤微生物对Cu胁迫下海州香薷光合-CO2响应曲线的影响Fig.4 Effects of soil microbe inoculation on the net photosynthetic rate-intercellular CO2 concentration curves of E. splendens under copper stress图中数据为平均值±标准误,同列数据不同小写字母表示差异显著(P<0.05, n=3)

表6 接种土壤微生物对Cu胁迫下海州香薷光合-CO2响应参数的影响Table 6 Effects of soil microbe inoculation on the CO2 response parameters of E. splendens under copper stress
3 讨论
在环境胁迫下,植物会通过改变其形态和生理特性以及生活史对策来适应环境的资源限制[30]。本研究发现,不同处理对海州香薷的生物量有较大的影响,Cu胁迫下海州香薷株高、基径、株数、生物量均显著低于对照,但根生物量的减小程度低于茎生物量,根重比略有增加,这可能是重金属影响了植物对水分和营养物质的正常吸收,作为补偿植株根系获得较多的生长,根重比的增加可以在根系中积累相对较多的重金属,有助于缓解对地上部分的毒害作用[24]。接种土壤微生物对Cu胁迫下植株的株高、株数和各器官生物量均有促进作用,有效地缓解了Cu胁迫导致的植株茎、根生物量的下降程度,茎重比增加较快。说明Cu胁迫下海州香薷接种土壤微生物后植物根际微环境发生改变,提高了植株的存活率,有利于海州香薷光合产物的积累,促进了茎、根的生长,其中对茎的促生作用更大。
当Cu在植物体内达到一定程度时,它会破坏叶绿体的结构与功能,使光合色素降解,影响光合作用电子传递链和PSⅡ光反应,导致光合器官结构受损以及光合作用系统等生理生化过程发生紊乱,最终使植物光合产物减少、生长受到限制[31- 32]。Cambrollé等[33]对Cu耐受性植物Limoniastrummonopetalum研究发现,过量的Cu浓度显著降低了净光合速率(Pn)、气孔导度(Gs)和叶绿素含量,并对光系统光产生了不可恢复的损伤,但对胞间CO2浓度(Ci)没有显著影响。朱光灿等[34]研究结果表明,低温胁迫下接种丛枝菌根真菌使玉米(Zeamays)叶片的Pn、蒸腾速率(Tr)、Gs显著增强,而Ci低于非菌根植株。本研究中,海州香薷有着相似的光合生理响应,与Cu胁迫相比,胁迫下接种土壤微生物显著提高了海州香薷日均Pn的和日均Tr,而日均Gs、日均Ci则下降。因为光合作用是酶促反应,Cu在叶肉细胞过量的积累会导致参与光合作用的相关酶活性降低,降低了叶肉细胞的光合能力,使CO2的同化利用率降低。接种土壤微生物后,降低了植株对Cu的吸收和向地上部位转运,使根系细胞壁上固定的Cu含量下降,同时减少了地上部位Cu含量,从而减轻过多Cu对胞质生理生化代谢伤害,使得叶肉细胞的光合能力有一定提高,即内部Rubisco酶活性和光合构件等非气孔因素的改善,有利于胞间CO2原料的利用,使植株的光合速率加快。
光饱和点(LSP)与光补偿点(LCP)是反映植物对强光和弱光利用能力的指标。一般植物的LSP与LCP均较低是典型的阴性植物,反之为阳性植物[35]。非胁迫条件下海州香薷的LSP大于1500 μmol m-2s-1,为阳性植物。Cu胁迫往往能降低植物的最大净光合速率(Pnmax)、LSP,增加LCP[36]。Shi等[37]甜菜(Betavulgaris)的生长和光合效率研究发现,接种Acinetobacterjohnsonii细菌可有效促进植株LSP、表观量子效率(AQY)的提高,且LCP显著降低。本研究中,单一接种土壤微生物处理显著增加了海州香薷的LSP,而Cu胁迫下接种土壤微生物使LCP显著下降。说明接种土壤微生物使得海州香薷对光能利用范围变宽,增加了其对光环境的适应能力,尤其是Cu胁迫下植株对弱光利用的能力提高,从而增加了叶片对光能利用率以及Pn。AQY反映了植物光合作用对光的利用效率[38],4个处理中Cu胁迫下植株的AQY显著低于对照,而接种土壤微生物显著提高了胁迫下海州香薷的AQY,表明接种土壤微生物条件下,海州香薷捕获光量子用于光合器官的能力得到了提高。且Cu胁迫下接种土壤微生物植株的Pnmax显著增加,而暗呼吸速率(Rd)却偏低,这时植株产生的光合产物较高,而对光合产物消耗较低,有助于植株在不利环境条件下更多的物质积累。说明土壤微生物通过提高Pnmax、AQY和降低LCP等途径来改善海州香薷的光合作用,使植株在胁迫条件下的光合能力得到提升。
CO2是植物进行光合作用的基本底物,其浓度大小影响着植物的光合速率。最大羧化效率(Vcmax)的大小主要受到核酮糖- 1,5-二磷酸羧化酶(Rubisco)的活性、数量的影响,而Rubisco是植物光合作用固定CO2的关键调控酶,反映了植物对CO2的利用能力[39]。最大电子传递速率(Jmax)为RuBP再生的电子传递速率,代表着RuBP再生能力。对高丹草(Sorghum×S.sudanes)和紫花苜蓿(Medicagosativa)不同浓度Cu处理的水培试验结果显示,Cu胁迫导致Gs、Vcmax、Jmax、磷酸丙糖利用率(TPU)值的下降,最终导致净光合速率降低[40]。本实验中,Cu胁迫处理,海州香薷叶片的Vcmax、Jmax、TPU值显著降低,但胁迫下接种土壤微生物显著增加了植株Vcmax、Jmax、TPU值。说明植株在光合作用过程中催化RuBP固定CO2的Rubisco的活性和数量明显增加,较高的电子传递速率促进了光合磷酸化作用和NADPH的合成,从而使RuBP再生能力得到了提高,这些特性有利于它们充分利用光能进行碳同化。
综上所述,在Cu胁迫下海州香薷植株的生长、生物量均受到了一定程度的抑制。接种土壤微生物有效缓解了Cu胁迫对海州香薷植株的抑制作用,可通过提高植株的存活率,降低光补偿点和增加表观量子效率、最大羧化速率、最大电子传递速率、磷酸丙糖利用率,从而减轻Cu对胞质生理生化代谢过程的伤害,提高植株的光合能力,促进植株的株高的生长,最终提高海州香薷耐受Cu胁迫的能力。
[1] Li J M, Jin Z X, Gu Q P. Effect of plant species on the function and structure of the bacterial community in the rhizosphere of lead-zinc mine tailings in Zhejiang, China. Canadian Journal of Microbiology, 2011, 57(7): 569- 577.
[2] 沈章军, 孙庆业, 田胜尼. 铜尾矿自然定居白茅对体内氮磷的适时分配及叶片氮磷代谢调节酶活性动态. 植物生态学报, 2012, 36(2): 159- 168.
[3] Kovácˇik J, Klejdus B, Hedbavny′ J, Bacˇkor M. Effect of copper and salicylic acid on phenolic metabolites and free amino acids inScenedesmusquadricauda(Chlorophyceae). Plant Science, 2010, 178(3): 307- 311.
[4] Brun L A, Le Corff J, Maillet J. Effects of elevated soil copper on phenology, growth and reproduction of five ruderal plant species. Environmental Pollution, 2003, 122(3): 361- 368.
[5] Vinit-Dunand F, Epron D, Alaoui-Sossé B, Badot P M. Effects of copper on growth and on photosynthesis of mature and expanding leaves in cucumber plants. Plant Science, 2002, 163(1): 53- 58.
[6] Bhakuni G, Dube B K, Sinha P, Chatterjee C. Copper stress affects metabolism and reproductive yield of chickpea. Journal of Plant Nutrition, 2009, 32(4): 703- 711.
[7] Lombardi L, Sebastiani L. Copper toxicity inPrunuscerasifera: growth and antioxidant enzymes responses ofinvitrogrown plants. Plant Science, 2005, 168(3): 797- 802.
[8] Andre C M, Larondelle Y, Evers D. Dietary antioxidants and oxidative stress from a human and plant perspective: a review. Current Nutrition and Food Science, 2010, 6(1): 2- 12.
[9] Lambers H, Mougel C, Jaillard B, Hinsinger P. Plant-microbe-soil interactions in the rhizosphere: an evolutionary perspective. Plant and Soil, 2009, 321(1/2): 83- 115.
[10] Rodriguez R J, Henson J, Van Volkenburgh E, Hoy M, Wright L, Beckwith F, Kim Y O, Redman R S. Stress tolerance in plants via habitat-adapted symbiosis. The ISME Journal, 2008, 2(4): 404- 416.
[11] Lau J A, Lennon J T. Evolutionary ecology of plant-microbe interactions: soil microbial structure alters selection on plant traits. New Phytologist, 2010, 192(1): 215- 224.
[12] Khan A G. Role of soil microbes in the rhizospheres of plants growing on trace metal contaminated soils in phytoremediation. Journal of Trace Elements in Medicine and Biology, 2005, 18(4): 355- 364.
[13] Hyatt L A, Rosenberg M S, Howard T G, Bole G, Fang W, Anastasia J, Brown K, Grella R, Hinman K, Krkudziel J P, Gurevitch J. The distance dependence prediction of the Janzen-Connell hypothesis: a meta-analysis. Oikos, 2003, 103(3): 590- 602.
[14] Hallberg K B, Johnson D B. Microbiology of a wetland ecosystem constructed to remediate mine drainage from a heavy metal mine. Science of the Total Environment, 2005, 338(1/2): 53- 66.
[15] Burd G I, Dixon D G, Glick B R. Plant growth-promoting bacteria that decrease heavy metal toxicity in plants. Canadian Journal of Microbiology, 2000, 46(3): 237- 245.
[16] Patten C L, Glick B R. Role ofPseudomonasputidaindoleacetic acid in development of the host plant root system. Applied and Environmental Microbiology, 2002, 68(8): 3795- 3801.
[17] 罗巧玉, 王晓娟, 林双双, 李媛媛, 孙莉, 金樑. AM真菌对重金属污染土壤生物修复的应用与机理. 生态学报, 2013, 33(13): 3898- 3906.
[18] Wang F Y, Lin X G, Yin R, Wu L H. Effects of arbuscular mycorrhizal inoculation on the growth ofElsholtziasplendensandZeamaysand the activities of phosphatase and urease in a multi-metal-contaminated soil under unsterilized conditions. Applied Soil Ecology, 2006, 31(1/2): 110- 119.
[19] Glick B R, Cheng Z Y, Czarny J, Duan J. Promotion of plant growth by ACC deaminase-producing soil bacteria. European Journal of Plant Pathology, 2007, 119(3): 329- 339.
[20] Qian M, Li X D, Shen Z G. Adaptive copper tolerance inElsholtziahaichowensisinvolves production of Cu-induced thiol peptides. Plant Growth Regulation, 2005, 47(1): 65- 73.
[21] 中国科学院中国植物志编辑委员会. 中国植物志. 北京: 科学出版社, 1977, 66: 342- 343.
[22] Ke W S, Xiong Z T, Chen S J, Wang Z H. Differences of Cu accumulation and Cu-induced ATPase activity in roots of two populations ofElsholtziahaichowensisSun. Environmental Toxicology, 2008, 23(2): 193- 199.
[23] Yang R Y, Zan S T, Tang J J, Chen X, Zhang Q. Variation in community structure of arbuscular mycorrhizal fungi associated with a Cu tolerant plant-Elsholtziasplendens. Applied Soil Ecology, 2010, 44(3): 191- 197.
[24] 骆永明. 重金属污染土壤的香薷植物修复研究. 北京: 科学出版社, 2012: 14- 99.
[25] Nie M, Wang Y J, Yu J Y, Xiao M, Jiang L F, Yang J, Fang C M, Chen J K, Li B. Understanding plant-microbe interactions for phytoremediation of petroleum-polluted soil. PLoS One, 2011, 6(3): 17961.
[26] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 1999: 24- 214.
[27] Ye Z P. A new model for relationship between irradiance and the rate of photosynthesis inOryzasativa. Photosynthetica, 2007, 45(4): 637- 640.
[28] Farquhar G D, von Caemmerer S, Berry J A. A biochemical model of photosynthetic CO2assimilation in leaves of C3species. Planta, 1980, 149(1): 78- 90.
[29] Long S P, Bernacchi C J. Gas exchange measurements, what can they tell us about the underlying limitations to photosynthesis? Procedures and sources of error. Journal of Experimental Botany, 2003, 54(392): 2393- 2401.
[30] Coomes D A, Grubb P J. Colonization, tolerance, competition and seed-size variation within functional groups. Trends in Ecology and Evolution, 2003, 18(6): 283- 291.
[31] Mallick N, Mohn F H. Use of chlorophyll fluorescence in metal-stress research: a case study with the green microalgaScenedesmus. Ecotoxicology and Environmental Safety, 2003, 55(1): 64- 69.
[32] Perales-Vela H V, González-Moreno S, Montes-Horcasitas C, Caňizares-Villanueva R O. Growth, photosynthetic and respiratory responses to sub-lethal copper concentrations inScenedesmusincrassatulus(Chlorophyceae). Chemosphere, 2007, 67(11): 2274- 2281.
[33] Cambrollé J, Mancilla-Leytón J M, Muoz-Vallés S, Figueroa-Luque E, Luque T, Figueroa M E. Effects of copper sulfate on growth and physiological responses ofLimoniastrummonopetalum. Environmental Science and Pollution Research International, 2013, 20(12): pp8839- 8847.
[34] 朱先灿, 宋凤斌, 徐洪文. 低温胁迫下丛枝菌根真菌对玉米光合特性的影响. 应用生态学报, 2010, 21(2): 470- 475.
[35] 蒋高明, 常杰, 高玉葆, 李永庚. 植物生理生态学. 北京: 高等教育出版社, 2004: 65- 66.
[36] 朱喜峰, 邹定辉, 简建波, 陈伟洲, 刘慧慧, 杜虹. 龙须菜对重金属铜胁迫的生理响应. 应用生态学报, 2009, 20(6): 1438- 1444.
[37] Shi Y W, Luo K, Li C. Growth and photosynthetic efficiency promotion of sugar beet (BetavulgarisL.) by endophytic bacteria. Photosynthesis Research, 2010, 105(1): 5- 13.
[38] 徐兴利, 金则新, 何维明, 王兴龙, 车秀霞. 不同增温处理对夏蜡梅光合特性和叶绿素荧光参数的影响. 生态学报, 2012, 32(20): 6343- 6353.
[39] Ichikawa K, Miyake C, Iwano M, Sekine M, Shinmyo A, Kato K. Ribulose 1,5-bisphosphate carboxylase/oxygenase large subunit translation is regulated in a small subunit-independent manner in the expanded leaves of tobacco. Plant and Cell Physiology, 2008, 49(2): 214- 225.
[40] 王瑞刚, 唐世荣, 郭军康, 赵玉杰, 宋正国. 铜胁迫对高丹草和紫花苜蓿生长和光合特性的影响. 生态环境学报, 2010, 19(12): 2922- 2928.
Effects of soil microbe inoculation on the growth and photosynthetic physiology ofElsholtziasplendensunder copper stress
LI Yueling1, 2, JIN Zexin2,*, LI Junmin2, GUO Sumin2, 3, GUAN Ming2
1SchoolofLifeandEnvironmentScience,ShanghaiNormalUniversity,Shanghai200234,China2InstituteofEcology,TaizhouUniversity,Taizhou318000,China3SchoolofLifeSciences,ShanxiNormalUniversity,Linfen041004,China
Phytoremediation, an emerging cost effective and ecologically benign technology for the decontamination of soils, is the use of plants and their associated microbes for environmental cleanup. The efficiency of phytoremediation depends mostly on the establishment of robust plant-microbe interactions.Elsholtziasplendensis a Labiatae plant well known for its high copper tolerance, which is widely distributed on copper deposits as well as non-contaminated areas. It has been considered for the phytoremediation of copper polluted soils; however, little is known about the role of the soil microbe community in the roots ofE.splendensin adapting the non-contaminated plants to copper stress. In order to evaluate the effects of inoculation with soil microbes on the copper tolerance ofE.splendens, this experiment studied the effect of inoculation with soil microbes on the seedling dry weight, plant morphology, survival rate, copper content and leaf gas exchange parameters ofE.splendensunder copper stress using a mesocosm system. The experiment included four soil treatments: the addition of copper (copper stress); soil microbe inoculation; addition of copper and soil microbe inoculation; and no additional copper or soil microbe inoculation (control). The results were as follows: (1) The plant number, plant height, basal diameter, biomass, and stem weight ratio ofE.splendensunder copper stress were lower than in the control. Inoculation with soil microbes significantly increased the plant number, plant height, biomass, and stem weight ratio ofE.splendensunder copper stress, indicating an alleviation effect on the inhibition of copper on the growth ofE.splendens. Compared with the control, the copper content of roots, stems, leaves, inflorescences and seeds were increased under copper stress. Under copper stress, soil microbe inoculation significantly decreased copper content in the stem and leaf organs ofE.splendens, but did not markedly affect copper content in the other organs. (2) In autumn, the diurnal variation in net photosynthetic rate (Pn) in the leaves ofE.splendensunder all treatments took on a one-peak curve. Inoculation with soil microbes significantly increased the daily meanPnand daily mean transpiration rate (Tr), and significantly decreased the daily mean stomatal conductance and daily mean intercellular CO2concentration (Ci) ofE.splendensunder copper stress. (3) Under copper stress, the maximum net photosynthetic rate (Pnmax), light saturation point (LSP), apparent quantum yield (AQY), maximum rate of carboxylation (Vcmax), maximum rate of electron transport (Jmax) and the triose phosphate use rate (TPU) ofE.splendenssignificantly decreased, while the light compensation point (LCP) significantly increased. Inoculation with soil microbes significantly increased thePnmax, LSP, AQY,Vcmax,Jmaxand TPU, but decreased the LCP. In conclusion, inoculation with soil microbes can effectively alleviate the damage of copper stress toE.splendensby increasing the photosynthetic ability, enhancing the light energy utilization and carbon assimilation and promoting the accumulation of organic matter. Inoculation with soil microbes can increase the growth of plants under copper stress, which could have potential applications in the phytoremediation of soils contaminated with heavy metals.
Elsholtziasplendens; soil microbe; copper stress; growth; photosynthetic physiology
浙江省自然科学基金项目(LY12C03002)
2013- 08- 21;
2014- 07- 02
10.5846/stxb201308212125
*通讯作者Corresponding author.E-mail: jzx@tzc.edu.cn
李月灵, 金则新, 李钧敏, 郭素民, 管铭.接种土壤微生物对铜胁迫下海州香薷生长及光合生理的影响.生态学报,2015,35(12):3926- 3937.
Li Y L, Jin Z X, Li J M, Guo S M, Guan M.Effects of soil microbe inoculation on the growth and photosynthetic physiology ofElsholtziasplendensunder copper stress.Acta Ecologica Sinica,2015,35(12):3926- 3937.
