O3浓度升高和太阳辐射减弱对小麦根际土壤微生物功能多样性的影响
2015-02-06吴芳芳郑有飞吴荣军王锦旗
吴芳芳, 郑有飞, 吴荣军, 王锦旗, 李 萍
南京信息工程大学环境科学与工程学院,江苏大气环境监测与污染控制高技术研究重点实验室, 南京 210044
O3浓度升高和太阳辐射减弱对小麦根际土壤微生物功能多样性的影响
吴芳芳, 郑有飞*, 吴荣军, 王锦旗, 李 萍
南京信息工程大学环境科学与工程学院,江苏大气环境监测与污染控制高技术研究重点实验室, 南京 210044
采用开顶箱(OTC)法和遮光网技术,设置100 nL/L臭氧熏气与3个辐射减弱梯度结合,模拟臭氧浓度升高和太阳辐射减弱的复合大气背景。用BIOLOG生态测试板,采用孔平均颜色变化率法(AWCD)测定冬小麦根际土壤微生物利用不同碳源的能力,计算微生物群落多样性指数,对不同碳源的利用率进行了主成分分析。两年试验结果显示,臭氧熏气与太阳辐射减弱复合作用,降低了土壤微生物对碳源的利用速度和利用总量;除了聚合物以外其它碳源利用率显著降低;对土壤微生物多样性没有直接的影响;对碳源降解的抑制效应大于增强的O3与减弱的太阳辐射两因素各自的单独作用。太阳辐射减弱20%,一定程度上增加了对聚合物类的分解。O3熏气条件下太阳辐射减弱,糖类、胺类代谢变异度较高,受环境影响较大。
臭氧增加; 太阳辐射减弱; 复合作用; 小麦; 微生物多样性
Effects of ozone fumigation and depressed solar irradiance on soil microbial
目前我国华东地区大气背景中O3浓度已达50 nL/L,已经超过了敏感作物O3伤害阀值AOT40的25%[1],而且每年还以0.5%—2%的速度递增[2]。空气中SO2、NOx、黑碳、飞灰、土壤尘粒子等,引起大气气溶胶光学厚度逐年增加,导致地面变暗变冷[3]。仅亚洲大气棕色云的直接辐射强迫引起的年均地表变暗就达14—16 W/m2(大约6%)[4]。近地层臭氧浓度增加和大气气溶胶引起的太阳辐射减弱等因素构成了复杂的大气背景。近地层大气太阳辐射减弱和O3浓度增加是全球科学家和公众密切关注的重要环境问题。地表O3和太阳辐射变化对土壤微生物的影响研究较少,Aneja M K等认为O3浓度增加降低了土壤微生物的群落结构[5]。陈展等认为臭氧浓度升高降低了盆栽小麦根系的生长和土壤微生物功能[6]。Voidarou 等认为O3浓度增加降低了环境中指示细菌的生长[7]。Johnson RM和李果梅分别报道了O3浓度升高对麦田土壤酶活性及酚酸类物质含量产生影响[8-9]。太阳辐射减弱通过改变光合有效辐射(PAR),使作物光合作用受抑制,作物减产,改变了碳、氮在植物中的分配[10- 14],改变了土壤中凋落物以及植物根系分泌物的数量和成分,改变了土壤温、湿度和pH值[15- 17],对土壤生态系统产生的影响有大量报道,而对土壤微生物的影响研究很少,特别是地表O3浓度增加和太阳辐射减弱复杂大气背景下,土壤微生物多样性的响应趋势国内外鲜见报道。土壤微生物多样性影响土壤生态系统的结构功能及过程,是维持土壤生产力的重要组分[18],土壤微生物种群的改变是土壤有机质变化的早期指标[19],可以敏感地指示气候和土壤环境条件的变化[20]。土壤微生物多样性在研究方法、研究范围等方面得到了广泛的重视,大量的研究认为,植被、土壤的管理方式包括农药的应用、施肥、耕作方式等,通过影响土壤有机碳和氮的水平、土壤含水量、温度、通气性及pH值等来影响土壤微生物多样性[21- 24]。土壤生态系统通过植物倍受大气环境的影响,Lou Y S报道紫外线增强降低了土壤微生物量碳氮的含量[25]。展小云等认为,加倍CO2浓度显著提高土壤微生物的活性及功能多样性[26];Gallo M,张乃莉等,认为气候变暖和大气N沉降改变了土壤微生物多样性[6,27]。然而孤立地分析单一环境因子对地下生化过程的影响,无法准确全面地评估土壤微生物群落对未来全球变化响应的真实情况。因为自然生态系统中,各种全球变化现象间的交互作用无处不在。为了研究地表O3浓度增加和太阳辐射减弱对土壤微生物多样性的交互影响,本文定点进行了两年试验,研究土壤微生物碳代谢指纹的变化,计算微生物多样性,为研究复杂大气背景对土壤微生态系统的影响提供参考。
1 材料与方法1.1 大田试验概况
于2008年至2011年在南京信息工程大学农业气象试验站(32.16°N,118.86°E)进行冬小麦生长季田间观测试验。当地多年平均温度为15.6 ℃,多年平均降水为每年1 100 mm。供试土壤为潴育型水稻土(灰马肝土属),土壤质地为壤质黏土,耕层土壤黏粒含量为26.10%,土壤pH(H2O) 值为6.20,有机碳和全氮的含量分别为19.40 g/kg、1.15 g/kg。
1.2 臭氧增加与辐射减弱复合作用的大田试验设计
试验采用直径3 m,高2.5 m 的开顶箱(OTC)作为臭氧布气的容纳装置,O3发生器(江苏省南京市万杰臭氧机电设备厂,WJ-H-Y5 型)通过电解空气中的O2产生O3;风机把空气和由发生器产生的O3混合后,由布气系统均匀地吹送到作物冠层;采用O3检测仪(新西兰aeroQUAL公司,S200型)对气室内O3浓度进行监测,通过阀门对室内浓度进行调节和控制。O3浓度设置为100 nL/L (T),为农田本底浓度的2 倍。OTC内设置臭氧浓度传感器(精度:1 nL/L),对臭氧浓度传感器进行预先设定浓度阈值,当OTC内臭氧浓度未达到此阈值时,臭氧发生器持续工作并向OTC内通入臭氧气体,当OTC内浓度超过此阈值时,臭氧传感器则提示报警,其信号通过微型电子控制仪的指令控制与臭氧发生器相连的电磁阀断开,此时臭氧发生器停止工作。这样可实现OTC内臭氧浓度的自动调控,每天臭氧处理时间段为08:00—16:00,遇有雨天则关闭整个装置。
遮荫棚采用镀锌钢管为主要支柱,搭建成3 m×3 m×3 m的立方体,两两间隔3 m。遮荫棚顶部用铁丝搭建为可上下调节的网状结构,用以支撑遮荫网,采用TBQ- 2型总辐射表对不同处理下达到冬小麦冠层的太阳总辐射强度进行了监测,监测时间为6:00—18:00,步长为1 min,每日实际监测到的太阳总辐射强度瞬时值(W m-2min-1)(图1)。通过计算确定各处理组实际接收的太阳辐射强度分别比对照减弱(20±5)%、(40±5)%、(60±5)%,田间大气O3浓度和太阳辐射强度没有人为干扰。并随着作物生长高度,调节遮荫网与冬小麦冠层间的距离,根据情况适当更换遮荫网,保证网下空气流通,使到达植物冠层的太阳总辐射变化量控制在预设值±5%范围内。在通入100 nL/L臭氧的OTC棚上方分别搭建不同透光度(网孔密度不同)的黑色聚乙烯遮荫网,使棚内处于100 nL/L O3熏气与太阳辐射分别减弱20%、40%、60%的复合环境中。试验设置T+S1(O3浓度为100 nl/L+太阳辐射强度减弱20%)、T+S2(O3浓度为100 nL/L+太阳辐射强度减弱40%)、T+S3(O3浓度为100 nl/L+太阳辐射强度减弱60%)三组双因子处理,另设T(O3浓度为100 nl/L)和S1(太阳辐射减弱20%)的单独作用,共5个处理,12个OTC棚和12个遮荫棚,实现每处理3次重复。以不通入O3不加遮荫网的OTC棚为对照。同步测定O3浓度和辐射通量,使O3误差控制在8%,使辐射误差控制在5%以内。
1.3 田间管理和取样
供试小麦品种为扬麦13号,水肥供应适量而充分, 其他农田管理措施均相同, 无病虫害及杂草的影响。播种日期、熏气起止日期、采样日期以及AOT40累积量如表1所示。按五点取样法,定点分别选取5株小麦,将其0—20 cm耕层根系区土样挖出,抖掉根系外围土,取紧贴在根表附近的土样,混合后作为根际土,用四分法取适量装于无菌纸袋中,立即带回实验室,4 ℃下冰箱保存,用于土壤微生物碳代谢指纹的测定。
1.4 微生物多样性的BIOLOG板检测
土壤微生物碳源利用多样性应用BIOLOG生态测试板(ECO MicroPlate, 美国Matrix Technologies Corporation生产)测定,Biolog EcoPlatesTM 技术是一种酶联免疫吸附剂测定方法(ELISA,enzyme linked immunosorbent assay)[28]。每块Biolog EcoPlate微孔板上有96 个孔, 3 份重复,每份重复有32 孔(包括1个对照孔和31个单一碳源孔),除对照孔仅有水和指示剂以外,其余31 孔都装有单一碳源和四唑染料。微生物利用单一碳源的代谢过程中产生氧化还原反应,使四唑染料变成紫色,根据每孔颜色变化程度检测微生物的代谢能力。称取抽穗期各处理新鲜土10 g,加入90 mL 0.85% NaCl无菌溶液于三角瓶中,无菌棉花塞封口后在摇床上震荡(200 r/min)30 min,按10 倍稀释法用0.85% NaCl无菌溶液将其稀释至原来的1 /1000,稀释液经离心去除残留的土壤后,上清液用于接种。接种悬浮液于生态测试板微孔板中,每孔150 μL,每样3 次重复,将接种好的测试板加盖在(25±1)℃下暗箱培养;连续培养10 d,期间每隔24 h用ELISA反应微平板读数器在590 nm处读取吸光度[ 29- 30]。

图1 不同处理下冬小麦冠层太阳辐射强度
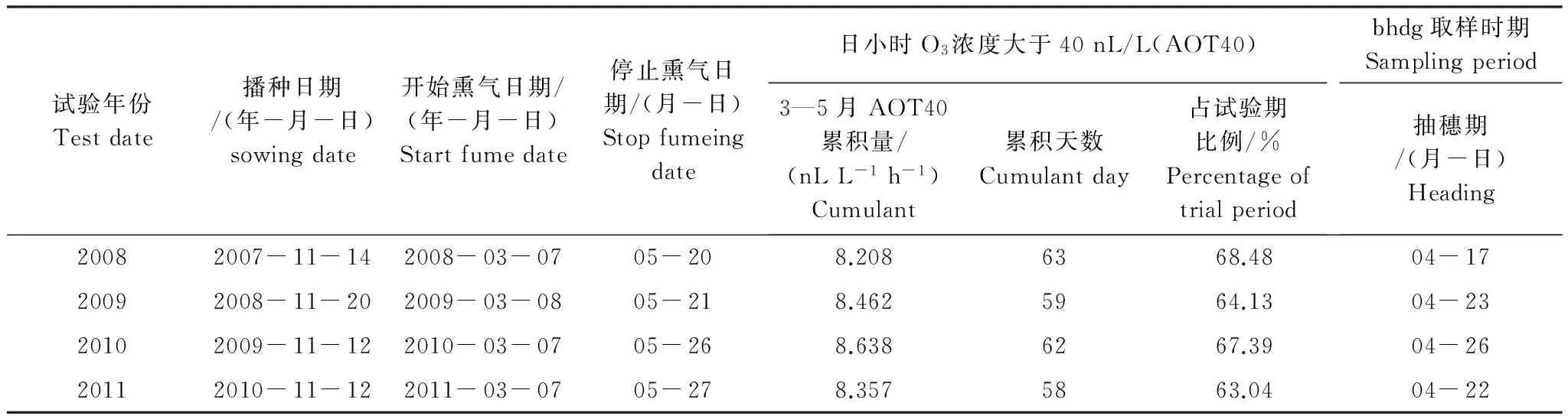
表1 大田熏气和采样时间表Table 1 Fumeing and sampling date
1.5 数据处理及统计分析
采用孔平均颜色变化率法(AverageWelL-Color Development, AWCD)测定土壤微生物利用单一碳源的能力[28]。AWCD的计算公式为:
AWCD =∑(Ci-R) /n
式中,Ci为各反应孔在590 nm下的吸光度,R为对照孔的吸光值,Ci-R≤0的孔在计算中记为0。n为培养基碳源种类数,本研究中为31。
当能观测到大部分微孔中微生物群落的反应,而且大部分活跃的微生物群落已达到颜色变化的渐近线时的培养时间为96 h,因此选择培养96 h时的数据,采用DPS软件,根据土壤微生物群落对31 种单一碳源利用的相似性,应用表2中的方法计算多样性指数,进行新复极差检验和主成分分析。

表2 土壤微生物群落功能多样性指数的计算公式Table 2 The equations of function diversity indexes of soil microbe community
2 结果与分析
2.1 O3熏气条件下太阳辐射减弱土壤微生物利用碳源的动力学特征

图2 不同处理土壤平均颜色变化率(AWCD) 192h培养期间的变化
2010年与2011年两年试验结果显示,O3熏气与太阳辐射减弱双因子处理下,土壤微生物对碳源的降解速率(24—96 h降解曲线的斜率)和最终AWCD 值都显著低于CK、T和S1,如图2所示。这说明,增强的O3与减弱的太阳辐射两种因素双因子处理对碳源降解速率的抑制效应大于它们的单独作用。单独O3熏气(T),土壤微生物对碳源的降解速率、AWCD最大值均显著低于对照。太阳辐射减弱20%单独作用(S1),土壤微生物对碳源降解速率与CK无显著差异,但AWCD最大值显著降低。结果说明,O3熏气降低了土壤微生物碳源利用的速率和最终碳源利用总量,太阳辐射减弱20%时对土壤微生物的碳源降解速率没有显著影响,但降低了最终碳源利用总量。
2.2 O3熏气和太阳辐射减弱土壤微生物对不同类别碳源的利用强度

图3 O3熏气和太阳辐射减弱下土壤微生物对不同类型碳源的利用
采用土壤ELISA反应96 h的数据分析土壤微生物对不同类别碳源的利用强度,从图3可看出,T,T+S1,T+S2,T+S3处理显著降低了碳源利用总量,S1对碳源总量的利用则没有显著影响。不同类型碳源的利用强度如表3所示,糖类、氨基酸、羧酸、酚酸和胺类的利用率在T、T+S1、T+S2、T+S3作用下显著降低,S1对它们则没有明显影响。聚合物类的AWCD值较小,说明难以被微生物分解,S1却能显著提高聚合物的利用强度。两年试验变化趋势相同。结果说明,适度的太阳辐射减弱(减弱20%),一定程度上增加了对聚合物类的分解,O3浓度单独增加处理,以及O3熏气和太阳辐射减弱双因子处理下,除了聚合物类以外其它碳源利用率显著降低。增加的O3和减弱的辐射两因素复合作用比O3单因素作用对碳源利用强度的抑制效应强。
2.3 O3熏气和太阳辐射减弱对土壤微生物群落功能多样性指数的影响
O3熏气和太阳辐射减弱条件下,土壤微生物群落功能多样性指数:Simpson指数(D)、 Shannon指数(H′)、McIntosh(Dmc)指数以及Simpson均匀度在两年的试验中均没有显著变化;只有评估微生物丰富度的Brillouin指数(H)比对照及S1处理低(表4)。可见增强的O3与减弱的太阳辐射处理,对麦田土壤常见微生物类群影响不大,对不同种类微生物生长繁衍的刺激作用没有很大差异,没有使某些物种大幅度增长或减少,群落均匀性变化不显著。微生物丰富度是否降低还需长期试验观察。

表 3 O3熏气和太阳辐射减弱处理下土壤不同类别碳源AWCD值Table 3 AWCD of different types carbon sources under ozone fumigation and depressed solar irradiance
不同字母表示处理间经Duncan氏多重极差检验差异显著(P<0.05)

表 4 O3熏气条件下太阳辐射减弱土壤微生物群落功能多样性指数Table 4 Function diversity index of soil microbe community under ozone fumigation and depressed solar irradiance
2.4 O3熏气和太阳辐射减弱条件下微生物群落功能主成分分析(PCA)
对培养96 h的AWCD数据进行微生物群落功能主成分分析(PCA),土壤微生物碳源利用功能多样性2010年相关的主成分1(PC1)、主成分2(PC2)依次解释变量方差的70.24%、20.16%,PC1,PC2的累计贡献率达到90.40%;2011年相关的主成分1、主成分2依次解释变量方差的76.17%、12.80%,PC1,PC2的累计贡献率达到88.97%;PC1、PC2是变异的主要来源,可以解释变异的绝大部分信息(表5)。再将土壤碳利用主成分进行分权计算,并计算出各因子在各主成分上的载荷:载荷=(特征向量×特征值1/2)2[31],得到表6,得出31 种碳源在两个主成分上的载荷值。由表7可知,2010年,PC1主要综合了15种碳源的信息,分别属于糖类(5 种)、氨基酸(4 种)、羧酸(4 种)、聚合物(1 种)酚酸(1 种),说明有15 种碳源使土壤微生物群落代谢功能多样性在PC1 上差异显著,决定PC1 的分异。与PC2 显著相关的碳源有6 种,分别属于糖类(5 种)、胺类(1 种),说明有6 种碳源使土壤微生物群落代谢功能多样性在PC2 上差异显著,决定PC2的分异。2011年,PC1主要综合了15 种碳源的信息,分别属于糖类(6种)、氨基酸(4 种)、羧酸(3 种)、聚合物(1 种)酚酸(1 种),说明有15 种碳源使土壤微生物群落代谢功能多样性在PC1上差异显著,决定PC1的分异。与PC2显著相关的碳源有3 种,分别属于糖类(2 种)、胺类(1 种),说明有3 种碳源使土壤微生物群落代谢功能多样性在PC2 上差异显著。由于大气O3浓度增加和太阳辐射减弱引起土壤中微生物环境出现差异造成15种碳源分解有显著变化。
表5 O3熏气和太阳辐射减弱条件下根际土壤微生物碳源主成分特征值
Table 5 Principal component eigenvalues of different carbon sources types by rhizosphere soil microbes under ozone fumigation and depressed solar irradiance (2010,2011)
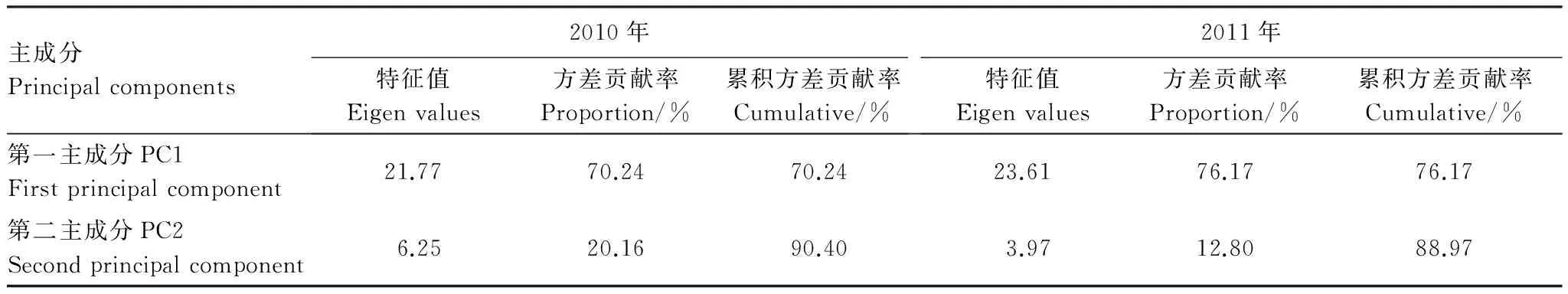
主成分Principalcomponents2010年特征值Eigenvalues方差贡献率Proportion/%累积方差贡献率Cumulative/%2011年特征值Eigenvalues方差贡献率Proportion/%累积方差贡献率Cumulative/%第一主成分PC1Firstprincipalcomponent21.7770.2470.2423.6176.1776.17第二主成分PC2Secondprincipalcomponent6.2520.1690.403.9712.8088.97
3 讨论
复杂的大气背景中,多种大气成分相互影响,NASA Goddard报道,臭氧对硫酸化合物的浓度影响很大[32]。硫酸化合物是重要的负辐射强迫物质,造成到达地面的太阳辐射减少。单文坡等认为,近地面O3浓度与太阳辐射和气温有很好的相关性[33],这主要是由于太阳辐射和气温是许多与O3相关的大气化学或光化学过程的控制因素,而相对湿度可以直接影响大气中自由基的数量,从而对O3化学产生影响。晴天地表各污染物浓度的变化比较平稳,阴天变化波动较大,这也说明了太阳辐射在近地面大气化学中的重要作用。O3熏气能使太阳负辐射强迫增强,增强了因太阳辐射减弱而给农田生态带来的负面影响。太阳辐射减弱促进了植物对O3的化学吸收。两年的定点试验得出,O3熏气条件下与太阳辐射减弱复合作用均显著降低了不同类型碳源的降解速率和降解总量,糖类、氨基酸类的分解变异度较高。辐射减弱与O3熏气结合能加剧O3对碳源分解的抑制作用,O3与辐射减弱之间存在协同关系。
表6 O3熏气和太阳辐射减弱条件下土壤微生物对不同碳源利用的主成分特征向量
Table 6 Principal component eigenvectors of different carbon sources types by rhizosphere soil microbes under ozone fumigation and depressed solar irradiance (2010,2011)

载荷- 1,2分别指各主成分上承载的各因子的方差百分率
土壤微生物对大气环境变化的响应受到土壤温度、CO2、养分利用效率和水分状况等因素的制约[34],O3浓度升高和太阳辐射减弱长期作用引起土壤养分有效性[35]和水分利用效率的变化将改变土壤微生物最初的响应。O3与太阳辐射减弱的交互作用,在不同年份差异显著性不同,这可能是土壤微生物异质性的结果。由于长期环境变化对生态系统微生物过程及结果的预测受到有限的生态学信息的制约,很难确定在较长时间尺度上O3浓度升高和太阳辐射减弱对土壤微生物的作用,更不能进行小尺度向大尺度的推绎,因为在不同的时间尺度土壤微生物对大气环境变化的响应可能很不一致。
大气环境变化对植物根际土壤微生物多样性的影响是通过植物生长代谢间接作用的结果,不仅随着植物类型改变, 还随着植物的生长发育过程改变, 具有非常强的时空特征[36]。土壤微生物多样性对大气环境的响应与植物生长发育过程有关。太阳辐射减弱增加了植物对O3的吸收,加重了O3伤害,O3浓度升高与太阳辐射减弱的交互作用加剧了对土壤根际微生物活性的抑制。
表征微生物群落功能多样性的指数没有显著变化,说明O3熏气条件下与太阳辐射减弱在较短时期内没有改变土壤微生物的群落结构和功能多样性。要确定在较长时间尺度上O3浓度升高和太阳辐射减弱对土壤微生物多样性的影响,需长期的后续研究。
4 结论
(1) O3熏气和太阳辐射减弱条件下,土壤微生物代谢活性下降,不同类型碳源的分解速率、分解总量下降。
(2)辐射减弱20%的单因素作用对碳源的分解没有显著影响,但与O3结合则能加剧了O3对碳源分解的抑制作用,O3与遮荫之间存在协同关系。O3浓度增加与太阳辐射减弱复合背景下,糖类、氨基酸类的分解变异度较高。
(3) O3熏气和太阳辐射减弱条件下,表征微生物优势度、均匀度、丰富度的多样性指数在两年试验中没有显著变化,微生物群落结构功能多样性在短期内没有明显影响。
[1] Tausz M, Grulke N E, Wieser G. Defense and avoidance of ozone under global change. Environmental Pollution, 2007, 147(3): 525- 531.
[2] Fuhrer J, Skärby L, Ashmore M R. Critical levels for ozone effects on vegetation in Europe. Environmental Pollution, 1997, 97(1/2): 91- 106.
[3] Forster P, Ramaswamy V, Artaxo P, Berntsen T, Betts R, Fahey D W, Haywood J, Lean J, Lowe D C, Myhre G, Nganga J, Prinn R, Raga G, Schulz M, Van Dorland R. Changes in atmospheric constituents and in radiative forcing // Solomon S, Qin D, Manning M, Chen Z, Marquis M, Averyt K B, Tignor M, Miller H L. Climate Change 2007: The Physical Science Basis. Working Group I Contribution to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge, United Kingdom and New York: Cambridge University Press, 2007.
[4] Satheesh S K, Ramanathan V. Large differences in tropical aerosol forcing at the top of the atmosphere and earth′s surface. Nature, 2000, 405(6782): 60- 63.
[5] Aneja M K, Sharma S, Fleischmann F, Stich S, Heller W, Bahnweg G, Charles M J, Schloter M. Influence of ozone on litter quality and its subsequent effects on the initial structure of colonizing microbial communities. Microbial Ecology, 2007, 54(1): 151- 160.
[6] Gallo M, Amonette R, Lauber C, Sinsabaugh R L, Zak D R. Microbial community structure and oxidative enzyme activity in nitrogen-amended north temperate forest soils. Microbial Ecology, 2004, 48(2): 218- 229.
[7] Voidarou C, Tzora A, Skoufos I, Vassos D, Galogiannis G, Alexopoulos A., Bezirtzoglou E. Experimental effect of ozone upon some indicator bacteria for preservation of an ecologically protected watery system. Water, Air and Soil Pollution, 2007, 181(1/4): 161- 171.
[8] Johnson R M, Pregitzer K S. Concentration of sugars, phenolic acids, and amino acids in forest soils exposed to elevated atmospheric CO2and O3. Soil Biology and Biochemistry, 2007, 39(12): 3159- 3166.
[9] 李果梅, 王殳屹, 史奕, 陈欣. O3浓度升高及温度对麦田土壤酶活性及酚酸类物质含量的影响. 农业环境科学学报, 2008, 27(1): 121- 125.
[10] 刘贤赵, 康绍忠, 邵明安, 王力. 土壤水分与遮阴水平对棉花叶片光合特性的影响研究. 应用生态学报, 2000, 11(3): 377- 381.
[11] 杨渺, 毛凯, 马金星. 遮阴生境下假俭草的形态变化与能量分配研究. 中国草地, 2004, 26(2): 44- 48,62.
[12] 王迅, 张新全, 刘金平. 草坪草对遮荫胁迫的生理反应. 草业科学, 2006, 23(4): 86- 90.
[13] 文军. 遮荫对粤西香根草光合特性和生长的影响 [D]. 兰州: 甘肃农业大学, 2007.
[14] 韦海建, 杨惠敏, 赵亮. 遮荫环境对白三叶草气孔和光合特性的影响. 草业科学, 2007, 24(10): 94- 97.
[15] 翟薇. 大气气溶胶辐射效应对长江三角洲地区主要作物生产的影响 [D]. 北京: 中国气象科学研究院, 2007.
[16] 蔡瑞国, 王振林, 张敏, 王晓英, 张体彬, 周印富, 王文颇, 李彦生. 挑旗-开花期遮光对强筋小麦干物质积累的影响. 河北科技师范学院学报, 2009, 23(1): 12- 19.
[17] Chen Z, Wang X K, Feng Z Z, Xiao Q, Duan X N. Impact of elevated O3on soil microbial community function under wheat crop. Water, Air, and Soil Pollution, 2009, 198(1/4): 189- 198.
[18] Bastida F, Zsolnay A, Hemández T, Garcia C. Past, present and future of soil quality indices: a biological perspective. Geoderma, 2008, 147(3/4): 159- 171.
[19] Lundquist E J, Jackson L E, Scow K M, Hsu C. Changes in microbial biomass and community composition, and soil carbon and nitrogen pools after incorporation of rye into three California agricultural soils. Soil Biology and Chemistry, 1999, 31(2): 221- 236.
[20] Zelles L. Fatty acid patterns of phospholipids and lipopolysaccharides in the characterisation of microbial communities in soil: a review. Biology and Fertility of Soils, 1999, 29(2): 111- 129.
[21] 杨永华, 姚健, 华晓梅. 农药污染对土壤微生物群落功能多样性的影响. 微生物学杂志, 2000, 20(2): 23- 25, 47- 47.
[22] 徐华勤, 肖润林, 邹冬生, 宋同清, 罗文, 李盛华. 长期施肥对茶园土壤微生物群落功能多样性的影响. 生态学报, 2007, 27(8): 3355- 3361.
[23] 王加龙, 刘坚真, 陈杖榴, 陈林. 恩诺沙星残留对土壤微生物数量及群落功能多样性的影响. 应用与环境生物学报, 2005, 11(1): 86- 89.
[24] 区余端, 苏志尧, 彭桂香, 刘刚. 车八岭山地常绿阔叶林冰灾后土壤微生物群落功能多样性. 生态学报, 2009, 29(11): 6156- 6164.
[25] Lou Y S, Ren L X, Li Z P, Cheng H Y, Zhang T L. Effect of elevated ultraviolet-B radiation on microbial biomass carbon and nitrogen in barley rhizosphere soil. Water, Air, and Soil Pollution, 2011, 219(1/4): 501- 506.
[26] 展小云, 吴冬秀, 张琳, 张灿娟, 周双喜, 杨云霞. 小叶锦鸡儿根际微生物群落功能多样性对环境变化的响应. 生态学报, 2010, 30(12): 3087- 3097.
[27] 张乃莉, 郭继勋, 王晓宇, 马克平. 土壤微生物对气候变暖和大气N沉降的响应. 植物生态学报, 2007, 31(2): 252- 261.
[28] Zheng H, Ouyang Z Y, Fang Z G, Zhao T Q. Application of biolog to study on soil microbial community functional diversity. Acta Pedologica Sinica, 2004, 41(3): 456- 461.
[29] Zogg G P, Zak D R, Pregitzer K S, Bruton A J. Microbial immobilization and the retention of anthropogenic nitrate in a northern hardwood forest. Ecology, 2000, 81(7): 1858- 1866.
[30] Sparling G P. Soil microbial biomass, activity and nutrient cycling as indicators of soil health // Pankhurst C, Doube B M, Gupta V V S R. Biological Indicators of Soil Health. Wallingford, UK: CAB International, 1997: 97- 119.
[31] 邱莉萍, 刘军, 王益权, 孙慧敏, 和文祥. 土壤酶活性与土壤肥力的关系研究. 植物营养与肥料学报, 2004, 10(3): 277- 280.
[32] 张燕. 臭氧和硫化物对地球气候变化的影响. 科学与管理, 2006, (5): 94- 94.
[33] 单文坡. 大气臭氧浓度变化规律及相关影响因素研究 [D]. 济南: 山东大学, 2006.
[34] Tscherko D, Kandeler E, Jones T H. Effect of temperature on below-ground N-dynamics in a weedy model ecosystem at ambient and elevated atmospheric CO2levels. Soil Biology and Biochemistry, 2001, 33(4/5): 491- 501.
[35] 吴芳芳, 郑有飞, 吴荣军, 李萍, 王锦旗. 4年O3熏气对小麦根际土壤氮素微生物转化的影响. 生态学报, 2013, 33(24): 7679- 7689.
[36] 吴芳芳, 郑有飞, 吴荣军, 王锦旗. 近地层臭氧对小麦抗氧化酶活性变化动态的影响. 生态学报, 2011, 31(14): 4019- 4026.
functional diversity in winter wheat rhizosphere
WU Fangfang, ZHENG Youfei*, WU Rongjun, WANG Jinqi, LI Ping
JiangsuKeyLaboratoryofAtmosphericEnvironmentalMonitoringandPollutionControlHigh-techResearch,NanjingUniversityofInformationScience&Technology,Nanjing210044,China
Enhanced ozone concentration and depressed solar irradiation were simulated by using open-top chambers (OTCs) method and shading net techniques at 100 nL/L ozone fumigation assembling with three different levels of depressed solar irradiance. The effect of enhanced O3combination with depressed solar irradiance was also studied. Two experiments were performed over two years. The combination of three OTCs with six shaded chambers was set up. Each OTC fed with 100 nL/L ozone. In the shaded chambers, solar irradiance was reduced to different levels of 20%, 40%, 60% respectively. Combined actions of O3and depressed solar irradiance were tested by shading net above OTCs. Using unshaded OTC and unfed with O3as controls. OTC fed with 100 nL/L ozone only, and shaded chamber solar irradiance reduced 20% only were applied too. Each chamber was equivalent and repeated three times. Winter wheat was grown to all life stage in OTCs, shading net and their combine chambers. From reviving to mature stages, in OTCs the plants were treated for 8 h (8:00—16:00) every sunny day with O3, in shading chambers covered net all life stage. The ability of winter wheat (Triticumaestivum)rhizosphere microbial to use different carbon sources were measured by applying BIOLOG ECO MicroPlate and Average WelL-Color Development (AWCD). Microbial diversity index and Principal Component Analysis (PCA) were calculated on the utilization of different carbon sources. Each treatment was assayed in triplicate. The data were initially compared by analysis of variance and differences between means were detected using the Duncans Multiple Range Tests. Values ofP<0.05 indicated significance. Quite similar results were obtained during the two years′ experiments. The results suggesting that under ozone fumigation and reduced solar irradiance, AWCD was reduced, catabolic ability of single carbon source was declined too. No obvious influence of O3combined with shading on soil microbial diversity was found. Principal Component Analysis suggested that different forms of carbon source have different sensitivity. The variation degree of carbohydrates′ is higher than others. Under ozone fumigation combined with reduced solar irradiance, AWCD and catabolic ability of single carbon sources were lower than enhanced O3or lower solar irradiance single acting. For soil microbial, two years′ results showed that combination effects of ozone fumigation and reduced solar irradiation reduced both rate and total utilization of carbon sources except polymers. However, there was no direct impact on the diversity of soil microbial. For Inhibitory effect on the degradation of carbon, combined effect of enhanced ozone concentration and reduced solar irradiation was greater than each factor functioning alone. 20% reduction of solar radiation increased the decomposition of polymers to some extent. On the conditions of combined O3fumigation and solar radiation weakened, that makes the metabolism of carbohydrates and amines highly variable, as they are largely affected by the environment. Enhanced O3and lower solar irradiation have a cooperative action. Reduced solar irradiance is benefit for winter wheat absorbing O3,resulting in a serious injury.
ozone; depressed solar irradiance; recombination action;Triticumaestivum; soil microbial diversity
教育部高等学校博士学科点专项科研基金(20123228110003); 国家自然科学基金(41075114)
2013- 08- 05;
2014- 10- 13
10.5846/stxb201308052029
*通讯作者Corresponding author.E-mail: zhengyf@nuist.edu.cn
吴芳芳, 郑有飞, 吴荣军, 王锦旗, 李萍.O3浓度升高和太阳辐射减弱对小麦根际土壤微生物功能多样性的影响.生态学报,2015,35(12):3949- 3958.
Wu F F, Zheng Y F, Wu R J, Wang J Q, Li P.Effects of ozone fumigation and depressed solar irradiance on soil microbial functional diversity in winter wheat rhizosphere.Acta Ecologica Sinica,2015,35(12):3949- 3958.
