基于纳米酞菁钴修饰的石墨烯作为过氧化物模拟酶的信号放大型免疫传感器的研究
2015-02-02杨哲涵柴雅琴
杨哲涵,汪 娟,卓 颖,柴雅琴
(西南大学化学化工学院,重庆400715)
基于纳米酞菁钴修饰的石墨烯作为过氧化物模拟酶的信号放大型免疫传感器的研究
杨哲涵,汪 娟,卓 颖,柴雅琴*
(西南大学化学化工学院,重庆400715)
该文利用酞菁钴纳米粒子修饰氧化石墨烯(NanoCoPc/GO)用于构建无酶的信号放大型电化学免疫传感器来灵敏地检测降钙素原(PCT)。纳米酞菁钴和氧化石墨烯都具有类似于天然过氧化物酶的性质可以催化氧化H2O2。因此,当H2O2的存在时,NanoCoPc/GO通过催化H2O2实现对电活性物质的信号的放大。NanoCoPc/GO作为模拟酶用于电化学放大时,可以避免天然酶的缺点比如价格昂贵和容易随着环境变化而发生变性。结果表明,该免疫传感器检测PCT的线性范围在0.025~5.0 ng/mL,最低检测限为8 pg/mL。
纳米酞菁钴;氧化石墨烯;降钙素原;电化学传感器
基于纳米酞菁钴和石墨烯的以上性质,该文中,设计合成了具有过氧化物酶性质的纳米酞菁钴氧化石墨烯纳米复合材料 (NanoCoPc/GO),并将其运用在构建一种无酶的信号放大型电化学免疫传感器用于检测降钙素原。首先将纳米酞菁钴与氧化石墨烯π-π堆积得到NanoCoPc/GO复合材料。然后将电活性物质硫瑾(thi)修饰的降钙素原的第二抗体 (Ab2)利用交联剂固载到NanoCoPc/GO复合材料上(thi/Ab2/NanoCoPc/GO)。由于GO具有较大的比表面积,增加了纳米酞菁钴、Ab2、thi的固载量。另一方面,NanoCoPc/GO复合物催化底物中的H2O2的氧化进一步的放大了电活性物质thi的信号。本文利用了纳米材料的催化作用取代了天然酶实现了无酶的信号放大。实验结果表明,该免疫传感器检测PCT的线性范围在0.025~5.0 ng/mL,最低检测限为8 pg/mL。
1 实验部分
1.1 实验试剂和实验仪器
单克隆捕获抗体Ab1(anti-PCT),PCT标准溶液,第二抗体Ab2(anti-PCT),牛血清白蛋白(BSA,96%~99%)购自郑州Biocell生物试剂公司,抗体抗原保存在4℃冰箱中待用。氧化石墨烯(GO)购于先锋纳米科技有限公司(中国南京)。酞菁钴,CTAB,氯金酸(HAuCl4),thi,均购自美国西格玛有限公司。交联剂N-羟基琥珀酰亚胺(NHS)和1-乙基-3-(3-二甲基氨丙基)-碳化二亚胺(EDC)均购自上海国药集团化学试剂有限公司 (中国上海)。醋酸缓冲溶液 (0.1 mol/L,PBS,pH5.5)用储备的0.1 mol/L HAc-NaAc和0.1 mol/L KCl配制,并由 NaOH溶液配成 pH为5.5。其它试剂为分析纯试剂,实验室用水为二次蒸馏水。
CHI852c电化学工作站 (上海辰华仪器公司),S-4800型扫描电子显微镜 (SEM,日本HITACHI公司)。AB204-S电子天平 (瑞士Mettler&Toledo公司);BRANSONIC200超声清洗仪(德国BRANSON UL—TRASCHALL公司);移液枪(成都方舟科技开发公司);JBZ-12H磁力搅拌器;三电极工作系统:免疫电极为工作电极,Ag/AgCl(饱和KCl)为参比电极,铂丝电极为对电极。
1.2 NanoCoPc/GO的制备
根据文献报道的方法合成纳米酞菁钴[15-16]。首先将0.015 g CoPc溶于500 μL质量分数98%的浓硫酸中待用。然后称取0.045 g十六烷基三甲基溴化铵(CTAB)于50 mL烧杯中,用28 mL蒸馏水溶解,在超声的条件下将硫酸溶解的CoPc逐滴加入CTAB中,溶液呈蓝色半透明溶液。离心,洗涤三次,得到NanoCoPc,将其用10 mL蒸馏水分散后待用。
取0.5 mg GO溶于1 mL蒸馏水中,超声使其充分溶解。将其加入到2 mL NanoCoPc溶液中,混合液超声48 h后,离心,洗涤三次,所得即为NanoCoPc/GO。将其用2 mL蒸馏水分散于5 mL烧杯中,并加入交联剂EDC/NHS(摩尔比4∶1)室温下搅拌2 h,即得到活化后的NanoCoPc/GO。冰箱中放置待用。
1.3 Thi/anti-PCT的制备
吸取100 μL PCT溶液于2 mL蒸馏水中,并加入交联剂EDC/NHS(摩尔比4∶1),在4℃下搅拌2 h,再加入10 mg thi于其中,于4℃下搅拌12 h。通过EDC和NHS的偶联作用,使抗体上的羧基和硫堇的氨基反应得到thi修饰的PCT第二抗体(thi/anti-PCT)。离心,洗涤三次,所得下层沉淀即为thi/anti-PCT。然后将其分散在1 mL pH7.0的PBS溶液中,置于冰箱待用。
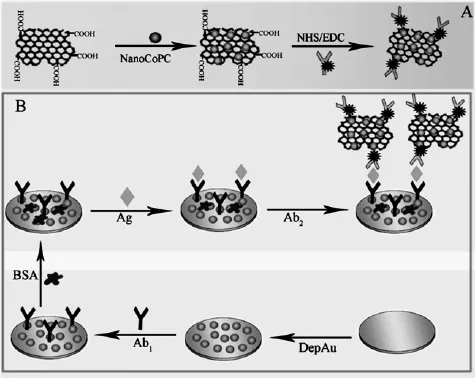
图1 (A)Ab2/Thi@NanoCoPc/GO生物耦合物的制备过程,(B)免疫传感器的制备过程Fig.1 (A)Synthesized process and preparation procedure of Ab2/Thi@NanoCoPc/GO bioconjugate,(B)the preparation and fabrication of immunosensor
1.4 二抗复合物 (Ab2/Thi@NanoCoPc/GO)的制备
取500 μL Thi/anti-PCT溶液,将其加入到2 mL活化后的NanoCoPc/GO中,于4℃下搅拌12 h。离心洗涤得到Ab2/Thi@NanoCoPc/GO复合物。用1.5 mL PBS分散,置于冰箱中待用。
1.5 免疫传感器的制备
该免疫传感器的构建过程如图1所示,首先用0.05 μm的Al2O3粉末反复打磨抛光玻碳电极使其成镜面,然后用蒸馏水冲洗,并在超声仪中超声5 min除去物理吸附的杂质。预处理后,将电极置于氯金酸(ω=1%HAuCl4)溶液中电沉积30 s,沉积电位为-0.2 V。用二次蒸馏水淌洗,室温下晾干。接着在电极上滴 15 μL降钙素原抗体(Ab1),放置于冰箱中12 h。再用蒸馏水淌洗,室温下晾干后,滴加15 μL牛血清白蛋白(BSA, 0.25%)。1 h后,用蒸馏水淌洗,晾干,滴加15 μL PBS稀释的PCT抗原溶液,37℃烘箱中反应30 min后取出,蒸馏水淌洗,晾干,滴加15 μL Ab2/ Thi@NanoCoPc/GO复合物,于37℃烘箱中反应30 min。取出电极后,用蒸馏水淌洗两次,在pH5.5醋酸缓冲溶液中进行试验测定。
2 结果与讨论
2.1 扫描电镜表征GO,NanoCoPc/GO
GO的扫描电子显微镜(SEM)图如图2A所示。由图可见,GO呈不规则片状,且表面光滑。图2B为NanoCoPc/GO复合物SEM图,当将纳米酞菁颗粒与GO π-π堆积后,可见片状的GO上已覆有一层不规则形状的颗粒。表征结果表明,成功的制备了NanoCoPc/GO复合物。

图2 扫描电镜图:GO(A),NanoCoPc/GO(B)Fig.2 SEM image of GO(A)and NanoCoPc/GO(B)
2.2 H2O2对PCT的检测信号放大的作用的研究
该文通过向电解池溶液中加入不同浓度的H2O2来考察NanoCoPc/GO是否能通过催化H2O2来放大检测信号。结果如图3所示,曲线a是在没有加H2O2的电化学响应信号。曲线b是向电解池溶液中加入了6 μL H2O2的电流响应。曲线c是向电解池中加入了14 μL H2O2的电流响应。曲线d是向电解池中加入了18 μL H2O2的电流响应。随着电解池中的H2O2浓度增加,电流响应增加,该结果表明NanoCoPc/GO通过催化H2O2的成功的使检测的信号提高,从而证明所设计的信号放大策略是成功的。
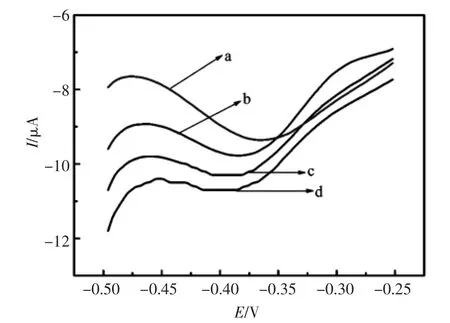
图3 H2O2对免疫电极的影响:曲线a-d为加入不同体积的0.35 mol H2O2的DPV响应图(a):0 μL,(b):6 μL, (c)14 μL,(d)18 μLFig.3 Influence of H2O2on the current response:(a):0 μL,(b):6 μL,(c)14 μL,(d)18 μL
2.3 H2O2浓度的优化
H2O2浓度对电化学信号放大的响应至关重要,因此该文对H2O2浓度的进行了优化。依次向电解池2 mL HAc-NaAc缓冲溶液(pH5.5)中加入体积为0 μL,2 μL,6 μL,10 μL,14 μL,18 μL,20 μL的0.35 mol/L H2O2,电解池中对应的H2O2浓度分别为 0.35,1.05,1.74,2.43,3.12,3.81 mol/L。电化学信号的响应结果如图4所示,当未加入H2O2时,即H2O2浓度为0时,电流响应值最小,随着的H2O2加入,电流值逐渐增大,当H2O2浓度达到3.12 mol/L时,即加入H2O2的为18 μL时,电流值达到最大。当再增加电解池中H2O2的浓度时,响应电流值开始减小,这可能是由于H2O2过大时,对电极表面有一定的腐蚀作用,导致了电流的减少。因此,在该体系中,选取电解池中H2O2浓度为3.12 mol/L为最佳响应浓度。
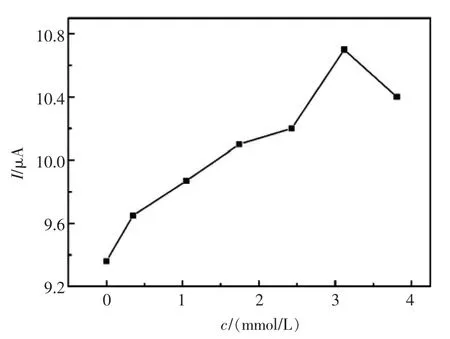
图4 H2O2浓度的优化图Fig.4 Optimization image of H2O2concentration
2.4 电极在组装过程中的电化学表征
为了考察电极在修饰过程中是否成功,该实验以铁氰化钾(pH=7.4,0.5 mmol/L)为氧化还原探针,对电极修饰过程的电极的电化学行为进行探究。在图5中,曲线a为裸的波碳电极的CV响应图,呈现出一对明显Fe(CN)64-/3-的氧化还原峰。曲线b为沉积金纳米粒子后的电极CV响应图,因为金纳米粒子具有很强的导电特性,能加快电子传输,因此,氧化还原峰电流值明显增大。曲线c为电极修饰一抗后的CV图,与未修饰一抗的曲线b相比,氧化还原峰电流值减小。由于PCT抗体属于蛋白质,阻碍了电子传递。这种现象说明PCT抗体已成功修饰到电极。曲线d为修饰了封闭剂BSA后的CV响应图,由于BSA同样会阻碍电子传递,从而使得响应电流值进一步减小。曲线e为孵育PCT抗原后的CV图,由于PCT阻碍电子传递的作用,使峰电流值减小。电极修饰的表征现象表明电极每一步的组装过程皆为成功。
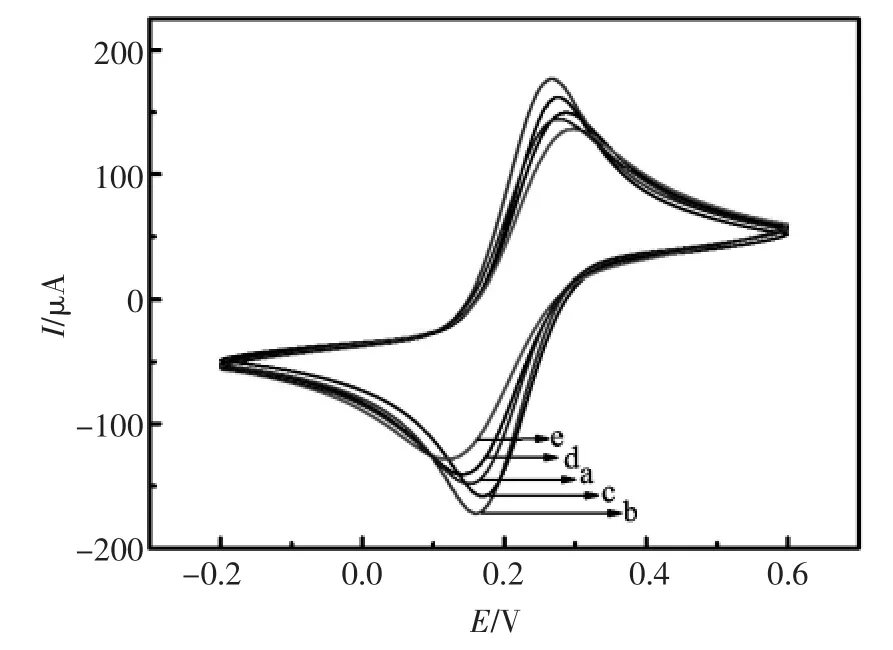
图5 不同修饰电极在0.5 mmoL/L铁氰化钾溶液中(pH=7.4)的循环伏安表征图,(a)裸玻碳电极,(b)电沉积纳米金后电极,(c)抗体修饰电极,(d)经BSA封闭的电极,(e)孵育30 μg/mL PCT后的电极。扫描速度为50 mV/sFig.5 CVs of the different electrodes in 0.5 mmol/L [Fe(CN)6]4-/3-solution(pH=7.4).(a)bare glassy carbon electrode;(b)GCE of electrodeposion of nano-Au;(c)anti-PCT modified electrode;(d)BSA blocked electrode;(e) modified electrode incubated with 30 μg/mL PCT.The scan rate was 50 mV/s

图6 (A)PCT的浓度从a到f(0.025,0.05,0.25,0.5,2.5,5 ng/mL)的DPV曲线图。(B)PCT的标准校准曲线图Fig.6 (A)PCT from a to g(0.025,0.05,0.25,0.5,2.5,5 ng/mL)in working buffer HAc-NaAc. (B)Calibration curve of the immunosensors for PCT determination
2.5 免疫传感器对降钙素原PCT浓度的电流响应
图6为实验条件优化的条件下对不同浓度PCT的电流响应图。首先,用pH7.4的PBS溶液配置不同浓度的PCT溶液,浓度依次为0.025,0.05,0.25,0.5,2.5,5 ng/mL。在最优的条件下,对不同浓度的PCT进行定量分析。图6(A)是相应的DPV曲线,随着PCT的浓度增加,电流响应增加。图6(B)是PCT标准的校准曲线,线性范围在0.025~5.0 ng/mL内,最低检测限为8 pg/mL,回归方程为I=4.264 c+8.891,相关系数r=0.9830。
3 结论
该文构建了一种NanoCoPc/GO新型载体,巧妙地利用了氧化石墨烯和纳米酞菁钴仿酶性质,构建了纳米酞菁钴修饰的氧化石墨烯复合物。该复合物不仅可以作为模拟酶催化H2O2,实现检测信号的放大,而且可以用作固载基质来固载Ab2。该体系利用纳米材料的催化作用实现了无酶信号放大,成功的避免了天然酶用作催化的缺点。此外,该复合物本身能参与H2O2的催化,实现电子的转移,从而实现对低浓度生物分子的放大检测,使得实验过程更加便捷。
[1]赵美建,徐琦新.降钙素原的临床意义以及在新生婴儿中的应用[J].国外医学:儿科学分册,2004,2:86-88.
[2]Simon L,Gauvin F,Amre D K,et al.Serum procalcitonin and C-reactive protein levels as markers of bacterial Infection:a systematic review and meta-analysis[J].Serum Clin Infect Dis.,2004,39:206-217.
[3]World Health Organization (WHO).WHO report on infectious disease:overcoming antimicrobial resistance, Geneva:WHO,2000.
[4]James L L,Patrick J B,Brian M G,et al.Procalcitonin to Predict Bacterial Coinfection in Infants With Acute Bronchiolitis:A Preliminary Analysis[J].Pediatric E-mergency Care,2014,30(1):11-15.
[5]杨滨,康梅.降钙素原在细菌感染性疾病诊断及治疗中的应用[J].现代预防医学,2009,36(3):596-597.
[6]Parshetti G K,Lin F,Doong R.Sensitive amperometric immunosensor for α-fetoprotein detection based on multifunctional dumbbell-like Au-Fe3O4heterostructures [J].Sensors and Actuators:B,2013,186:34-43.
[7]Jiang W,Yuan R,Chai Y Q,et al.Amperometric immunosensor based on multiwalled carbon nanotubes/ Prussian blue/nanogold-modified electrode for determination of α-fetoprotein[J].Anal.Bioanal.,2010,407(1): 65-71.
[8]Liu K,Zhang JJ,Wang C,et al.Graphene-assisted dual amplification strategy for the fabrication of sensitive amperometric immunosensor[J].Biosens.Bioelectron, 2011,26(8):3627-3632.
[9]Ojeda I,Moreno-Guzmán M,González-Cortés A,et al. Electrochemical magneto immunosensor for the ultrasensitive determination of interleukin-6 in saliva and urine using poly-HRP streptavidin conjugates as labels for signal amplification[J].Anal Bioanal Chem,2014,DOI 10.1007/s00216-014-8055-6.
[10]Wang H,Wang E K.Fe3O4magnetic nanoparticles as peroxidase mimetics and their applications in H2O2and glucose detection[J].Anal.Chem.,2008,80(6):2250-2254.
[11]He W W,Liu Y,Yuan J,et al.Au@Pt nanostructures as oxidase and peroxidase mimetics for use in immunoassays[J].Biomaterials,2011,32(4):1139-1147.
[12]Shimomura T,Sumiya T,Onoa M,et al.Amperometric llactate biosensor based on screen-printed carbon electrode containing cobalt phthalocyanine,coated with lactate oxidase-mesoporous silica conjugate layer[J].Anal. Chim.Acta,2012,714:114-120.
[13]Wang K,Xu J J,Tang K S,et al.Solid-contact potentiometric sensor for ascorbic acid based on cobalt phthalocyanine nanoparticles as ionophore[J].Talanta,2005, 67:798-805.
[14]黄奕,陈永胜.石墨烯的功能化及其相关应用[J].中国科学B辑:化学,2009,39(9):887-896.
[15]Yang R,Ruan C M,Dai W L.Elect ropolymerization of thionine in neutral aqueousmedial and H2O2biosensor based on poly (Thionine)[J].Elect rochim Acta,1999, 44:1585-1596.
[16]Bartlett P N,Bradford V Q,Whitaker R G.Enzyme electrode studies of glucose-oxidase-modified with a redox mediator[J].Talanta,1991,38:57-63.
A signal amplification immunosensor based on nano-cobalt phthalocyanine modified graphene as a peroxidase simulated enzyme
Yang Zhe-han,Wang Juan,Zhuo Ying,Chai Ya-qin*
(School of Chemistry and Chemical Engineering,Southwest University,Chongqing 400715,China)
In this work,a signal-amplified electrochemical immunosensor based on cobalt phthalocyanine nanoparticles decorated graphene oxide nanocomposite (NanoCoPc/GO)was proposed for sensitive detection procalcitonin (PCT).Here,both cobalt phthalocyanine nanoparticles and graphene oxide exhibited an intrinsic enzyme mimetic activity similar to natural peroxidase.In the present of H2O2,an enhanced electrochemical signal was obtained as the catalysis of NanoCoPc/GO to H2O2.Importantly,NanoCoPc/GO as peroxidase mimetic applied to electrochemical amplification system could avoid the disadvantage of nature enzymes such as expensive and easily denatured by environmental changes.The proposed immunosensor showed good sensitivity for quantitative determination of PCT.
cobalt phthalocyanine nanoparticles;graphene oxide;procalcitonin;electrochemical immunosensor
0 引言
国家自然科学基金(51473136)资助
细菌感染在我国患病新生儿中占有相当比例,早期诊断和及时治疗能够有效提高诊疗水平和降低新生儿病死率[1]。但是,由于细菌感染与病毒感染、非感染引起炎症的症状非常相似,导致在临床中细菌感染很难被准确的诊断出来[2]。同时,对细菌感染的错误诊断可能会导致治疗费用的增加,抗生素的滥用以及其他过敏反应[3]。近年来,降钙素原(PCT)被认为是诊断细菌感染性疾病的可靠标志物[4]。当患者被细菌感染后,血液中PCT的量会急剧的增加,并且与感染的严重程度呈一定的相关性[5]。因此,可以通过有效检测患者血液中PCT的量从而判断是否是细菌感染。
电化学免疫传感器是将免疫识别和电化学分析方法相结合的一种新型的免疫分析方法。与
*通信联系人,E-mail:yqchai@swu.edu.cn其他分析方法相比,其具有专一性强、灵敏度高、检测快速和便于携带等优点[6]。近年来,已有许多致力于通过对检测信号的放大来进一步提高电化学免疫传感器的检测灵敏度的研究。常用的信号放大的方法有:利用纳米材料增加信号物质的固载量[7]、酶催化放大[8]、亲和素生物素系统放大[9]等。其中,酶催化放大策略运用最为广泛。但是,酶的活性受环境的影响非常大,同时价额昂贵,因此研究者们试图通过运用一些具有催化活性的纳米材料来取代天然酶。比如Fe3O4纳米颗粒[10],Pt纳米粒子[11]等。酞菁[12](CoPc)是一个18个π电子共轭的大环体系具有强烈的π-π电子作用。报道指出,酞菁钴具有过氧化物酶的模拟性质,可以催化H2O2氧化。但是,酞菁钴分子的溶解性差,在一定程度上限制了其应用研究,因此,人们开始转向酞菁钴纳米粒子的研究。酞菁钴纳米粒子不仅保有原有酞菁钴的特异性质,而且具有较好的溶解性质和催化性质。它能直接溶于水中与其他物质发生键合而形成配合物,大大扩大了其研究范围[13]。另外,石墨烯是目前备受瞩目的研究热点材料[14]。它是碳的二维结构,厚度只有0.335纳米,在室温下具有高速的电子迁移率。经强酸氧化后的氧化石墨烯表面引入了大量羟基,羧基和环氧基等氧基功能团。其表面的羟基,使得氧化石墨烯亲水性好,且具有较大的比表面积,增大了物质的固定量,已被广泛用于修饰电极。最近的报道指出,氧化石墨烯可以催化H2O2氧化。其这一性质还很少运用在电话学传感器构建中。
