小鼠牙囊细胞体外培养方法与形态特征探讨
2015-02-02吴补领段小红
王 贺,吴补领,段小红
(1.南方医科大学南方医院,南方医科大学口腔医学院,广东广州 510515;2.军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院口腔生物学教研室,陕西西安 710032)
小鼠牙囊细胞体外培养方法与形态特征探讨
王 贺1,2,吴补领1,段小红2
(1.南方医科大学南方医院,南方医科大学口腔医学院,广东广州 510515;2.军事口腔医学国家重点实验室,陕西省口腔医学重点实验室,第四军医大学口腔医院口腔生物学教研室,陕西西安 710032)
目的:探讨小鼠牙囊细胞的体外培养方法并观察其形态特征。方法:体视显微镜下分离出生3~5d仔鼠牙胚,用I型胶原酶消化后分离牙囊组织,采用酶消化-组织块法和二次酶消化法进行牙囊细胞的原代及传代培养,倒置显微镜下进行细胞形态学观察。结果:酶消化-组织块法经4~5d,部分组织块周围见细胞呈放射状爬出,2周后细胞集落仍难以汇合,无法传代。二次酶消化法第2天可见散在细胞集落形成,4~5d细胞接触汇合。传代发现,多角形细胞消失,第2代后梭形细胞占大多数,第3代细胞生长速度最快,第4代细胞增殖速度减慢,第5代后细胞趋于静止;随着传代次数的增加胞体逐渐增大,可出现一些树突形细胞。结论:采用二次酶消化法进行小鼠牙囊细胞原代培养可在短时间内获得较多的细胞,操作简便且成功率高,细胞形态随培养时间而变化多样。
小鼠牙囊细胞;二次酶消化法;细胞培养;方法学
[Chinese Journal of Conservativedentistry,2015,25(6):370]
牙囊(Dental follicle,DF)起源于外胚间充质,是包绕在成釉器周围和牙乳头底部呈囊状排列的结缔组织,其在牙齿萌出后期可形成牙骨质、牙周膜和固有牙槽骨。牙囊是牙萌出的必需条件之一[1],并在组织、细胞和分子等多个水平上调控牙齿的萌出[2-3]。Wise 等[4](1992)首次报道了采用改良组织块酶消化法进行大鼠牙囊细胞的体外培养,凌均棨等[5-6]、叶国[7]、刘晓辉等[8]也采用不同或类似的方法先后进行了大鼠牙囊细胞体外培养并取得成功。而小鼠牙囊细胞的原代分离培养仅有葛少华等[9-10]采用改良组织块培养法获得成功,国外尚未见相关报道。小鼠作为应用最广泛的模式动物之一,在牙萌出领域的研究中具有其他动物无法比拟的优势。但小鼠牙囊细胞的分离培养却较其他动物困难,大大限制了其应用范围。本实验通过比较酶消化-组织块法和二次酶消化法在小鼠牙囊细胞原代培养中的优缺点,以期为进一步研究牙囊细胞的生物学特性奠定基础。
1 材料和方法
1.1 主要试剂、仪器和实验动物
α-MEM培养基(Hyclone,美国);胎牛血清、胰蛋白酶(Gibco,美国);I型胶原酶(Sigma,美国);EDTA、青霉素、链霉素(西安科昊生物);丙酮酸钠(北京中生瑞泰);PBS(西安国安生物);细胞培养板(广州洁特);低速离心机(长沙湘仪);温控水浴机(上海精宏);超净工作台(Airtech,苏净安泰);细胞培养箱(Thermo Scientific,美国);倒置相差显微镜(Leica,德国);Balb/c仔鼠(第四军医大学实验动物中心)。
1.2 牙囊组织的分离和获取
参考Wise等[4]报道的方法并进行改进。取6只出生3~5d的Balb/c仔鼠,分别经脱颈法处死,750 mL/L乙醇浸泡消毒1 min后,外科法分离出完整下颌骨,并置于预冷的PBS(含100 U/mL青霉素和100 μg/mL链霉素)中。体视显微镜下剥离牙胚周围的骨组织,分离出各小鼠的下颌第一磨牙和第二磨牙牙胚,并置于预冷的α-MEM培养基中。收集所有牙胚置于200 μL(2g/L)I型胶原酶消化液中,37℃水浴20 min后,将牙胚转移至预冷的α-MEM培养基中;然后在体视显微镜下分离牙囊和成釉器,并将剥离出的牙囊组织立即置于预冷的α-MEM培养基中待用。
1.3 牙囊细胞的原代培养
1.3.1 酶消化-组织块法
取上述方法获得的牙囊组织,分散成小块后以0.5 cm的间距直接接种于24孔板,放置2~5 min待组织块稍干并贴壁后,每孔加入含胎牛血清(200 mg/L)、丙酮酸钠 (0.1g/L)、青霉素(100 U/mL)、链霉素(100 μg/mL)的 α -MEM 培养基各 500 μL(注意避免组织块浮起),置于37℃、50 mL/L CO2、饱和湿度条件下进行培养。次日轻吹悬浮未贴壁组织块,并用预温的培养基进行半量换液,倒置相差显微镜下观察;此后每2d半量换液1次,并严密观察细胞的状态,待细胞生长接近80%汇合时进行传代。
1.3.2 二次酶消化法
取上述获得的牙囊组织,用眼科剪剪成1 mm×1 mm×1 mm大小的组织块后,置于 500 μL(2g/L)Ⅰ型胶原酶消化液中,37℃水浴1 h,消化期间每10 min振荡1次悬浮组织。消化结束后,200目筛网过滤细胞悬液,1 000 r/min离心5 min,弃上清;沉淀部分用1 mL α-MEM培养基(配方同1.3.1)重悬后,接种于 24孔板,置于37℃、50 mL/L CO2、饱和湿度条件下进行培养。次日轻吹悬浮未贴壁细胞,并用预温的培养基进行半量换液,倒置相差显微镜下观察。此后每2d半量换液1次,待细胞生长接近80%汇合时,则进行传代。
1.4 牙囊细胞的传代培养和分离纯化
在上述原代培养中,酶消化-组织块法培养共进行29次,二次酶消化法培养共进行32次。传代时均加入2.5g/L胰蛋白酶和0.2g/L EDTA复合消化液,并置于37℃下消化8~20 min;当显微镜下观察到大部分细胞胞体收缩变圆,且部分细胞悬浮时,加入含血清的α-MEM培养基终止消化,并反复吹打20次(吹打过程中尽量避免产生气泡)。然后收集细胞悬液,1 000 r/min离心5 min,弃上清;沉淀的细胞用新鲜培养基重悬后,1∶2传代培养(培养条件与原代培养相同)。
1.5 倒置相差显微镜观察牙囊细胞
倒置相差显微镜下观察不同生长阶段细胞,拍照前4 h轻吹悬浮死亡细胞,然后更换预温新鲜培养基,置于孵箱中继续培养4 h后取出并拍照。
2 结果
2.1 牙囊细胞
酶消化-组织块法培养的牙囊细胞,24~48 h小部分组织块见细胞爬出,呈贴壁生长,第3~5天时爬出的细胞数量逐渐增多,成晕环状。细胞呈多突起的梭形和多角形,细胞核较大且位于中央,呈圆形或卵圆形。
二次酶消化法培养的牙囊细胞,培养基底部混杂大量组织碎屑,24 h后散在细胞集落生成,大小不均。细胞呈放射状或漩涡状生长,为典型的成纤维细胞。4~5d时细胞集落融合,铺满板底。细胞为多突起的梭形和多角形两种细胞群体,形态混杂且生长界限不清(图1a)。
2.2 细胞的传代和纯化
酶消化-组织块法体外培养10~14d后,细胞生长较为密集,传代消化发现,细胞贴壁牢固,加入消化液20 min后大部分胞体收缩变圆,细胞间隙变大、分离。常规中止消化、吹打、离心、重悬后,继续传代培养。传代细胞贴壁后生长几乎停滞,因长时间培养使细胞逐渐老化,无法生长汇合至实验所需的细胞量。
二次酶消化法培养4~5d细胞生长接近汇合后,加入消化液5~8 min后大部分胞体收缩变圆,细胞间隙变大、分离。常规中止消化、吹打、离心、重悬后,继续传代培养。12 h后细胞恢复形态并贴壁生长,大部分呈梭形,多角形细胞比例减少(图1b)。首次传代后,细胞生长速度加快,3~4d可再次传代。第3代细胞生长速度最快,2~3d时数量倍增,大小一致、胞体较丰满、立体感强、呈多形型,多角形细胞基本消失(图1c)。第4代细胞生长速度明显下降,细胞表面积变大,形态异型性明显,胞体趋于扁平,含2个胞核的细胞增多。第5代细胞生长接近停滞,表面积和形态变化、细胞间差异更为明显(图1d)。2.3 两种培养方法的比较
酶消化-组织块法培养进行29次,二次酶消化法培养33次,培养过程中前者污染4次(13.8%),后者污染 5 次(15.2%)。除去污染的样本,酶消化-组织块法:有6次培养的细胞群落生长至板底50%(表面积),占20.7%,传代后未出现细胞汇合,无法继续传代培养;二次酶消化法:原代培养4~5d均达到80%汇合率且能顺利传代,成功率100%。
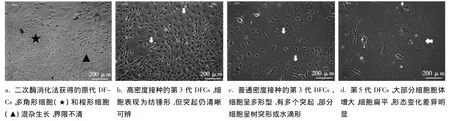
图1 倒置相差显微镜下不同培养代数小鼠牙囊细胞的形态特征(白色箭头示细胞突起,×100)
3 讨论
牙囊在牙萌出时期占据的天然重要位点使其在调节破骨和成骨平衡、牙槽骨活性、牙萌出发挥重要作用[11],牙囊通过在时间和空间上调节重要基因的表达,调节破骨细胞形成和骨生成[3]。无论是研究牙囊的多向分化[12]、牙周再生组织工程[13]还是牙萌出相关因子的作用[14],都需要以牙囊细胞成功的体外分离培养为基础。
以往的研究者多使用大鼠[4,15]牙囊细胞作为动物取材对象,培养方法涉及组织块法、酶消化-组织块法、酶消化法等(图2)。小鼠牙囊细胞体外培养较少,葛少华等[9]曾采用酶消化-组织块法获取原代培养小鼠牙囊细胞;Zhao M等尝试使用SV40[16]、HPV16 E6[17]等使小鼠牙囊细胞永生化,虽然此方法可获得充足的细胞量以方便研究,但永生化的牙囊细胞特异表型可能会发生一定的改变。
关于牙囊细胞的培养方法命名报道各异,较不统一,如改良组织块法、酶消化细胞分散法、牙囊直接剥离法和胶原酶-胰酶交替消化法等,不利于各研究结果之间的横向比较。本文基于国内外相关文献,从取材动物、牙囊的分离方法、牙囊细胞获取和接种特点等,将牙囊细胞的体外培养方法归为6类:酶消化-组织块法、二次酶消化法、二次酶消化-组织块法、酶消化法、组织块法、组织块-酶消化法(图2)。其核心步骤包括:①牙囊组织通过机械剥离还是酶消化后剥离;②剥离后的牙囊组织按组织块法还是酶消化法离散后接种。
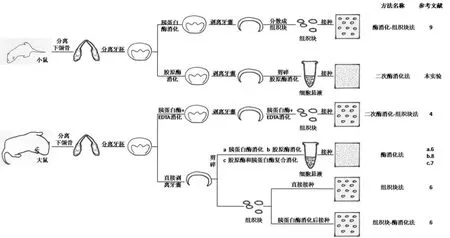
图2 小鼠和大鼠牙囊细胞不同体外分离培养方法及流程
1992年以来,国内外不同学者采用不同或类似的方法进行大鼠牙囊细胞的分离培养,并获得了较高的成功率。大鼠牙胚较大,可不经过酶消化从其表面直接剥离牙囊组织;小鼠牙胚细小,不经过消化处理难以将牙囊组织从成釉器表面剥离;由于小鼠牙囊组织量少,难以获得足够多的组织进行接种,并且细胞在传代后不易生长。本实验将小鼠牙囊细胞的酶消化-组织块法和二次酶消化法进行了对比验证。胰蛋白酶能选择性地水解由赖氨酸或精氨酸的羧基所构成的肽链,使细胞间的蛋白质水解而使细胞离散,其作用力强、消化程度不易掌握,本实验采用作用于细胞外基质胶原蛋白、效力柔和的I型胶原酶消化牙胚获取牙囊组织及后期的细胞分离。本结果显示,二次酶消化法更易于获得足够的细胞,并且还具有操作简便、成功率高、所需时间短等优点。采用二次酶消化法10d左右可得到第3代细胞,细胞量从1个24孔板孔可扩增到1个6孔板孔(而采用酶消化-组织块法一般需10~14d方能进行首次传代),此时细胞为较均质的群体,状态稳定,便于开展各项研究。
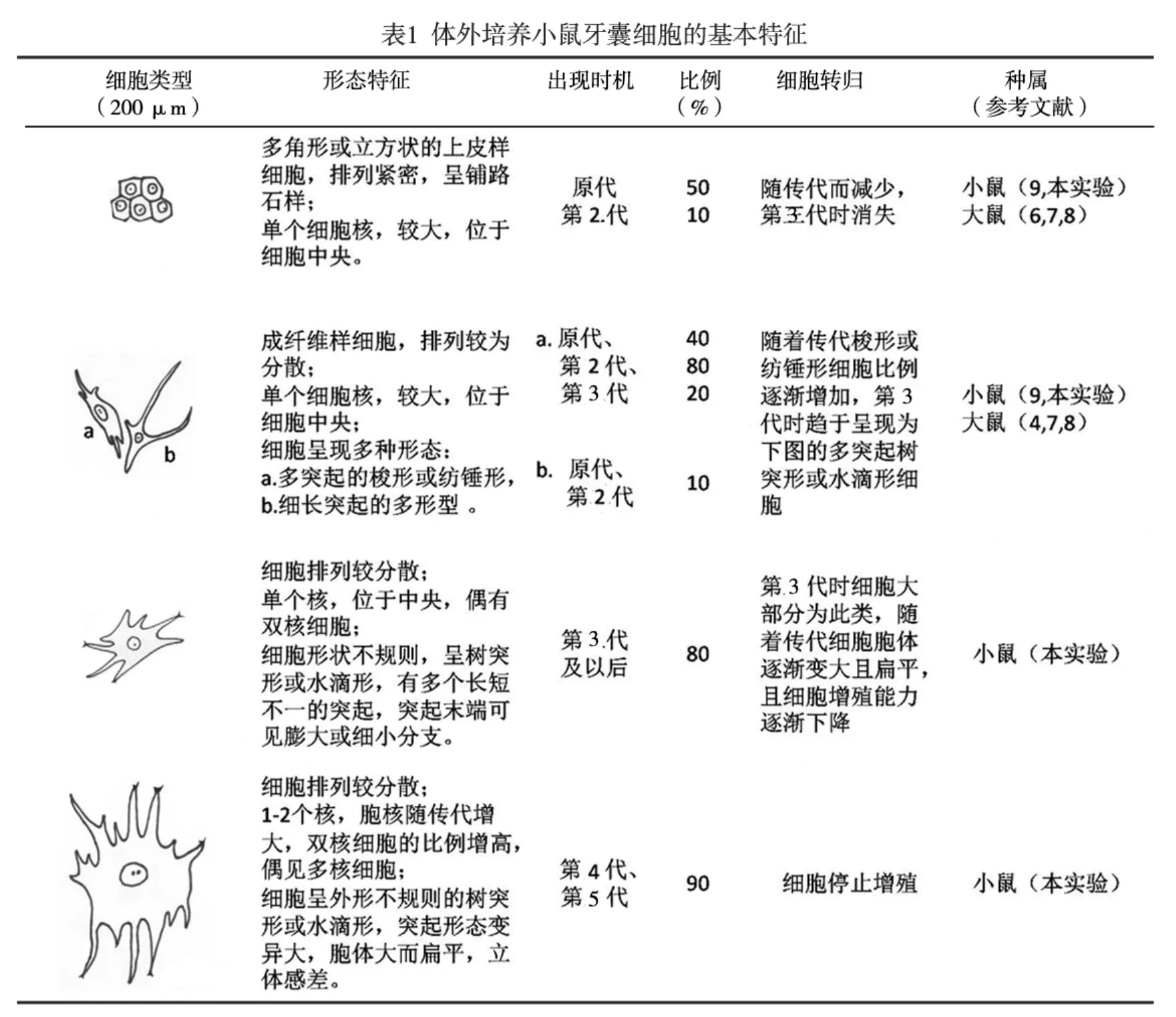
通过本实验及回顾文献,我们将体外培养牙囊细胞的形态归为4类(表1)。在细胞培养初期,多角形与梭形细胞并存,随着细胞传代次数的增加,多角形细胞减少,梭形细胞增多,后期可出现一些树突形或水滴形的细胞。本实验结果提示,小鼠牙囊细胞在原代培养和生长密度较高的时候才会呈现出规则的梭形或纺锤形(图1b),传代后普通密度体外培养时为多突起的不规则树突状或水滴状(图1c)。推测牙囊细胞丰富多样的细胞突起可能与其旺盛的分泌功能有关[18]。牙囊细胞是一种异质性的细胞群体[18],可能是导致细胞外在形态差异的原因.因此我们认为,细胞的接种密度、传代次数在很大程度上影响体外培养的牙囊细胞形态。第4代以后细胞形态逐渐发生较大变化,因此建议应选用状态最佳的第3代小鼠牙囊细胞进行各类实验。
[1]Larson EK,CahilldR,Gorski JP,et al.The effect of removing the truedental follicle on premolar eruption in thedog[J].Arch Oral Biol,1994,39(4):271 -275.
[2]WisegE,Frazier- Bowers S,D'Souza RN.Cellular,molecular,andgeneticdeterminants of tooth eruption[J].Crit Rev O-ral Biol Med,2002,13(4):323 -334.
[3]WisegE.Cellular and molecular basis of tooth eruption[J].Orthod Craniofac Res,2009,12(2):67 -73.
[4]WisegE,Lin F,Fan W.Culture and characterization ofdental follicle cells from rat molars[J].Cell Tissue Res,1992,267(3):483-492.
[5]凌均棨,谷海晶,高燕,等.大鼠牙囊细胞体外培养技术的建立及其鉴定[J].华西口腔医学杂志,2004,22(1):19-22.
[6]谷海晶,凌均棨,杜宇.大鼠牙囊细胞培养方法的探讨[J].中山大学学报:医学科学版,2007,28(5):586-589.
[7]叶国.大鼠牙囊细胞体外培养方法的改良及生物学特性的初步研究[D].四川大学硕士学位论文,2007.
[8]刘晓辉,文玲英,方军,等.差速传代纯化大鼠牙囊细胞[J].实用口腔医学杂志,2007,23(1):12-14.
[9]葛少华,李德懿,杨丕山.小鼠牙囊细胞的体外分离培养鉴定及异质性研究[J].上海口腔医学,2004,13(06):506-509.
[10]葛少华,杨丕山,赵宁,等.小鼠牙囊细胞的体外培养及表型特征[J].华西口腔医学杂志,2005,23(05):415-417.
[11]WisegE,KinggJ.Mechanisms of tooth eruption and orthodontic tooth movement[J].Jdent Res,2008,87(5):414-434.
[12]Pan K,Sun Q,Zhang J,et al.Multilineagedifferentiation ofdental follicle cells and the roles of Runx2 over-expression in enhancing osteoblast/cementoblast-relatedgene expression indental follicle cells[J].Cell Prolif,2010,43(3):219-228.
[13]guo S,Guo W,Ding Y,et al.Comparative study of humandental follicle cell sheets and periodontal ligament cell sheets for periodontal tissue regeneration[J].Cell Transplant,2013,22(6):1061-1073.
[14]Pan K,Yan S,Ge S,et al.Effects of core binding factor alpha1 or bone morphogenic protein-2 overexpression on osteoblast/cementoblast-relatedgene expressions in NIH3T3 mouse cells anddental follicle cells[J].Cell Prolif,2009,42(3):364-372.
[15]Yao S,Norton J,WisegE.Stability of cultureddental follicle cells[J].Cell Prolif,2004,37(3):247-254.
[16]Zhao M,Xiaog,Berry JE,et al.Bone morphogenetic protein 2 inducesdental follicle cells todifferentiate toward a cementoblast/osteoblast phenotype[J].J Bone Miner Res,2002,17(8):1441-1451.
[17]Yao S,Norton J,WisegE.Stability of cultureddental follicle cells[J].Cell Prolif,2004,37(3):247-254.
[18]Yokoi T,Saito M,Kiyono T,et al.Establishment of immortalizeddental follicle cells forgenerating periodontal ligament in vivo[J].Cell Tissue Res,2007,327(2):301 -311.
[19]gorski JP,Marks SJ,CahilldR,et al.Developmental changes in the extracellular matrix of thedental follicleduring tooth eruption[J].Connect Tissue Res,1988,18(3):175 -190.
[20]Luan X,Ito Y,Dangaria S,et al.Dental follicle progenitor cell heterogeneity in thedeveloping mouse periodontium[J].Stem Cellsdev,2006,15(4):595 -608.
Exploration of culture method and morphological characteristics of mousedental follicle cells in vitro
WANG He*,WU Bu-ling,DUAN Xiao-hong
(*Nanfang Hospital,Southern Medical University,College of Stomatology,Southern Medical University,Guangzhou 510515,China)
AIM:To explore the culture method of mousedental follicle cells(DFCs)in vitro and to observe their morphological characteristics.METHODS:Dentalgerms from 3-5days postnatal mice weredigested with type I collagenase and thedental follicle tissues weredissected by enzyme isolation-tissue explant and twice-enzyme isolation.The morphology of the cultureddFCs was observed under inverted microscope.RESULTS:At the 4 th-5 thday in vitro,several cells were extended from part of the tissue explants and were hardly to fuse even after 2 weeks'culture.The method of enzyme isolation-tissue explant was failed because of unable to passage and amplify the cells while the method of twice-enzyme isolationgot a success rate of about 85%.Scatteredgroups of cells were seen at the secondday and they fused at the 4 th-5 thday in vitro by way of twice-enzyme isolation.Polygonal and spindle cell populations coexisted in primary culture.Almost all polygonal cellsdisappeared in subculture,and spindle cells became the majority of cell population.The cells of third passagegrew fastest,then sloweddown and tended to stop in the fourth and fifth passage,respectively.After several times of passage,the cells became larger and polymorphic in shape,somedendrite -like cells were observed.CONCLUSION:The method of twice-enzyme isolation may havest considerable cells in a short time with a high success rate.Morphology ofdFCs is changed with the culture time and is multiple.
mousedental follicle cells;twice-enzyme isolation;cell culture;methodology
R780.2
B
1005-2593(2015)06-0370-05
10.15956/j.cnki.chin.j.conserv.dent.2015.06.009
2014-11-04
国家自然科学基金(81271116)
王 贺(1990-),男,汉族,广东揭阳人。硕士生(导师:吴补领,段小红)
吴补领,E -mail:bulingwu@smu.edu.cn
段小红,E -mail:xhduan@fmmu.edu.cn
