对立的双生子:基于疼痛的安慰剂效应和反安慰剂效应机制*
2015-02-01邓潇斐郭建友
邓潇斐 罗 非 郭建友
(1中国科学院心理研究所 心理健康院重点实验室, 北京 100101) (2中国科学院大学, 北京 100049)
1 介绍
安慰剂(Placebo, 拉丁文, I will please)一词最早出现于5世纪初期, 源于St Jerome在将圣经从希伯来原文翻译成拉丁文的过程中, 把第 116篇赞美诗的第9行的第1个单词误译成Placebo。到了13世纪, 由于当时葬礼上雇佣的哭丧者经常唱诵这错译的第9行, 于是人们开始用placebo来形容用于取悦他人的虚假行为(Finniss, Kaptchuk,Miller & Benedetti, 2010)。1955 年, Henry Beecher发表了他的经典著作《强大的安慰剂》, 宣称35%的患者能从安慰剂治疗中获益, 引起了公众对安慰剂效应的广泛关注。目前对于安慰剂效应的应用主要集中在临床实验和新药开发领域, 将安慰剂控制组应用于随机对照实验, 以排除心理因素对治疗手段或者药物的实际效果的影响。与此同时, 安慰剂效应本身作为一种研究心理对神经生理调节作用的重要模型, 也得到了日益密切的关注。
与此同时, 一个与安慰剂效应性质完全相反的效应亦存在——反安慰剂效应(Nocebo effect)。反安慰剂(Nocebo)一词来源于拉丁文“I shall harm”, 又名消极安慰剂或阴性安慰剂(Negative placebo), 最初由Walter Kennedy (1961)提出, 可以使用检测安慰剂效应相同的方法检测出来。例如在早期的临床试验中, 让一组病人服用惰性药物并对药物给予负面评价, 会出现病情恶化的现象。这个是由于接受药物的病人对于药物的效力抱有消极的预期, 从而产生了反安慰剂效应。与安慰剂效应相比, 反安慰剂效应获得的关注要少得多, 因此我们对它依旧知之甚少。
安慰剂和反安慰剂效应已被证实能对多种疾病障碍和感觉刺激产生影响, 譬如帕金森病(Keitel et al., 2013; Benedetti et al., 2003)、肠胃疾病(Lee,Hsieh, Lu, Yeh, & Tu, 2012; Musial, Klosterhalfen,& Enck, 2007)、疲惫(Pollo, Carlino & Benedetti,2008)、疼痛(Colloca & Grillon, 2014)、瘙痒(Bartels et al, 2014; Van Laarhoven et al.,2011)等, 目前对安慰剂和反安慰剂效应的研究主要集中于疼痛领域, 这是因为实验性疼痛刺激具有可控、无创的特点, 被认为是研究安慰剂和反安慰剂效应的最好实验模型(Colloca, Sigaudo, & Benedetti, 2008)。本文综述了目前主要来自疼痛领域的关于安慰剂和反安慰剂的研究成果, 以期有助于揭示二者的作用机制和内在联系, 为临床研究、新药开发提供指导。
2 心理机制
2.1 条件反射
条件化是建立安慰剂和反安慰剂效应的重要方法, 通过将条件刺激(如药片的形状和颜色)与无条件刺激(如药片的有效药理作用)进行多次联结后, 使得条件刺激单独出现就能诱发与有效药物接近甚至相同的效果, 即产生安慰剂/反安慰剂效应。Voudouris, Peck和Coleman (1985)首先将条件化方法应用于安慰剂领域的研究, 在实验前阶段, 先对被试施予伤害性电刺激以检测其痛阈;在调整阶段, 给被试皮肤上涂抹一种惰性药膏,同时偷偷降低刺激强度, 造成“药膏具有镇痛作用”的假象; 正式实验时, 在被试的同一皮肤区域涂抹上述药膏, 并给予原始强度的电刺激。结果发现, 与在调整阶段中给予惰性药膏但没有建立条件反射的一组相比, 在建立起条件反射的一组中, 药膏表现出显著的镇痛效应。该结果表明通过将降低的刺激强度和惰性药膏建立联结可以使药膏产生镇痛作用, 即安慰剂效应。
同样的条件化手段也可以应用于反安慰剂的研究, 例如, Jensen等(2012)通过将有差异的提示图片与强度不同的热痛刺激进行反复结合, 形成条件化。当呈现低强度热痛刺激的提示时给予中等强度的刺激, 会引起镇痛效应, 即产生安慰剂效应; 当呈现高强度热痛刺激的提示时给予中等强度的刺激时, 会引起痛敏效应, 即产生反安慰剂效应。值得关注的是, 在该研究的另一组实验中, 提示图片呈现后12 ms立即会被掩蔽物遮挡,使得被试无法有意识地识别出可视线索, 在这种情况下, 依然出现了显著的安慰剂和反安慰剂效应, 由此可见条件化在安慰剂和反安慰剂形成中的重要作用。
2.2 预期
预期(expectancy)是凭借经验推测某种结果或某种期待中的效应发生的可能性, 是介导安慰剂和反安慰剂效应的重要心理因素。影响预期的因素有很多, 譬如暗示(Pollo et al., 2001; Gracely,Dubner, Deeter, & Wolskee, 1985)、医患关系(Klinger,Colloca, Bingel, & Flor, 2014; Benedetti, 2013;Kaptchuk et al., 2008)、先前经验(Colloca, &Benedetti, 2009; Price, Finniss, & Benedetti, 2008;Colloca et al., 2008; Colloca & Benedetti, 2005)等。
暗示可以分为语言暗示和非语言暗示。通过给被试以积极或消极的指导语, 可以产生相应的预期, 从而引发症状的减轻或加重, 这在很多研究中已经得到印证(Keitel et al., 2013; Van Laarhoven et al., 2011; Pollo et al., 2001)。Gracely 等(1985)发现增加医生的治疗信心会影响安慰剂的镇痛效果, 即使医生并没有将这一想法用言语或其他方式传递给患者, 这在一定程度上体现了非言语暗示的作用。
其次, 良好的医患关系也有助于患者对治疗效果形成积极正面的预期(Klinger et al., 2014;Benedetti, 2013), Kaptchuk等(2008)比较了在两种医患关系下安慰剂治疗效果的差异, 发现与在公事公办的医患关系环境下相比, 在医患关系积极融洽的情况下进行安慰剂针灸治疗的效果要更好,意味着医生与患者间的治疗性互动能够影响安慰剂的效果。
再次, 有研究者提出安慰剂和反安慰剂效应是受先前经验影响的学习现象(Price et al., 2008;Colloca & Benedetti, 2005), 若被试有过治疗成功或者失败的记忆, 会影响被试对治疗结果的预期,进而影响安慰剂或反安慰剂的效果(Colloca,Sigaudo et al., 2008; Colloca et al., 2008)。例如,Colloca和Benedetti (2006)在一项研究中比较了在药物有效的先前经验下和药物无效的经验下的安慰剂效应, 发现相比后者而言, 前者表现出更强的安慰剂效应, 且这一效应能持续数天。此外, 除了亲身经历, 对于安慰剂治疗效果的经验还可以通过社会观察学习获得(Colloca & Benedetti, 2009;Hunter, Siess, & Colloca, 2014), 这在反安慰剂效应的研究(Vögtle, Barke, & Kröener-Herwig, 2013;Swider & Babel, 2013)中同样得到了证实, 说明社会观察是获得治疗效果预期的重要途径。
综上所述, 预期和条件化是形成安慰剂和反安慰剂效应的两种重要方式, 预期被认为是有意识的认知加工过程, 而条件化则被认为是无意识的过程。一些研究者试图探索预期和条件化在诱导安慰剂和反安慰剂效应中的不同之处(Benedetti et al., 2003; Amanzio & Benedetti, 1999; Price &Barrell, 1999)。有研究(Amanzio & Benedetti, 1999)证实镇痛预期触发了内源性阿片肽的释放, 而条件化则涉及到不同的子系统, 其中阿片条件化(吗啡)所引起的安慰剂镇痛效应由内源性阿片肽介导, 与非阿片条件化(酮咯酸)引发的镇痛效应在生理机制上有所不同。Benedetti等(2003)在安慰剂和反安慰剂效应的研究中发现, 无论是积极预期还是消极预期都对荷尔蒙(生长激素和皮质醇)的分泌无效, 但能够影响疼痛和运动表现; 与之相反, 利用sumatriptan (5-HT1B/1D受体激动剂, 能够刺激生长激素和皮质醇的分泌)建立起的条件反射诱导出的安慰剂效应可以显著降低血液中生长激素和皮质醇的浓度水平, 且该效应不能被负面预期所逆转。这一结果表明, 条件化介导了安慰剂和反安慰剂效应中不受意识控制的生理功能,例如荷尔蒙分泌; 而预期则介导了其中有意识的生理过程, 例如疼痛和运动表现。总之, 预期和条件化是形成安慰剂和反安慰剂效应的两种途径,但二者并不是非此即彼的关系。事实上, 在临床实践中, 安慰剂/反安慰剂效应的引发往往并不是条件化或者预期的单独作用, 而是二者乃至更多因素的共同作用。
3 生化机制
3.1 安慰剂镇痛的生化机制
疼痛是研究安慰剂/反安慰剂效应的重要切入点, 关于安慰剂/反安慰剂效应的内在生化机制的关键性突破多来自于该领域, 因此受到研究者们广泛的重视。Levine, Gordon和Fields (1978)首次提出了安慰剂的镇痛作用是由内源性阿片肽系统所介导的, 是安慰剂研究领域的突破性进展。其后, Petrovic, Kalso, Petersson和Ingvar (2002)首先采用正电子发射断层扫描(PET)以探索安慰剂镇痛的神经机制, 通过检测区域性脑血流(regional cerebral blood flow, rCBF)发现, 由阿片类药物和安慰剂所产生的镇痛效应具有相似的脑活动, 主要体现在前扣带回喙部(rACC)和脑干活动水平的增加。该结果在后来的神经影像学研究中得到了进一步的证实, 为阿片系统在安慰剂镇痛效应中的参与提供了强有力的证据(Eippert et al., 2009;Kong et al., 2008; Bingel, Lorenz, Schoell, Weiller,& Büchel, 2006; Zubieta et al., 2005; Wager et al.,2004)。随着安慰剂机制研究的深化, Petrovic等(2010)指出阿片类镇痛药和安慰剂镇痛的机制并非是完全相同的, 阿片镇痛是通过调控下行疼痛抑制通路来实现的, 而安慰剂镇痛则是基于新皮层自上而下的机制。
μ阿片受体在安慰剂效应中有着极其重要的地位, 很多研究者(Qiu, Wu, Xu, & Sackett, 2009;Scott et al., 2007; Wager, Scott, & Zubieta, 2007;Zubieta et al., 2005; Petrovic et al., 2002)在影像学研究中发现疼痛背景下的安慰剂效应与脑内μ阿片受体的激活程度有关。本实验室在阿片类安慰剂镇痛模型的基础之上, 通过在大鼠 rACC脑区微注射三种主要的阿片受体拮抗剂, 以检测其作用的阿片受体, 发现只有特异性 μ受体拮抗剂CTOP能够阻断安慰剂镇痛效应, 并表现出剂量依赖效应(Zhang, Zhang, Wang, & Guo, 2013)。这表明阿片类安慰剂镇痛效应至少在大鼠中仅仅通过μ阿片受体介导。
安慰剂效应可以分为阿片和非阿片成分, 该理论由 Fields和 Levine (1984)首次提出, 随后在Amanzio和 Benedetti (1999)的研究中得到证实,通过条件化、预期以及二者的结合作用来研究不同心理机制下安慰剂镇痛效应的生理基础, 结果发现, 预期所引发的安慰剂镇痛可以完全被阿片肽拮抗剂纳洛酮所阻断; 利用吗啡进行镇痛条件化所引起的安慰剂效应也可以被纳洛酮阻断; 与之相对的是, 由非甾体抗炎药酮咯酸所建立起的条件化所引发的安慰剂镇痛不受纳洛酮的影响;而将酮咯酸条件化与预期联合作用时产生的镇痛效应可以部分被纳洛酮阻断。这一结果提示镇痛预期触发了内源性阿片肽的释放, 而条件化则涉及到不同的子系统, 其中阿片条件化(吗啡)所引起的安慰剂镇痛效应由内源性阿片肽介导, 与非阿片条件化引发的镇痛效应机制不同。这一现象在动物实验中也得到了印证(Guo, Wang, & Luo,2010)。在上述研究的基础上, Benedetti, Amanzio,Rosato和 Blanchard (2011)首次在实验中证明了rimonabant (大麻素 CB1受体拮抗剂)能够完全阻断由非阿片条件化引起的安慰剂镇痛效应, 提示通过非阿片条件化建立起的安慰剂镇痛效应可能是由内源性大麻素系统所介导的。随后, Benedett,Thoen, Blanchard, Vighetti和 Arduino (2013)发现纳洛酮和 rimonabant(大麻受体拮抗剂)可以分别不完全地抑制安慰剂的镇痛效果, 而将二者联合使用则能够完全阻断安慰剂效应, 为大麻素在安慰剂效应的非阿片成分中的关键性作用提供了有力佐证。除此之外, 安慰剂的其他可能的非阿片机制将在本节内容的第四部分给予具体阐述。
3.2 反安慰剂痛敏的生化机制
与安慰剂效应获得的广泛关注相比, 少有人愿意将目光驻留在反安慰剂效应上, 这使得对反安慰剂内在作用机制的探索要相对滞后。Harrington(1999)在他的书中这样写道:“在我看来, 只要我们能通过研究充分了解安慰剂效应, 便能自然而然地获知反安慰剂效应是如何产生的。”持有相同观点的研究者曾一度不在少数, 他们认为, 安慰剂和反安慰剂就好像同一个硬币的正反两面, 一个表现为积极的结果, 另一个为消极的结果, 但脑内支持这两个效应的机制是相同的。然而,Benedetti, Amanzio, Casadio, Oliaro和Maggi (1997)在一项研究中得出了与该观点相悖的结论, 该研究结果显示, 疼痛背景下的反安慰剂效应是由胆囊收缩素(cholecystokinin, CCK)而非内源性阿片肽所介导的, 证明反安慰剂是由不同于安慰剂的神经机制所驱动的。
胆囊收缩素是一种脑/肠激素, 其不仅在协调胃肠活动方面起多种作用, 同时还作为一种神经肽而广泛地存在于脑内, 通过与 CCK-A和CCK-B受体的结合而在情绪和认知功能的调节中起着重要作用。人类和动物研究均已证实CCK对焦虑以及疼痛的调节起着重要的作用(Hebb, Poulin,Roach, Zacharko, & Drolet, 2005; Benedetti &Amanzio, 1997)。例如, Andre等(2005)在大鼠的社会失败模型的研究中发现, 焦虑会引起疼痛过敏,而这种疼痛过敏可以被 CI-988(CCK-B的选择性受体拮抗剂)和苯二氮卓类抗焦虑药 chlordiazepoxide所抵消, 暗示CCK可能是处于焦虑和疼痛过敏反应之间的中介变量。该结果对反安慰剂的研究有极大的启发意义, 之前就有研究者(Benedetti et al., 1997; Benedetti & Amanzio, 1997)怀疑反安慰剂痛敏反应是由于对疼痛的预期性焦虑, 诱发了脑内 CCK的释放, 从而引起疼痛阈限的下降。Benedetti, Amanzio, Vighetti和Asteggiano (2006)证实了这个猜想, 在该研究中作者发现, 苯二氮卓类药物不仅能抵消反安慰剂所导致的痛敏反应,并可以阻断典型的由焦虑引起的“下丘脑−垂体−肾上腺素轴” (HPA 轴)的过度激活; 而 proglumide(CCK受体非选择性拮抗剂)仅能够阻断反安慰剂所引起的疼痛过敏, 而对HPA轴的活动水平无影响。作者推论, 对疼痛的消极预期导致被试产生焦虑情绪, 焦虑作为上游机制能够同时激活两条相对独立的下游通路:HPA轴与CCK系统, 苯二氮卓类药物作用于焦虑本身, 因此可以同时抑制这两条通路的激活, 而proglumide仅作用于CCK系统, 因此只阻断了疼痛过敏反应而不能抑制 HPA轴的过度激活。该结果表明CCK系统特异地参与了反安慰剂痛敏效应的疼痛成分, 而没有参与焦虑成分, 证实了预期性焦虑是导致反安慰剂痛敏反应的关键因素, 二者之间存在着密切的关联。
有一种理论认为在反安慰剂治疗下疼痛阈限的降低依赖于脑干活动的增强, 该区域参与了疼痛信号输入的调节。众所周知, 在延髓喙端腹内侧(RVM, rostroventral medulla)区域存在着一种启动神经元(on-cell), 该神经元会在机体痛反应出现前突然增加放电, 增强伤害性信息的传递(Fields, 2004)。由于CCK可以直接激活启动神经元(Heinricher & Neubert, 2004), 故有人推测疼痛背景下的反安慰剂现象是由于延髓处的兴奋性神经环路易化了脊髓传来的疼痛信号传递, 从而导致疼痛过敏(Manchikanti, Giordano, Fellows, &Hirsch, 2011)。
3.3 疼痛背景下二者生化机制的联系
众所周知, CCK是目前已知的效应最强的内源性抗阿片肽, 而CCK受体与阿片受体在神经系统中有着相似的分布, 暗示二者间可能存在着密切的交互作用(Gall, Lauterborn, Burks, & Seroogy,1987; Gibbins, Furness, & Costa, 1987)。当内源性阿片系统呈现过度激活状态时, 会触发负反馈调节机制, 将促进中枢CCK的基因表达和生物合成(Bertolini, 1995)。因此, CCK和阿片肽在神经系统中此消彼长的相互作用、相对平衡在决定机体的疼痛感受中起着关键作用(Xie et al., 2005;Pommier et al., 2002)。先前的研究(Wang, Wang, &Han, 1990)发现CCK-8可以对抗μ和κ阿片受体激动剂的镇痛作用, 却不能对抗 δ激动剂的镇痛作用, 而前文提到吗啡条件化引起的安慰剂镇痛仅由μ阿片受体介导, 暗示CCK可能选择性地参与了安慰剂效应。在(Benedetti, 1996; Benedetti,Amanzio, & Maggi, 1995)的安慰剂研究中发现,proglumide能够增强安慰剂镇痛效应, 而 CCK-B受体激动剂 pentgastrin则会阻断对吗啡条件化引起的安慰剂镇痛(Benedetti, Amanzio, & Thoen,2011)。结合以上所述, 我们可以得出这样一个模型:在疼痛背景下, 内源性阿片肽和内源性胆囊收缩素这两种神经递质系统分别介导了安慰剂镇痛效应和反安慰剂痛敏效应(Enck, Benedetti, &Schedlowski, 2008), 积极的预期(疼痛减轻)可以激活内源性阿片肽系统, 产生安慰剂镇痛; 消极的预期(疼痛增加)则会触发内源性胆囊收缩素系统, 从而引起反安慰剂痛敏(见图1)。
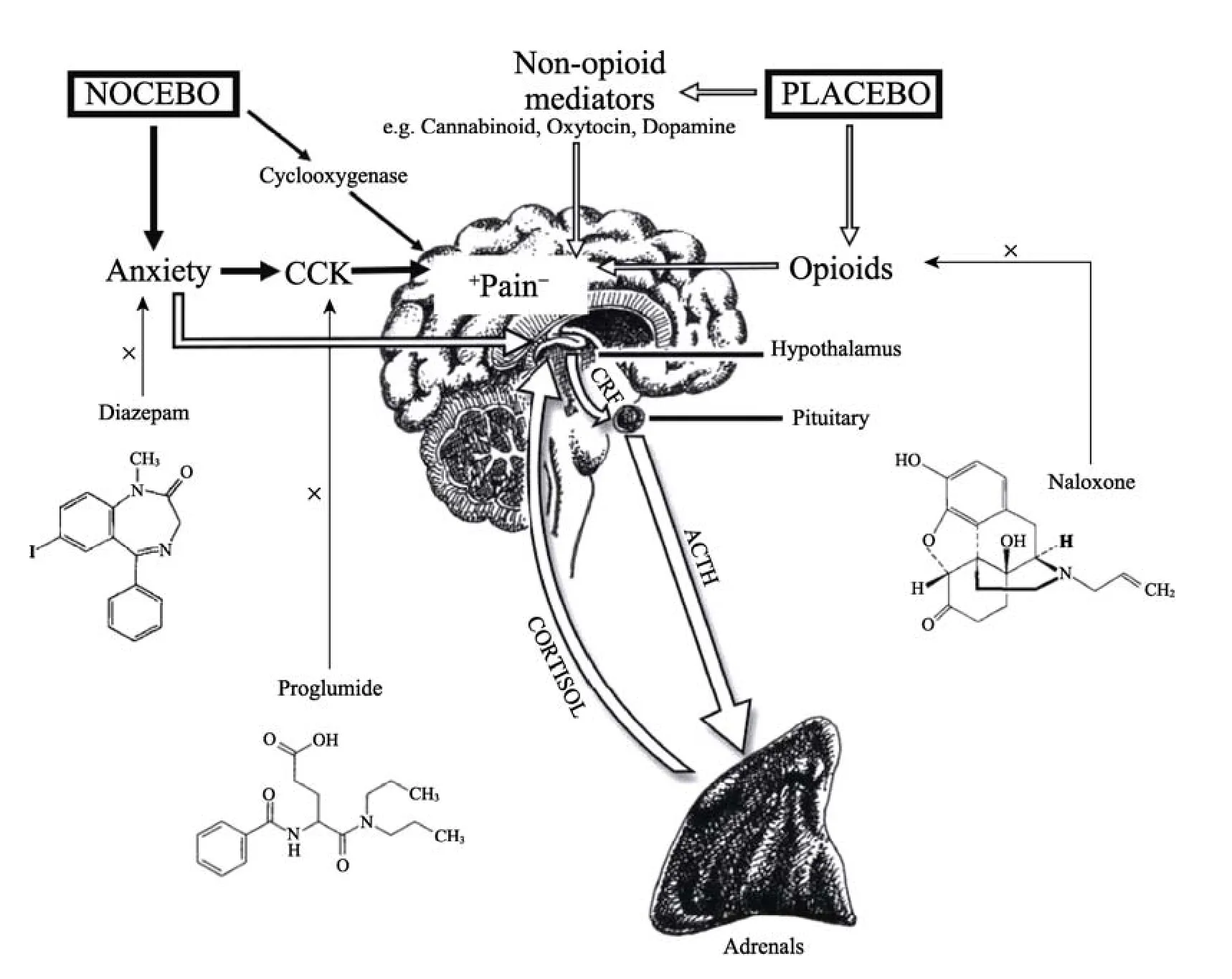
图1 安慰剂与反安慰剂对疼痛的调节
3.4 其他
除了阿片肽、大麻素和胆囊收缩素之外, 其他几种神经信号分子也参与了对安慰剂/反安慰剂效应的调控, 并且不仅仅局限于疼痛领域。
多巴胺系统能够调节多种认知、行为和感觉运动功能, 尤其在奖赏机制中扮演重要角色。一些研究者(de la Fuente-Fernández et al., 2002; de la Fuente-Fernández et al., 2001)在探索帕金森病治疗中的安慰剂效应的机制时发现, 帕金森病的安慰剂效应是由脑内纹状体处的内源性多巴胺的释放所介导的, 并且多巴胺释放量越大, 安慰剂效应越强。考虑到多巴胺在奖赏机制中的作用, 多巴胺的参与应该与患者对奖赏——即从治疗中获益的期待有关(de la Fuente-Fernández et al., 2002)。由于患者期待痊愈的心态在各类疾病的治疗中广泛存在, 预期相关的多巴胺释放在各种治疗背景下的安慰剂效应中可能是一个普遍现象。该推测得到了 Scott等人(2008, 2007)研究结果的支持和补充, 通过正电子发射断层扫描(PET), 发现当被试在安慰剂状态下受疼痛刺激时, 会激活在疼痛相关脑区的 μ阿片受体以及伏隔核的多巴胺D2/D3受体; 与此相反, 在反安慰剂条件下, μ阿片受体以及多巴胺受体在上述脑区都呈现去激活状态。这一结果暗示脑内涉及奖赏和动机神经环路也参与了安慰剂/反安慰剂对疼痛的调节。
催产素(oxytocin)是一种由大细胞性神经分泌细胞释放的神经激素, 其在共情、信任和社会学习中起了重要作用(Meyer-Lindenberg, Domes,Kirsch, & Heinrichs, 2011), 提高催产素的分泌水平可以帮助社交场合因羞涩而受人冷落之人克服社交羞涩感, 从而使人更加积极地参与社交活动。Kessner, Sprenger, Wrobel, Wiech和 Bingel(2013)发现催产素也参与了安慰剂的镇痛过程。在该研究中, 作者通过鼻腔给被试施以催产素和生理盐水, 发现在安慰剂组中, 接受催产素的被试的疼痛强度显著低于接受生理盐水的被试, 而在控制组中二者无差异, 首次证明了催产素能够有效提高安慰剂效应。考虑到催产素能够提高共情和信任, 而这些恰恰是构成良好的医患关系的要素, 能够影响安慰剂效应的强度(Kaptchuk et al.,2008), 这一结果的产生可能是因为催产素增强了实验参与者对主试指导语的信任程度, 进而影响了安慰剂镇痛的效果。
环氧合酶(Cyclooxygenase, COX)是负责合成重要的生物激素——前列腺素(PG, prostaglandins)家族的导介物质。当身体组织受到某种刺激如外伤、感染时会活化环氧合酶, 使花生四烯酸大量转变为诸如 PGE2、PGI2和血栓素(thromboxane)等前列腺素。因此, 环氧合酶-前列腺素通路在疼痛尤其是炎症痛的调控中具有极其重要的地位(Ghilardi, Svensson, Rogers, Yaksh, & Mantyh,2004; Svensson & Yaksh, 2002)。最近在Benedetti,Durando, & Vighetti (2014)的一项研究证明环氧合酶-前列腺素通路对安慰剂和反安慰剂效应都有调节作用。该研究在海拔3500米处进行, 在此低压缺氧的环境下可能会诱发头痛症状。进行正式实验前, 实验者依据被试对高海拔环境诱发头痛的相关负面信息了解程度为筛选标准挑选出反安慰剂组和控制组, 结果发现, 反安慰剂组被试的疼痛发生概率及其疼痛程度都显著大于控制组,并且都随着对负面信息了解程度的增加而增加。同时, 被试唾液中前列腺素和血栓素含量都显著增加, 表明负面预期提高环氧合酶的活性。有趣的是, 对头痛患者给予安慰剂治疗可以抵消掉低压缺氧性头痛中的反安慰剂成分, 并抑制前列腺素的合成。该结果首次证明了安慰剂和反安慰剂能够影响前列腺素的合成, 暗示安慰剂效应和非甾体类镇痛药物可能有着相同的生化通路。
综上所述, 安慰剂/反安慰剂效应受到多种神经化学途径的调节, 包括阿片肽、胆囊收缩素、大麻素、多巴胺、催产素以及前列腺素, 这在一定程度上反映了多种心理因素在其中的参与。然而, 目前对参与安慰剂/反安慰剂的各类神经递质和信号因子的研究仍然相对孤立, 仅从一种神经递质或者一种心理机制出发, 尚不足以对临床实践中错综复杂的现象做出充分解释。因此, 未来的研究应着眼于整体, 了解各种生化系统在其中的交互作用, 以尽可能获得安慰剂/反安慰剂效应的生化机制的全貌。
4 正负性预期调节疼痛的脑机制
4.1 安慰剂镇痛相关脑区
有人认为, 安慰剂效应仅仅是一种报告偏差。事实真是如此吗?
神经影像学研究表明, 安慰剂镇痛时被试报告的疼痛评分减轻往往伴随着大脑疼痛加工区域活动水平的降低, 包括丘脑(thalamus), 岛叶(insula),前扣带回(ACC)以及躯体感觉皮层(somatosensory cortex) (Schenk, Sprenger, Geuter, & Büchel, 2014;Wager & Atlas, 2013; Meissner et al., 2011; Lu et al., 2010; Kong et al., 2006; Wager et al., 2004), 而在以临床病人为被试的安慰剂研究(Price, Graggs,Verne, Perlstein, & Robinson, 2007; Craggs, Price,Verne, Perlstein, & Robinson, 2007)中也发现了疼痛相关脑区的去激活。这些研究证明了安慰剂效应并不仅仅是主观上的疼痛体验上的改变, 而具备客观的神经生理基础。丘脑作为疼痛信号上行传导通路的中转站, 其在安慰剂镇痛过程中活动水平的降低(Geuter, Eippert, Hindi Attar, & Büchel,2013; Kong et al., 2006; Wager et al., 2004 )暗示疼痛信号的抑制可能发生在疼痛信息加工更早期阶段。
安慰剂效应依赖于脑内自上而下的认知调节机制, 涉及到皮层-边缘系统-脑干的多个脑区的激活, 其中以下几个脑区在多个研究中被反复提及——背外侧前额叶(DLPFC)、前扣带回嘴侧(rACC)和中脑导水管周围灰质(PAG) (Kong et al.,2006; Bingel et al., 2006; Wager et al., 2004; Petrovic et al., 2002)。在疼痛的研究中, 这一调节机制被认为是由内源性阿片系统所驱动的(Eippert et al.,2009; Kong et al., 2006; Bingel et al., 2006; Zubieta et al., 2005; Petrovic et al., 2002), 疼痛相关的认知信号可以激活皮层和脑干的阿片网络, 并且rACC和 PAG的活动有很高的一致性, 暗示下行的 rACC/PAG/RVM 疼痛调制通络可能参与安慰剂镇痛。此外, 来自影像学研究也肯定了诸如眶额(OFC) (Wager et al., 2007; Wager et al., 2004)、岛叶(Kong et al., 2006; Wager et al., 2007)等皮层以及杏仁核(amygdala) (Craggs, Price, Perlstein,Nicholas Verne, & Robinson, 2008; Bingel et al.,2006)、伏隔核(NAc) (Scott et al., 2007, 2008;Zubieta et al., 2005)、脑桥(Pons) (Bingel et al.,2006; Wager et al., 2004; Petrovic et al., 2002)等皮下结构在疼痛预期中的作用。进一步的功能连接分析揭示了在安慰剂条件下一些脑区间存在着功能耦合, 例如镇痛预期在DLPFC启动(Lui et al.,2010)并与 ACC产生联结(Derbyshire, & Oakley,2013; Petrovic et al., 2010; Wager et al., 2007;Craggs et al, 2007), 根据二者联结的强度能够预测安慰剂效应的大小。
前额叶被认为是预期调节疼痛体验的触发机制。利用经颅磁(TMS)刺激(Krummenacher, Candia,Folkers, Schedlowski, & Schönbächler, 2010)对前额叶进行暂时性抑制, 以及在阿尔兹海默症研究(Benedetti, Arduino et al., 2006)中患者额叶的退行性变化都能导致安慰剂镇痛效果的削减乃至完全丧失, 足可见前额叶的作用不可或缺。值得注意的是, 前额叶在安慰剂效应中的激活可能存在时间上的特异性, 有些功能成像研究(Derbyshire &Oakley, 2013; Lui et al., 2010; Watson et al., 2009;Wager et al., 2004)更是把前额叶的激活锁定在对伤害性刺激的预期而非感受阶段, 其中DLPFC和OFC的BOLD信号在疼痛刺激来临前的预期阶段的显著增强被广泛地报道。Petrovic等(2010)认为前额叶负责对预期发生的伤害与错误信号的编码,阿片镇痛是预期的伤害和疼痛输入相符, 而安慰剂是预期和疼痛输入不符合(incongruent), 这种不相符将会以某种错误信号的形式表现出来, 这与外侧眶额皮层的激活相关, 并安慰剂特异地投射到ACC进而激活下行的阿片系统。
ACC是和疼痛、情绪相关的重要脑区, 在编码痛情绪中具有枢纽地位——它与多个脑区有大量的纤维联系, 包括丘脑、岛叶、后扣带皮层和前额叶, 使得疼痛的躯体感觉、认知过程、注意及初步的情绪机制在此整合(Price & Bushnell,2004)。早期的行为学和电生理研究都证实,作为痛觉中枢的ACC脑区广泛参与了预期过程。近年来的神经影像学研究(Kong et al., 2006;Wager et al.,2004; Petrovic et al., 2002)观察到 ACC, 尤其是rACC在安慰剂相关的预期活动中被激活。进一步的功能连接分析揭示了ACC的激活与脑干(PAG、Pons)活动存在共变关系(Eippert et al., 2009; Wager et al., 2007; Bingel et al., 2006; Petrovic et al., 2002),证明 ACC参与了安慰剂对疼痛的自上而下的认知调控, 并在其中起到了关键作用。所以说, 在安慰剂相关的脑活动中, ACC通过对脑干的投射,对疼痛信息施加一个阿片依赖的下行抑制, 继而影响了疼痛加工的更早期阶段(例如 RVM,脊髓),从而缓解疼痛。
我们尝试着对安慰剂效应做出一个较为完整的解释:对疼痛刺激的预期加工起始于前额叶,并通过阿片依赖的信号发放, 投射到 ACC, 该区域可通过投射参与疼痛下行控制系统的更低部分(更低部分包括下丘脑、PAG、RVM), 这些部分会对脊髓的疼痛加工施加一个阿片相关的抑制性影响, 导致输入到丘脑和皮层的疼痛信号减弱, 使得疼痛加工相关脑区去激活, 进而降低疼痛体验。
4.2 反安慰剂痛敏相关脑区
相比较安慰剂的研究而言, 反安慰剂相关的神经影像学研究起步较晚, 也相对稀缺, 但这并不妨碍我们对其神经机制进行尝试性的初步阐述。作为预期调节疼痛的另一方向, 反安慰剂在神经机制上与安慰剂存在着很多相同之处。例如在一项PET研究中, Scott等(2008)发现安慰剂与反安慰剂的神经活动在空间上的重叠, 以及相关脑区在激活方向上的对立——安慰剂的镇痛效果伴随着 μ阿片受体在前扣带回(ACC)、眶额皮层(OFC)、岛叶(IC)、伏隔核(NA)、杏仁核和中脑导水管周围灰质(PAG)的激活, 以及多巴胺受体在伏隔核的激活。相反, 在反安慰剂作用下, μ阿片受体在上述脑区以及多巴胺受体在伏隔核处都呈现去激活状态。这一结果似乎对进行反安慰剂研究的必要性提出了挑战, 因为既然二者在神经机制上是一致的, 只不过表达的方向相反, 那么大量的、成熟的安慰剂研究成果已经足以为反安慰剂的内在神经机制提供证据。对此, 有研究者(Kong et al., 2008)对Scott等的研究结果提出了质疑, 他们认为该研究的实验设计似乎是以验证安慰剂效应为出发点, 而并没有真正地引起反安慰剂效应, 因此其反安慰剂相关结果的意义是有待商榷的。同年, Kong等(2008)在反安慰剂的fMRI研究中发现内侧痛觉系统(疼痛的情感-认知通路)的优先激活, 包括双侧 ACC、岛叶、右侧眶额皮层以及右侧前额叶, 这在一定程度上印证了前人(Benedetti et al., 2006)对焦虑在反安慰剂效应中重要作用的描述。然而, 若要证明反安慰剂效应在脑活动上的确有别于安慰剂效应, 仅仅是内侧痛觉系统的激活并不具有足够的说服力, 因为这一激活模式在安慰剂的影像学研究中并不罕见。该研究最重要的发现是海马(hippocampus)在反安慰剂条件下特异的激活, 并得到 Bingel等(2011)进一步研究的支持, 证明当被试处于无预期或者正性预期条件下时, 不能观察到海马的激活。海马作为边缘系统的重要组成部分, 与情绪加工和记忆编码紧密相关。有研究(Ploghaus et al., 2001)发现, 海马参与了焦虑对疼痛的调节, 当焦虑增加时, 海马会放大疼痛信号以适应可能出现的最坏的结果。因此, 海马在反安慰剂中特异的激活和焦虑在消极预期中的参与是相符的, 并明确了反安慰剂在脑机制上和安慰剂的不同之处。另一个值得注意的脑区是岛叶。岛叶主要和痛的情绪成分有关, 并参与伤害性刺激引起的内脏反应以及痛相关的学习和记忆, 属于内侧痛觉系统(王锦琰, 罗非, 韩济生, 2004)。大量研究表明, 当被试在安慰剂条件下受到伤害性刺激会导致岛叶的去激活状态(Schienle, Übel, Schöngaßner, Ille, &Scharmüller, 2014; Wager, Atlas, Leotti, & Rilling,2011; Eippert et al., 2009; Kong et al., 2008; Wager et al., 2007; Wager et al., 2004), 被认为是安慰剂效应最佳的观测指标之一。与在安慰剂效应中恰恰相反的是, 在反安慰剂效应中, 消极预期状态下的被试接受疼痛刺激时岛叶的活动水平是显著增加的(Schmid et al, 2013; Rodriguez-Raecke et al.,2010)。例如Schmid等(2013)在内脏痛病人的研究中发现, 持有正性预期的患者相比持中性预期的患者而言, 其岛叶、躯体感觉皮层和杏仁核呈去激活状态; 而消极预期会增加岛叶的激活。岛叶的这种激活模式与反安慰剂在躯体痛上的研究结果相吻合(Kong et al., 2008; Bingel et al., 2011;Rodriguez-Raecke et al., 2010)。因此, 两种预期下岛叶激活方向上的对立表明, 岛叶是预期调节疼痛的重要敏感脑区, 从其激活方向上可以预测疼痛是减轻还是加重。
除此之外, Bingel等(2011)在一项fMRI研究中比较了分别给予不同组的被试对同一种镇痛药物(remifentanil)的积极预期、无预期和消极预期后,不同组别的被试在应对疼痛时脑活动的变化。结果发现, 反安慰剂条件下被试的在疼痛相关脑区(MCC、岛叶、丘脑、SI)的激活水平要显著大于安慰剂组, 证明二者确实在疼痛感受上存在差异;而安慰剂组被试在DLPFC、ACC、纹状体和岛盖的活动水平要高于反安慰剂组。此外, 在海马、杏仁核、MPFC和小脑的激活上, 反安慰剂组的BOLD信号也要强于安慰剂组。
我们对上述内容做一个简单总结。首先, 反安慰剂与安慰剂在脑活动上存在一定程度的交叉,但具体的激活模式可能有所不同, 例如其在疼痛相关脑区激活方向的对立:在疼痛感受阶段, 安慰剂降低痛觉系统的激活, 而反安慰剂增加疼痛加工区域的活动, 这与两种预期造成的主观疼痛感受上的差异以及脊髓上的双向调节是一致的。其次, 海马在反安慰剂中的激活具有特异性, 表明两种预期调节疼痛的潜在机制并非是完全重叠的。最后, 尽管在反安慰剂研究中少有单独强调杏核仁的作用, 但考虑到杏仁核在预期焦虑和恐惧中的重要参与, 是否其在疼痛背景下的消极预期中也有特殊地位?这有待未来研究的检测。
4.3 脊髓水平的双向调节
脊髓是中枢神经系统的一部分, 是脑和躯体之间相互传递信息的主要通道, 其中包含有携带着躯体感觉(如痛觉)上行到脑的轴突, 因此在伤害性信息的传递和调节中发挥着重要的作用。由于疼痛的下行抑制系统介导了预期对疼痛的调节(Eippert et al., 2009; Wager et al., 2004), 很多研究者认为疼痛在脊椎水平上的活动应该会受到安慰剂/反安慰剂效应的调节。Matre, Casey和Knardahl(2006)采取了巧妙的实验设计首次证明了镇痛预期能够影响脊髓的伤害性刺激加工。在该实验中,通过对被试前臂皮肤进行持续五分钟的接触性热刺激, 诱发被试产生继发性痛觉过敏(secondary hyperalgesia) (指局部没有病理因素的对外周刺激的敏感性增高现象, 普遍认为是脊椎背角神经元的敏化造成的), 随后对向实验组被试介绍一种没有实际作用的磁力镇痛疗法, 并用其给予被试虚假的镇痛治疗。结果发现, 安慰剂能够显著减少表现出疼痛过敏的皮肤的面积, 暗示安慰剂确实影响了脊椎水平的疼痛加工。此外, Goffaux, Redmond,Rainville和Marchand (2007)的电生理研究也为安慰剂/反安慰剂在脊髓水平的调控提供了佐证, 他们首先对被试的腓肠神经给予经皮电刺激, 记录其躯体感觉诱发脑电位(Somatosensory-evoked brain potentials,简称SEP)及主观疼痛评分, 并在其股二头肌处用肌电图仪(EMG, electromyograph )记录其诱发的伤害性脊髓屈肌反射(The nociceptive flexion reflex)的振幅; 接着采用对抗刺激(counterirritation)的方式(将被试的手浸入冰水里)激活弥漫性伤害抑制性控制(diffuse noxious inhibitory controls, 简称 DNIC)系统, 并告诉其中一组被试把手浸入冰水能有效缓解经皮电刺激的疼痛(安慰剂组), 而告诉另一组被试相反的信息, 即对抗刺激会加剧疼痛(反安慰剂组), 然后让两组对预期的疼痛进行评分。结果表明, 在皮层水平上, 被试的SEP和主观评分都与预期评分保持一致; 而在脊髓水平上, 对抗刺激引发的 DNIC在安慰剂组极大地抑制了屈肌反射的肌电振幅, 而在反安慰剂组, 屈肌反射的肌电振幅与对抗刺激程序实施前没有差异, 也就是说, 负性预期完全阻断了DNIC的疼痛抑制作用。该研究证明了安慰剂/反安慰效应不仅仅是皮层活动的附带现象, 而且与疼痛的下行抑制系统产生了交互作用, 脊髓在预期调节疼痛过程中发挥的作用不容忽视。随后Goffaux, de Souza, Potvin 和 Marchand (2009)在纤维组织肌痛(fibromyalgia, 简称 FM, 患者被认为存在下行抑制功能的缺失)病人身上重复了上述实验步骤, 发现安慰剂降低了被试的主观疼痛评分与 SEP的振幅, 并与预期评分显著相关, 证明了预期改变了丘脑-皮层的疼痛反应。然而, 尽管出现了镇痛体验, 安慰剂组的 FM 病人屈肌反射的振幅反而增加了; 在反安慰剂组, 病人屈肌反射的振幅也增加了, 但是增加的幅度与预期评分并不相关。因此, 在FM病人中, 脊椎的过度兴奋是普遍的, 不能被归因为预期效应。该研究证明了预期调节疼痛的脊髓成分和脊髓以上成分是可以分离的, 在没有脊髓参与的情况下安慰剂依然能够发生效应。值得注意的是, 该研究并没有否定脊髓在安慰剂镇痛中的作用, 但是确定了脊髓以上机制已经足够产生镇痛/痛敏体验。
更直观的证据来源于人类脊椎 fMRI的扫描结果, Eippert, Finsterbusch, Bingel和 Büchel (2009)发现安慰剂会在降低主观疼痛评分的同时极大地减少对应受刺激区域的身体同侧背角的BOLD信号, 并认为这种下行的疼痛控制是以门控的方式由阿片系统所驱动的(Eippert et al., 2009; Eippert,Finsterbusch et al., 2009)。而对于反安慰剂研究,Geuter和Büchel (2013)用相似的方法发现反安慰剂操作引起了脊髓C5/C6(对应受刺激区域的身体同侧)的BOLD信号的强烈激活, 并使疼痛阈限降低。这些结果强调了预期的正性和负性调节效应从额叶到脊髓的延伸, 并证实了早期的假设。综合这两个研究证实了这样一个观点:自上而下的机制参与了疼痛加工在中枢神经系统的最早期阶段, 安慰剂和反安慰剂在脊椎水平双向调节疼痛。
综上, 安慰剂/反安慰剂能够作用于疼痛的下行抑制系统, 甚至可以直接影响脊髓背角神经元对伤害性信息的传递。也就是说, 伤害性信息在上传到达中枢的疼痛相关系统之前, 就已经受到了调节。因此, 心理过程能对疼痛的性质和强度发挥巨大的调制作用。
5 总结与展望
安慰剂与反安慰剂是预期的对立双生子, 二者的既有共同之处, 也存在种种差异。近10年来,随着技术方法的不断革新以及人们对于安慰剂和反安慰剂越来越广泛的关注, 使得我们对于这两种预期调节方式的了解愈加深刻。在本文中, 我们总结了安慰剂和反安慰剂的心理机制和生理机制, 力求从整体的角度完整地诠释这种特殊的身心交互现象, 希望能对进一步的科学研究和临床治疗提供一定的借鉴和指导意义。
疼痛作为一种可控的、无创的实验室病理模型, 并且其神经机制已经被研究得较为透彻, 因而在安慰剂/反安慰剂的研究中具有绝对的优势而被频繁地探讨。但不得不说, 这种优势同时也束缚了安慰剂效应的研究向其他病理背景的延伸,使得我们对于疼痛背景之外的安慰剂效应缺乏完整的了解, 例如在临床用药上也存在着很多针对不同病理背景的安慰剂/反安慰剂效应(心血管药物、镇静催眠药、胃肠道用药, 等等),它们的内在机制又如何呢?和疼痛背景下的安慰剂/反安慰剂效应的作用机制有多大程度的重叠?从目前的研究现状来看, 非疼痛背景下的安慰剂/反安慰剂效应相关研究存在以下问题:第一, 更多作为一种实验对照手段而非研究对象, 常常被研究者忽略。因此尽管在多种临床用药的实验研究中提及了安慰剂, 其中真正探讨安慰剂内在机制的研究却并不多见。第二, 研究相对较少, 且分散在各种疾病或感知觉研究领域中, 难以相互借鉴。第三,研究相对较肤浅、缺乏相应的机制探讨。非疼痛领域的安慰剂/反安慰剂效应研究更多是在描述现象, 而缺乏对该类病症或感知觉背景下安慰剂/反安慰剂机制的深入挖掘, 多是浅尝辄止, 停留在认知层面。而在认知水平上, 各种疾病或者感知觉背景中的安慰剂/反安慰剂效应的心理机制在大多数情况下是缺乏特异性的。所以, 未来的研究应致力于拓展安慰剂/反安慰剂效应所针对的病理或感知觉背景, 使我们能够从更全面的角度诠释这种独特的身心交互现象。
同时必须指出的是, 尽管近年来关于预期调节疼痛的研究成果颇丰, 但在其领域内仍存在许多问题尚未明了。首先, 受到目前实验技术的限制, 多数研究只能看到短时乃至瞬间的神经递质发放或者脑活动, 而很多机制是在更长的时间范围内起作用的。未来的研究应该着眼于临床实际,确定安慰剂/反安慰效应的时间进程及其在更长的时间跨度中的形成机制。其次, 相比较人类研究, 动物实验往往能提供更加独特的视角, 安慰剂效应在以动物为对象的研究上已经取得了一些重要成果(Zhang et al., 2013; Nolan, Price, Caudle,Murphy, & Neubert, 2012; Guo et al., 2009), 而在反安慰剂效应中还没有起步。但动物研究对于了解安慰剂/反安慰剂效应具有深远意义, 应该加以重视:第一, 反安慰剂效应受限于伦理因素, 其临床研究更加难以展开, 而在动物研究中这一阻力相对较小; 第二, 对于一些具有重大临床意义但缺乏足够数量的人类被试的疾病的安慰剂/反安慰剂研究, 可以用相对应的动物模型代替; 第三,动物研究在技术上的可操作性要大于人类研究,为更加深入地挖掘安慰剂/反安慰剂内在机制提供可能。总之, 未来的研究应该立足于更全面的视角, 力图使得我们对于安慰剂和反安慰剂的研究与临床实践和日常生活结合得更加紧密, 为其提供现实可靠的帮助和指导。
王锦琰, 罗非, 韩济生. (2004). 前扣带回在痛感知中的作用.中国疼痛医学杂志, 10(2), 113–116.
Amanzio, M., & Benedetti, F. (1999). Neuropharmacological dissection of placebo analgesia: Expectation-activated opioid systems versus conditioning-activated specific subsystems.The Journal of Neuroscience, 19(1), 484–494.
Andre, J., Zeau, B., Pohl, M., Cesselin, F., Benoliel, J. J., &Becker, C. (2005). Involvement of cholecystokininergic systems in anxiety-induced hyperalgesia in male rats:Behavioral and biochemical studies.The Journal of Neuroscience, 25(35), 7896–7904.
Bartels, D. J. P., van Laarhoven, A. I. M., Haverkamp, E. A.,Wilder-Smith, O. H., Donders, A. R. T., van Middendorp,H., ... Evers, A. W. (2014). Role of conditioning and verbal suggestion in placebo and nocebo effects on itch.PLoS ONE, 9(3), e91727.
Benedetti, F. (1996). The opposite effects of the opiate antagonist naloxone and the cholecystokinin antagonist proglumide on placebo analgesia.Pain, 64(3), 535–543.
Benedetti, F. (2013). Placebo and the new physiology of the doctor-patient relationship.Physiological Reviews, 93(3),1207–1246.
Benedetti, F., & Amanzio, M. (1997). The neurobiology of placebo analgesia: From endogenous opioids to cholecystokinin.Progress in Neurobiology, 52(2), 109–125.
Benedetti, F., Amanzio, M., Casadio, C., Oliaro, A., &Maggi, G. (1997). Blockade of nocebo hyperalgesia by the cholecystokinin antagonist proglumide.Pain, 71(2), 135–140.
Benedetti, F., Amanzio, M., & Maggi, G. (1995). Potentiation of placebo analgesia by proglumide.The Lancet, 346(8984),1231.
Benedetti, F., Amanzio, M., Rosato, R., & Blanchard, C.(2011). Nonopioid placebo analgesia is mediated by CB1 cannabinoid receptors.Nature Medicine, 17(10), 1228–1230.
Benedetti, F., Amanzio, M., Vighetti, S., & Asteggiano, G.(2006). The biochemical and neuroendocrine bases of the hyperalgesic nocebo effect.The Journal of Neuroscience,26(46), 12014–12022.
Benedetti, F., Amanzio, M., & Thoen, W. (2011). Disruption of opioid-induced placebo responses by activation of cholecystokinin type-2 receptors.Psychopharmacology,213(4), 791–797.
Benedetti, F., Arduino, C., Costa, S., Vighetti, S., Tarenzi, L.,Rainero, I., & Asteggiano, G. (2006). Loss of expectationrelated mechanisms in Alzheimer’s disease makes analgesic therapies less effective.Pain, 121(1–2), 133–144.
Benedetti, F., Durando, J., & Vighetti, S. (2014). Nocebo and placebo modulation of hypobaric hypoxia headache involves the cyclooxygenase-prostaglandins pathway.Pain®,155(5), 921–928.
Benedetti, F., Pollo, A., Lopiano, L., Lanotte, M., Vighetti,S., & Rainero, I. (2003). Conscious expectation and unconscious conditioning in analgesic, motor, and hormonal placebo/nocebo responses.The Journal of Neuroscience,23(10), 4315–4323.
Benedetti, F., Thoen, W., Blanchard, C., Vighetti, S., &Arduino, C. (2013). Pain as a reward: Changing the meaning of pain from negative to positive co-activates opioid and cannabinoid systems.Pain®, 154(3), 361–367.
Bertolini, A. (1995). The opioid/anti-opioid balance in shock:A new target for therapy in resuscitation.Resuscitation,30(1), 29–42.
Bingel, U., Lorenz, J., Schoell, E., Weiller, C., & Büchel, C.(2006). Mechanisms of placebo analgesia: rACC recruitment of a subcortical antinociceptive network.Pain, 120(1–2),8–15.
Bingel, U., Wanigasekera, V., Wiech, K., Mhuircheartaigh,R. N., Lee, M. C., Ploner, M., & Tracey, I. (2011). The effect of treatment expectation on drug efficacy: Imaging the analgesic benefit of the opioid remifentanil.Science Translational Medicine, 3(70), 70ra14–70ra14.
Colloca, L., & Benedetti, F. (2005). Placebos and painkillers:Is mind as real as matter?.Nature Reviews Neuroscience,6(7), 545–552.
Colloca, L., & Benedetti, F. (2006). How prior experience shapes placebo analgesia.Pain, 124(1–2), 126–133.
Colloca, L., & Benedetti, F. (2009). Placebo analgesia induced by social observational learning.Pain®, 144(1–2),28–34.
Colloca, L., & Grillon, C. (2014). Understanding placebo and nocebo responses for pain management.Current Pain and Headache Reports, 18(6), 1–7.
Colloca, L., Sigaudo, M., & Benedetti, F. (2008). The role of learning in nocebo and placebo effects.Pain, 136(1–2),211–218.
Colloca, L., Tinazzi, M., Recchia, S., Le Pera, D., Fiaschi,A., Benedetti, F., & Valeriani, M. (2008). Learning potentiates neurophysiological and behavioral placebo analgesic responses.Pain, 139(2), 306–314.
Craggs, J. G., Price, D. D., Perlstein, W. M., Nicholas Verne,G., & Robinson, M. E. (2008). The dynamic mechanisms of placebo induced analgesia: Evidence of sustained and transient regional involvement.Pain, 139(3), 660–669.
Craggs, J. G., Price, D. D., Verne, G. N., Perlstein, W. M., &Robinson, M. M. (2007). Functional brain interactions that serve cognitive–affective processing during pain and placebo analgesia.Neuroimage, 38(4), 720–729.
de la Fuente-Fernández, R., Phillips, A. G., Zamburlini, M.,Sossi, V., Calne, D. B., Ruth, T. J., & Stoessl, A. J. (2002).Dopamine release in human ventral striatum and expectation of reward.Behavioural Brain Research, 136(2), 359–363.
de la Fuente-Fernández, R., Ruth, T. J., Sossi, V., Schulzer,M., Calne, D. B., & Stoessl, A. J. (2001). Expectation and dopamine release: Mechanism of the placebo effect in parkinson's disease.Science, 293(5532), 1164–1166.
Derbyshire, S. W. G., & Oakley, D. A. (2013). A role for suggestion in differences in brain responses after placebo conditioning in high and low hypnotizable subjects.Pain,154(9), 1487–1488.
Eippert, F., Bingel, U., Schoell, E. D., Yacubian, J., Klinger,R., Lorenz, J., & Büchel, C. (2009). Activation of the opioidergic descending pain control system underlies placebo analgesia.Neuron, 63(4), 533–543.
Eippert, F., Finsterbusch, J., Bingel, U., & Büchel, C. (2009).Direct evidence for spinal cord involvement in placebo analgesia.Science, 326(5951), 404–404.
Enck, P., Benedetti, F., & Schedlowski, M. (2008). New insights into the placebo and nocebo responses.Neuron,59(2), 195–206.
Fields, H. (2004). State-dependent opioid control of pain.Nature Reviews Neuroscience, 5(7), 565–575.
Fields, H. L., & Levine, J. D. (1984). Placebo analgesia—a role for endorphins?.Trends in Neurosciences, 7(8),271–273.
Finniss, D. G., Kaptchuk, T. J., Miller, F., & Benedetti, F.(2010). Biological, clinical, and ethical advances of placebo effects.The Lancet, 375(9715), 686–695.
Gall, C., Lauterborn, J., Burks, D., & Seroogy, K. (1987).Co-localization of enkephalin and cholecystokinin in discrete areas of rat brain.Brain Research, 403(2), 403–408.Geuter, S., & Büchel, C. (2013). Facilitation of pain in the human spinal cord by nocebo treatment.The Journal of Neuroscience, 33(34), 13784–13790.
Geuter, S., Eippert, F., Hindi Attar, C., & Büchel, C. (2013).Cortical and subcortical responses to high and low effective placebo treatments.Neuroimage, 67, 227–236.
Ghilardi, J. R., Svensson, C. I., Rogers, S. D., Yaksh, T. L., &Mantyh, P. W. (2004). Constitutive spinal cyclooxygenase-2 participates in the initiation of tissue injury-induced hyperalgesia.The Journal of Neuroscience, 24(11),2727–2732.
Gibbins, D. I. L., Furness, J. B., & Costa, M. (1987).Pathway-specific patterns of the co-existence of substance P, calcitonin gene-related peptide, cholecystokinin and dynorphin in neurons of the dorsal root ganglia of the guinea-pig.Cell and Tissue Research, 248(2), 417–437.
Gracely, R. H., Dubner, R., Deeter, W., & Wolskee, P. J.(1985). Clinicians’ expectations influence placebo analgesia.The Lancet, 325(8419), 43.
Goffaux, P., de Souza, J. B., Potvin, S., & Marchand, S. (2009).Pain relief through expectation supersedes descending inhibitory deficits in fibromyalgia patients.Pain®, 145(1–2),18–23.
Goffaux, P., Redmond, W. J., Rainville, P., & Marchand, S.(2007). Descending analgesia – When the spine echoes what the brain expects.Pain, 130(1–2), 137–143.
Guo, J. -Y., Wang, J. -Y., & Luo, F. (2010). Dissection of placebo analgesia in mice: the conditions for activation of opioid and non-opioid systems.Journal of Psychopharmacology,24(10), 1561–1567.
Harrington, A. (1999).The placebo effect: An interdisciplinary exploration. Cambridge: Harvard University Press.
Hebb, A. L. O., Poulin, J. -F., Roach, S. P., Zacharko, R. M.,& Drolet, G. (2005). Cholecystokinin and endogenous opioid peptides: Interactive influence on pain, cognition,and emotion.Progress in Neuro-Psychopharmacology and Biological Psychiatry, 29(8), 1225–1238.
Heinricher, M. M., & Neubert, M. J. (2004). Neural basis for the hyperalgesic action of cholecystokinin in the rostral ventromedial medulla.Journal of Neurophysiology, 92(4),1982–1989.
Hunter, T., Siess, F., & Colloca, L. (2014). Socially induced placebo analgesia: A comparison of a pre-recorded versus live face-to-face observation.European Journal of Pain,18(7), 914–922.
Jensen, K. B., Kaptchuk, T. J., Kirsch, I., Raicek, J.,Lindstrom, K. M., Berna, C., ... Kong, J. (2012).Nonconscious activation of placebo and nocebo pain responses.Proceedings of the National Academy of Sciences of the United States of America, 109(39), 15959–15964.
Kaptchuk, T. J., Kelley, J. M., Conboy, L. A., Davis, R. B.,Kerr, C. E., Jacobson, E. E., … Lembo, A. J. (2008).Components of placebo effect: Randomised controlled trial in patients with irritable bowel syndrome.British Medical Journal, 336(7651), 999–1003.
Keitel, A., Wojtecki, L., Hirschmann, J., Hartmann, C. J.,Ferrea, S., Südmeyer, M., & Schnitzler, A. (2013). Motor and cognitive placebo-/nocebo-responses in Parkinson's disease patients with deep brain stimulation.Behavioural Brain Research, 250, 199–205.
Kennedy, W. P. (1961). The nocebo reaction.Medical World,95, 203–205.
Kessner, S., Sprenger, C., Wrobel, N., Wiech, K., & Bingel,U. (2013). Effect of oxytocin on placebo analgesia: A randomized study.JAMA, 310(16), 1733–1735.
Klinger, R., Colloca, L., Bingel, U., & Flor, H. (2014).Placebo analgesia: Clinical applications.Pain®, 155(6),1055–1058.
Kong, J., Gollub, R. L., Polich, G., Kirsch, I., LaViolette, P.,Vangel, M., … Kaptchuk, T. J. (2008). A functional magnetic resonance imaging study on the neural mechanisms of hyperalgesic nocebo effect.The Journal of Neuroscience,28(49), 13354–13362.
Kong, J., Gollub, R. L., Rosman, I. S., Webb, J. M., Vangel,M. G., Kirsch, I., & Kaptchuk, T. J. (2006). Brain activity associated with expectancy-enhanced placebo analgesia as measured by functional magnetic resonance imaging.The Journal of Neuroscience, 26(2), 381–388.
Krummenacher, P., Candia, V., Folkers, G., Schedlowski, M.,& Schönbächler, G. (2010). Prefrontal cortex modulates placebo analgesia.Pain®,148(3), 368–374.
Lee, H. F., Hsieh, J. C., Lu, C. L., Yeh, T. C., Tu, C. H.,Cheng, C. M.,... & Chang, F. Y. (2012). Enhanced affect/cognition-related brain responses during visceral placebo analgesia in irritable bowel syndrome patients.Pain, 153(6), 1301–1310.
Levine, J., Gordon, N., & Fields, H. (1978). The mechanism of placebo analgesia.The Lancet, 312(8091), 654–657.
Lu, H. -C., Hsieh, J. -C., Lu, C. -L., Niddam, D. M., Wu, Y.-T., Yeh, T. -C., … Lee, S. -D. (2010). Neuronal correlates in the modulation of placebo analgesia in experimentally-induced esophageal pain: A 3T-fMRI study.Pain, 148(1), 75–83.
Lui, F., Colloca, L., Duzzi, D., Anchisi, D., Benedetti, F., &Porro, C. A. (2010). Neural bases of conditioned placebo analgesia.Pain®, 151(3), 816–824.
Manchikanti, L., Giordano, J., Fellows, B., & Hirsch, J. A.(2011). Placebo and nocebo in interventional pain management: A friend or a foe-or simply foes?.Pain Physician, 14(2), E157–E175.
Matre, D., Casey, K. L., & Knardahl, S. (2006).Placebo-induced changes in spinal cord pain processing.The Journal of Neuroscience, 26(2), 559–563.
Meissner, K., Bingel, U., Colloca, L., Wager, T. D., Watson,A., & Flaten, M. A. (2011). The placebo effect: Advances from different methodological approaches.The Journal of Neuroscience, 31(45), 16117–16124.
Meyer-Lindenberg, A., Domes, G., Kirsch, P., & Heinrichs,M. (2011). Oxytocin and vasopressin in the human brain:Social neuropeptides for translational medicine.Nature Reviews Neuroscience, 12(9), 524–538.
Musial, F., Klosterhalfen, S., & Enck, P. (2007). Placebo responses in patients with gastrointestinal disorders.World Journal of Gastroenterology, 13(25), 3425–3429.
Nolan, T. A., Price, D. D., Caudle, R. M., Murphy, N. P., &Neubert, J. K. (2012). Placebo-induced analgesia in an operant pain model in rats.Pain®, 153(10), 2009–2016.
Petrovic, P., Kalso, E., Petersson, K. M., Andersson, J.,Fransson, P., & Ingvar, M. (2010). A prefrontal non-opioid mechanism in placebo analgesia.Pain, 150(1), 59–65.
Petrovic, P., Kalso, E., Petersson, K. M., & Ingvar, M.(2002). Placebo and opioid analgesia-- imaging a shared neuronal network.Science, 295(5560), 1737–1740.
Ploghaus, A., Narain, C., Beckmann, C. F., Clare, S.,Bantick, S., Wise, R., … Tracey, I. (2001). Exacerbation of pain by anxiety is associated with activity in a hippocampal network.The Journal of Neuroscience, 21(24),9896–9903.
Pollo, A., Amanzio, M., Arslanian, A., Casadio, C., Maggi,G., & Benedetti, F. (2001). Response expectancies in placebo analgesia and their clinical relevance.Pain, 93(1),77–84.
Pollo, A., Carlino, E., & Benedetti, F. (2008). The top-down influence of ergogenic placebos on muscle work and fatigue.European Journal of Neuroscience, 28(2), 379–388.
Pommier, B., Beslot, F., Simon, A., Pophillat, M., Matsui, T.,Dauge, V., … Noble, F. (2002). Deletion of CCK2 receptor in mice results in an upregulation of the endogenous opioid system.The Journal of Neuroscience, 22(5), 2005–2011.
Price, D. D., & Barrell, J. J. (1999). Mechanisms of analgesia produced by hypnosis and placebo suggestions.Progress in Brain Research, 122, 255–271.
Price, D. D., & Bushnell, M. C. (2004). Overview of pain dimensions and their psychological modulation. In D. D.Price, & M. C. Bushnell (Eds.),Psychological methods of pain control: Basic science and clinical perspectives.Progress in Pain Research and Management,29, (pp.3–17). Seattle, WA: IASP Press.
Price, D. D., Craggs, J., Nicholas Verne, G., Perlstein, W. M.,& Robinson, M. E. (2007). Placebo analgesia is accompanied by large reductions in pain-related brain activity in irritable bowel syndrome patients.Pain, 127(1–2), 63–72.
Price, D. D., Finniss, D. G., & Benedetti, F. (2008). A comprehensive review of the placebo effect: recent advances and current thought.Annual Review of Psychology, 59(1),565–590.
Qiu, Y. -H., Wu, X. -Y., Xu, H. & Sackett, D. (2009).Neuroimaging study of placebo analgesia in humans.Neuroscience Bulletin, 25(5), 277–282.
Rodriguez-Raecke, R., Doganci, B., Breimhorst, M.,Stankewitz, A., Büchel, C., Birklein, F., & May, A. (2010).Insular cortex activity is associated with effects of negative expectation on nociceptive long-term habituation.The Journal of Neuroscience, 30(34), 11363–11368.
Schenk, L. A., Sprenger, C., Geuter, S., & Büchel, C. (2014).Expectation requires treatment to boost pain relief: An fMRI study.Pain®, 155(1), 150–157.
Schienle, A., Übel, S., Schöngaßner, F., Ille, R., &Scharmüller, W. (2014). Disgust regulation via placebo:An fMRI study.Social Cognitive and Affective Neuroscience,9(7), 985–990.
Schmid, J., Theysohn, N., Gaß, F., Benson, S., Gramsch, C.,Forsting, M., … Elsenbruch, S. (2013). Neural mechanisms mediating positive and negative treatment expectations in visceral pain: A functional magnetic resonance imaging study on placebo and nocebo effects in healthy volunteers.Pain®, 154(11), 2372–2380.
Scott, D. J., Stohler, C. S., Egnatuk, C. M., Wang, H.,Koeppe, R. A., & Zubieta, J. -K. (2007). Individual differences in reward responding explain placebo-induced expectations and effects.Neuron, 55(2), 325–336.
Scott, D. J., Stohler, C. S., Egnatuk, C. M., Wang, H.,Koeppe, R. A., & Zubieta, J. -K. (2008). Placebo and nocebo effects are defined by opposite opioid and dopaminergic responses.Archives of General Psychiatry,65(2), 220–231.
Svensson, C. I., & Yaksh, T. L. (2002). The spinal phospholipase-cyclooxygenase-prostanoid cascade in nociceptive processing.Annual Review of Pharmacology and Toxicology, 42(1), 553–583.
Swider, K., & Babel, P. (2013). The effect of the sex of a model on nocebo hyperalgesia induced by social observational learning.Pain, 154(8), 1312–1317.
van Laarhoven, A. I., Vogelaar, M. L., Wilder-Smith, O. H.,van Riel, P. L., van de Kerkhof, P., Kraaimaat, F. W., &Evers, A. W. (2011). Induction of nocebo and placebo effects on itch and pain by verbal suggestions.Pain,152(7), 1486–1494.
Vögtle, E., Barke, A., & Kröener-Herwig, B. (2013). Nocebo hyperalgesia induced by social observational learning.Pain, 154(8), 1427–1433.
Voudouris, N. J., Peck, C. L., & Coleman, G. (1985).Conditioned placebo responses.Journal of Personality and Social Psychology, 48(1), 47–53.
Wager, T. D., & Atlas, L. Y. (2013). How is pain influenced by cognition? Neuroimaging weighs in.Perspectives on Psychological Science, 8(1), 91–97.
Wager, T. D., Atlas, L. Y., Leotti, L. A., & Rilling, J. K.(2011). Predicting individual differences in placebo analgesia: Contributions of brain activity during anticipation and pain experience.The Journal of Neuroscience, 31(2),439–452.
Wager, T. D., Rilling, J. K., Smith, E. E., Sokolik, A., Casey,K. L., Davidson, R. J., … Cohen, J. D. (2004).Placebo-induced changes in fMRI in the anticipation and experience of pain.Science, 303(5661), 1162–1167.
Wager, T. D., Scott, D. J., & Zubieta, J. -K. (2007). Placebo effects on human μ-opioid activity during pain.Proceedings of the National Academy of Sciences of the United States of America, 104(26), 11056–11061.
Wang, X. J., Wang, X. H., & Han, J. S. (1990). Cholecystokinin octapeptide antagonized opioid analgesia mediated by μ-and κ-but not δ-receptors in the spinal cord of the rat.Brain Research, 523(1), 5–10.
Watson, A., El-Deredy, W., Iannetti, G. D., Lloyd, D.,Tracey, I., Vogt, B. A., … Jones, A. K. P. (2009). Placebo conditioning and placebo analgesia modulate a common brain network during pain anticipation and perception.Pain, 145(1–2), 24–30.
Xie, J. Y., Herman, D. S., Stiller, C. -O., Gardell, L. R.,Ossipov, M. H., Lai, J., … Vanderah, T. W. (2005).Cholecystokinin in the rostral ventromedial medulla mediates opioid-induced hyperalgesia and antinociceptive tolerance.The Journal of Neuroscience, 25(2), 409–416.
Zhang, R. -R., Zhang, W. -C., Wang, J. -Y., & Guo, J. -Y.(2013). The opioid placebo analgesia is mediated exclusively through μ-opioid receptor in rat.International Journal of Neuropsychopharmacology, 16(4), 849–856.
Zubieta, J. -K., Bueller, J. A., Jackson, L. R., Scott, D. J., Xu,Y., Koeppe, R. A., … Stohler, C. S. (2005). Placebo effects mediated by endogenous opioid activity on μ-opioid receptors.The Journal of Neuroscience, 25(34), 7754–7762.
