利用TALEN技术高效制备TXNIP基因敲除小鼠模型
2015-02-01张欢欢刘楚新肖丽萍李飞达应华忠
张欢欢,刘楚新,马 月,肖丽萍,李飞达,应华忠,刘 欢
(1.浙江省医学科学院浙江省实验动物中心,杭州 310013;2.深圳华大基因研究院,深圳 518083)
利用TALEN技术高效制备TXNIP基因敲除小鼠模型
张欢欢1,刘楚新2,马月1,肖丽萍2,李飞达2,应华忠1,刘欢2
(1.浙江省医学科学院浙江省实验动物中心,杭州310013;2.深圳华大基因研究院,深圳518083)
【摘要】目的利用显微注射技术注射敲除Txnip基因的TALEN mRNA获得TXNIP敲除小鼠。方法在线设计Txnip敲除位点,构建TALEN载体并在细胞水平验证剪切活性,体外转录TALENs成mRNA并通过显微注射技术注射到C57BL/6J小鼠受精卵,对F0代小鼠进行DNA水平鉴定获得TXNIP敲除小鼠。结果在Txnip第一外显子上设计了TALEN识别剪切位点,并在细胞水平验证具有剪切活性,注射mRNA到受精卵获得了4只敲除小鼠,其中2只Txnip发生移码突变,成功制备了TXNIP敲除小鼠。结论通过注射TALENs mRNA可以高效制备TXNIP敲除小鼠。
【关键词】TALEN;显微注射;TXNIP;基因敲除;模型,小鼠
基因敲除小鼠模型是研究基因功能的重要工具之一,最早科学家利用同源重组技术制备基因敲除小鼠ES细胞系,然后通过囊胚注射制备基因敲除小鼠[1,2],近年来兴起的基因组编辑工具,例如锌指核酸酶ZFN[3],转录激活因子样效应物核酸酶TALEN[4],规律成簇间隔短回文重复序列CRISPR以及CRISPR相关蛋白系统CRISPR/Cas系统[5],都大大提高了基因敲除小鼠制备效率。TALEN (transcription activator-like effector nucleases)通过类转录激活因子效应物(TALE)识别DNA序列,并在特定位点对DNA进行切割,形成双链断裂(DSB),随后在非同源末端连接(NHEJ)修复机制下形成随机的多个碱基的插入或删除,从而实现基因敲除[6]。
硫氧还蛋白结合蛋白(thioredoxin-interacting protein,Txnip)通过与硫氧还原蛋白( thioredoxin,Trx) 结合抑制其活性,从而发挥调节氧化还原的作用[7]。TXNIP 不仅通过调节NLRP3参与2型糖尿病的发生[8],而且是肿瘤抑制相关基因,与黑色素瘤、肝细胞癌、乳腺癌、白血病等联系密切[9]。本研究采用TALEN技术敲除C57BL/6J小鼠Txnip基因,为进一步研究Txnip的生物学功能奠定基础。
1材料和方法
1.1TALENS位点设计
根据NCBI上Txnip基因序列,利用TALEN在线设计工具(http://zifit.partners.org/ZiFiT/ChoiceMenu.aspx)设计基因敲除位点。TALENs敲除靶序列如下:TALEN-L靶向5’-TGTGAAGTTACCCGAGTC-3’,TALEN-R靶向5’-TGGCCACGCCGCAAGCCA-3’。中间的sapcer序列为AAAGCCGTCAGGATCC,其中GGATCC为BamHI酶切位点。
1.2TALENs载体构建
采用Golden gate TALEN and TAL Effector kit[10]将识别靶序列的RVD模块构建到pTAL3载体上。然后将TALEN片段通过AflII和XhoI双酶切构建到pcDNA3.1载体上,使得TALEN表达由CMV或者T7启动子启动,其中CMV启动TALENs在动物细胞中表达,T7启动TALENs体外转录成mRNA。将测序正确的TALENs表达载体采用无内毒素质粒提取试剂盒(OMEGA)提取质粒备用。
1.3TALENs载体活性验证
复苏小鼠Hepa1-2细胞系,用含10% FBS的DMEM培养基在6孔板上进行培养,培养条件为5%37℃,CO2。采用lipofectamine(Invitrogen)将TALEN-F和TALEN-R共转染细胞,并且以EGFP转染作为阴性对照,转染后继续培养。48 h后用0.25%胰酶(Life technologies)消化收集细胞,提取DNA。设计活性鉴定引物,引物序列如下:TXNIP-F为5’-TCGGCTCAATCATGGTGATGT-3’,TXNIP-R为5’-TAGGGGGGTGAAGGGTAGTGA-3’。以细胞DNA为模板进行PCR扩增,并采用BamHI进行酶切鉴定,其中扩增片段大小为421 bp,酶切片段为146 bp + 275 bp。
1.4体外转录
AflII和XhoI双酶切TALENs无内毒素质粒,电泳回收片段,并用cycle-purekit(OMEGA)进行纯化。以纯化片段为模板,采用mMESSAGE mMACHINE T7 Kit(Life Technologies)进行体外转录合成加帽mRNA,再用Poly(A) Tailing Kit(Life Technologies)对mRNA进行加尾。将转录的稳定mRNA纯化回收并用显微注射缓冲液(10 mmol/L Tris-HCl/0.1 mmol/L EDTA,pH 7.4)稀释到100 ng/μL,-80℃保存备用。
1.5显微注射
C57BL/6J品系小鼠由上海市西普尔必凯实验动物有限公司提供,实验动物生产许可证号SCXK(沪)2013-0016;ICR小鼠由浙江省医学科学院提供,实验动物生产许可证号SZXK(浙)2014-0001。实验动物使用许可证号:SYXK(浙)2014-0008。将Txnip的TALEN-L和TALEN-R mRNA混合在一起后在显微镜(Nikon)下利用显微操作系统(Eppendorf)注射到C57BL/6J的受精卵中,并移植到ICR受体雌鼠,具体实验方法参考小鼠胚胎操作实验手册[11]。
1.6突变检测及基因型分析
取出生1周龄小鼠鼠尾提取基因组DNA,按照活性鉴定方法对F0代小鼠进行鉴定。并将BamHI酶切鉴定为阳性的小鼠的PCR扩增产物连接到T载体上,进行Sanger测序(Invitrogen),进行突变基因型分析。
2结果
2.1 TALEN载体构建及活性鉴定

图1 Txnip基因敲除TALENs位点Fig.1 The TALENs binding site in the mouse Txnip gene
小鼠Txnip基因有两个已知转录本,为了高效敲除TXNIP蛋白表达,本研究选择的敲除位点为Txnip基因的第一外显子区域两个转录本重叠的部分,如图1。TAL-effector识别模块HD、NG、NI、NN分别识别碱基C、T、A、G[12],因此本研究中识别Txnip的模块序列分别为5’-NN-NG-NI-NI-NN-NG-NG-NI-HD-HD-HD-NN-NI-NN-NG-HD-3‘和5’-NN-NN-HD-HD-NI-HD-NN-HD-HD-NN-HD-NI-NI-NN-HD-HD-NI-3’。为了便于活性鉴定及后期小鼠阳性鉴定,本研究识别序列中间的spacer含有BamHI酶切位点,如图1所示。
将构建的好的TALENs质粒转染小鼠Hepa1-2细胞系,进行活性鉴定。如图2所示,与阴性对照相比,BamHI酶切后,TxnipTALENs转染的细胞DNA有未切开片段,说明其部分DNA样品BamHI酶切位点被破坏,进而验证了本研究采用的TALENs有剪切活性。
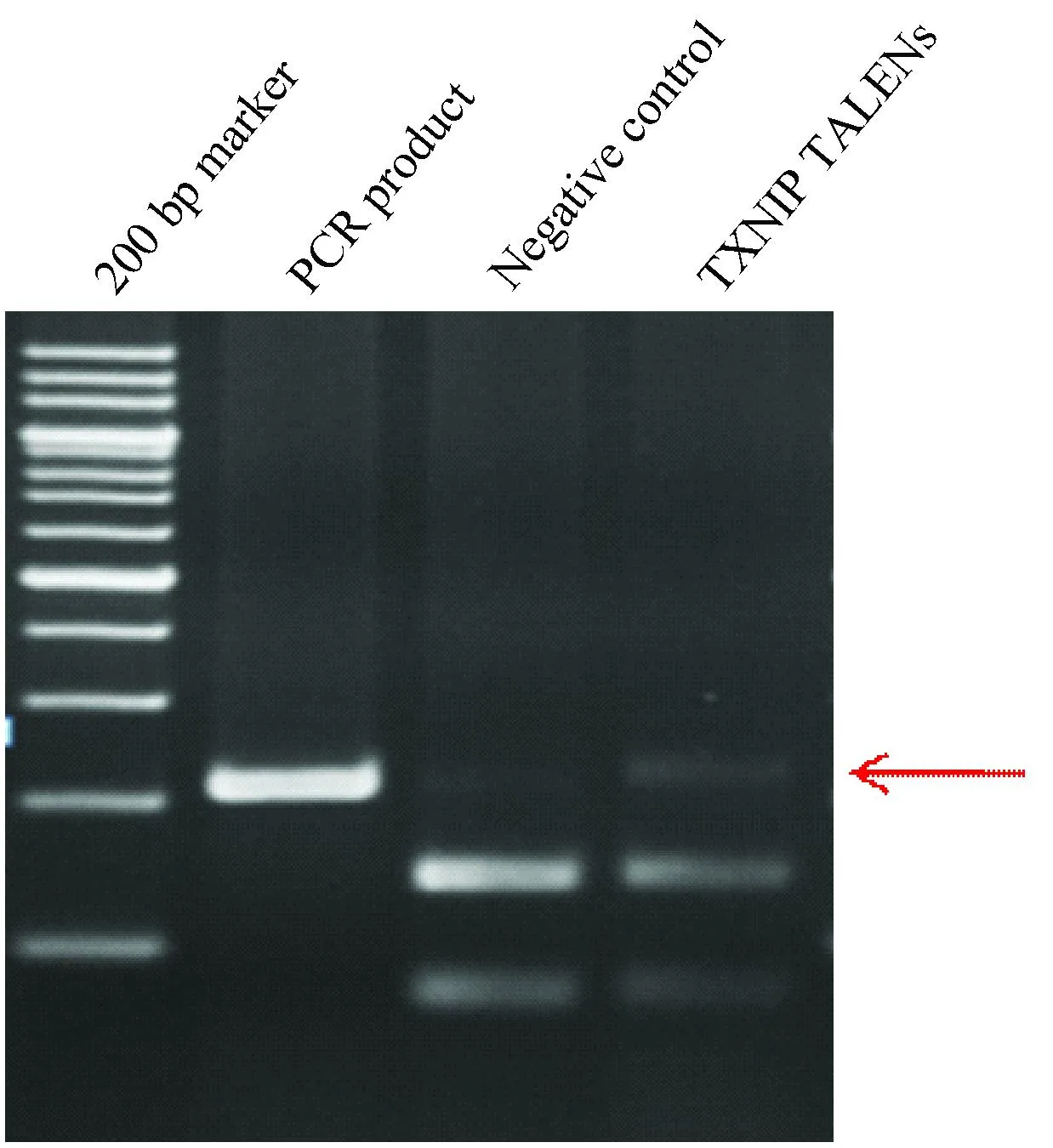
图2 Txnip TALENs剪切活性验证酶切电泳图Fig.2 Cleavage activity of TALENs by restriction fragment length polymorphism analysis
2.2 TXNIP基因敲除小鼠构建及鉴定
体外转录分别得到TALEN-L和TALEN-R的mRNA,如图3。将mRNA分别稀释到100 ng/μL后等量混合进行胞质注射,共注射400枚受精卵,移植383枚到14只ICR受体母鼠,其中8只怀孕,出生26只F0代小鼠。。对出生的26只F0代小鼠进行PCR酶切鉴定,从图4A可以看出,跟阴性对照(N)相比,11#,20#,22#,26#都有BamHI未切开片段。经Sanger测序验证,11#小鼠属于嵌合体,有3种基因型,包括WT、缺失21 bp、缺失4 bp,20#、22#、26#小鼠属于基因单敲除,分别缺失15 bp、10 bp、19 bp(图4B)。鉴定结果显示,26只F0代小鼠有4只敲除阳性小鼠,敲除效率为15.4%,其中22#和26#小鼠Txnip发生移码突变,可作为F0代阳性小鼠继续繁育获得TXNIP双敲除模型。本研究获得了Txnip基因敲除小鼠founder,可作为基因功能研究工具深入探讨Txnip基因的生物学活性。
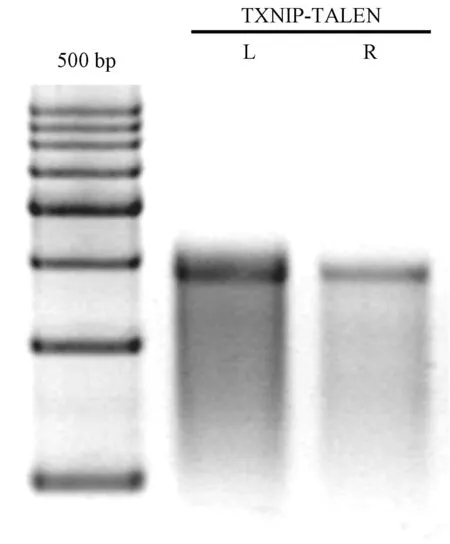
图3 Txnip TALENs体外转录mRNAFig.3 Txnip TALEN mRNAs transcripted in vitro
3讨论
相对于传统打靶同源重组10-6概率,基因组编辑工具大大提升了基因敲除的效率,因而在基因功能研究领域快速推广。TALEN技术2012年被Science杂志评为十大科学突破之一,具有操作简单,特异性高等特点,广泛应用于动物、植物、微生物等多个物种[13]。通过截短TALE蛋白的N-端和C-端并连接异源FokI(ELD/KKR)实现的TALEN系统优化可以有效提高剪切效率并降低脱靶效率[14], Xin等[15]采用该优化系统获得89.5%的敲除细胞系。本研究实验结果显示Txnip敲除阳性率为15.4%,远低于该系统在其他基因敲除动物制备的效率[16,17],可能原因有两种,第一本研究构建的TALEN活性低于其他研究者选择的TALEN的活性,因而造成显微注射获得的阳性受精卵较少;第二Txnip基因本身参与细胞的凋亡[9],对细胞的生长发育有一定的影响,造成出生小鼠阳性率较低。
通过胞质注射TALEN mRNA的方法制备的基因敲除动物模型,其部分F0代基因型为嵌合体[18],这跟注射的mRNA量有一定的关系,当受精卵发育到二细胞期或者四细胞期时,仍然有表达TALEN的mRNA进行翻译并对基因组进行剪切,因此发育的囊胚存在多种基因型[4]。本研究获得的11# Txnip敲除小鼠表现为3种基因型,属于嵌合体。多数嵌合体小鼠繁育的F1代小鼠能够将不同的基因型分离出来,并保持稳定遗传。因此TALEN技术虽然能够快速制备基因敲除动物模型,获得纯合的敲除模型则需要更长的时间进行繁育和筛选。

A:出生小鼠Txnip基因PCR产物BamHI酶切鉴定电泳结果;B:酶切鉴定阳性小鼠测序结果。图4 Txnip小鼠鉴定结果A: Genotyping of all newborn mice by gel electrophoresis of BamHI digested PCR products spanning the Txnipgene target site;B: Sanger sequencing of positive founder mice which were identified by BamHI digestion.Fig.4 Identification of TALEN-induced Txnip mutants in the founder mice.
TXNIP(thioredoxin-interacting protein)具有多种生物学功能,尤其在氧化还原平衡中起着重要作用[19]。TXNIP既可以通过ASK1-Trx-TXNIP信号通路调节细胞凋亡[20]、抑制DNA转录[21],还可以与NLRP3结合激活炎症反应[22],因而TXNIP可能发挥抑制肿瘤的功能,尤其是在肝癌[23]、乳腺癌[24]、膀胱癌[25]、白血病[26]等癌症中表达量均显著下降。本研究通过注射敲除Txnip的TALEN mRNA构建的TXNIP敲除小鼠,除了Txnip基因序列发生改变,没有引入任何外源片段,相对于传统方法更加“干净”。除此之外,TALEN技术敲除基因表达的原理是识别特异序列并进行剪切形成双链断裂((double strand break, DSB),通过非同源末端修复引入序列改变。有报道表明,切割位点越靠近5’端基因表达起始位点,对其形成的蛋白功能影响越大,从而基因敲除的效应越明显[27]。本研究设计的识别序列在Txnip基因的第一外显子,而且是两个转录本重叠的部分,因而本研究获得的TXNIP敲除小鼠是研究TXNIP功能的良好模型。
参考文献:
[1]Thomas KR, Capecchi MR. Site-directed mutagenesis by gene targeting in mouse embryo-derived stem cells [J]. Cell, 1987, 51(3): 503-512.
[2]Mansour SL, Thomas KR, Capecchi MR. Disruption of the proto-oncogene int-2 in mouse embryo-derived stem cells: a general strategy for targeting mutations to non-selectable genes [J]. Nature, 1988, 6197(336): 348-352.
[3]Carbery ID, Ji D, Harrington A et al. Targeted genome modification in mice using zinc-finger nucleases [J]. Genetics, 2010, 186(2): 451-459.
[4]Sung YH, Baek IJ, Kim DH, et al. Knockout mice created by TALEN-mediated gene targeting [J]. Nat Biotechnol, 2013, 31(1): 23-24.
[5]Wang H, Yang H, Shivalila CS, et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering [J]. Cell, 2013, 153(4): 910-918.
[6]Miller JC, Tan S, Qiao G, et al. A TALE nuclease architecture for efficient genome editing [J]. Nat Biotechnol, 2011, 29(2): 143-148.
[7]Nishiyama A, Matsui M, Iwata S, et al. Identification of thioredoxin-binding protein-2/vitamin D(3) up-regulated protein 1 as a negative regulator of thioredoxin function and expression [J]. J Biol Chem, 1999, 274 (31): 21645-21650.
[8]王定坤, 陈广, 陆付耳. NLRP3炎症小体与2 型糖尿病的研究进展 [J]. 生理科学进展, 2014, 45(2): 111-114.
[9]李立夫, 梁莉. TXNIP 基因与肿瘤发生及转移 [J]. 中国生物化学与分子生物学报, 2012, 28(3): 222-226.
[10]Cermak T, Doyle EL, Christian M, et al. Efficient design and assembly of custom TALEN and other TAL effector-based constructs for DNA targeting [J]. Nucleic Acids Res, 2011, 39(12): e82.
[11]孙青原, 陈大元. 小鼠胚胎操作实验手册(第3版)[M]. 化学工业出版社. 2006: 235-241.
[12]Gaj T, Gersbach CA, Barbas CF.3rd. ZFN, TALEN, and CRISPR/Cas-based methods for genome engineering[J].Trends Biotechnol,2013,31(7):397-405.
[13]沈延, 黄鹏, 张博. TALEN构建与斑马鱼基因组定点突变的实验方法与流程 [J]. 遗传, 2013, 35(4): 533-544.
[14]Bedell VM, Wang Y, et al. In vivo genome editing using a high-efficiency TALEN system [J]. Nature, 2012, 7422(491): 114-118.
[15]Xin J, Yang H, Fan N, et al. Highly efficient generation of GGTA1 biallelic knockout inbred mini-pigs with TALENs [J]. PLoS ONE. 2013, 12(8): e84250.
[16]李飞达, 李勇, 刘欢, 等. 利用TALENs 和手工克隆技术高效获得GHR基因敲除巴马猪 [J]. 遗传, 2014, 36(9): 903-911.
[17]Davies B, Davies G, Preece C, et al. Site specific mutation of the Zic2 locus by microinjection of TALEN mRNA in mouse CD1, C3H and C57BL/6J oocytes [J]. PLoS ONE, 2013, 8(3): e60216.
[18]Tesson L, Usal C, Ménoret S, et al. Knockout rats generated by embryo microinjection of TALENs [J]. Nat Biotechnol, 2011, 29(8): 695-696.
[19]Spindel ON, World C, Berk BC. Thioredoxin interacting protein: redox dependent and independent regulatory mechanisms [J]. Antioxid Redox Signal, 2012, 16(6): 587-596.
[20]Lu J, Holmgren A. Thioredoxin system in cell death progression [J]. Antioxid Redox Signal, 2012, 17(12): 1738-1747.
[21]Minn AH, Pise-Masison CA, Radonovich M, et al. Gene expression profiling in INS-1 cells overexpressing thioredoxin-interacting protein [J]. Biochem Biophys Res Commun, 2005, 336(3): 770-778.
[22]Zhou R, Tardivel A, Thorens B, et al. Thioredoxin-interacting protein links oxidative stress to inflammasome activation [J]. Nat Immunol, 2010, 11(2): 136-140.
[23]Kwon HJ, Won YS, Suh HW, et al. Vitamin D3 upregulated protein 1 suppresses TNF-α-induced NF-κB activation in hepatocarcinogenesis [J]. J Immunol, 2010, 185(7): 3980-3989.
[24]Butler LM, ZhouX, Xu WS, et al. The histone deacetylase inhibitor SAHA arrests cancer cell growth, up-regulates thioredoxin-binding protein-2, and down-regulates thioredoxin [J]. Proc Natl Acad Sci U S A, 2002, 99(18): 11700-11705.
[25]Nishizawa K, Nishiyama H, Matsui Y, et al. Thioredoxin-interacting protein suppresses bladder carcinogenesis [J]. Carcinogenesis, 2011, 32(10): 1459-1466.
[26]Zhou J, BiC, Cheong LL, et al. The histone methyltransferase inhibitor, DZNep, up-regulates TXNIP, increases ROS production, and targets leukemia cells in AML [J]. Blood, 2011, 118(10): 2830-2839.
[27]Wang T, Wei JJ, Sabatini DM, et al. Genetic screens in human cells using the CRISPR-Cas9 system [J]. Science, 2014, 6166(343): 80-84.
〔修回日期〕2015-04-20
研究报告
Efficient preparation of a TXNIP knockout mouse model by
transcription activator-like effector nucleases (TALEN)
ZHANG Huan-huan1, LIU Chu-xin2, MA Yue1, XIAO Li-ping2, LI Fei-da2, YING Hua-zhong1, LIU Huan2
(1. Zhejiang Laboratory Animal Center,Zhejiang Academy of Medical Sciences, Hangzhou 310013, China;
2. BGI-Shenzhen, Shenzhen 518083)
【Abstract】ObjectiveTo knockout the murine Txnip gene using microinjection of transcription activator-like effector nuclease (TALEN) mRNAs. MethodsTALEN knockout site recognizing Txnip was designed by tools on line, then constructed the vectors and assayed its cleavage activity at cellular level. TALEN mRNA was transcribed in vitro and microinjected into C57BL/6J mouse zygotes. F0 mice were verified at DNA level with BamHI and TXNIP-knockout mice were obtained. Results We designed and constructed TALENs which recognized and cut the first exon of Txnip, and got four TXNIP knockout mice, among which two were frameshift mutation, demonstrating that the TXNIP-knockout mice were generated by TALEN technique. ConclusionsMicroinjection of in vitro transcribed TALEN mRNAs into murine zygotes is a highly effective and convenient way to develop TXNIP-knockout mouse model.
【Key words】TALEN; Microinjection; TXNIP; Gene knockout;Model, mouse
doi:10.3969.j.issn.1671.7856. 2015.006.002
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2015) 06-0009-05
[通讯作者]刘欢(1984-),男,助理研究员,研究方向:转基因动物开发。E-mail: liuhuan@genomics.cn。
[作者简介]张欢欢(1985-),女,研究实习员,研究方向:动物疾病模型。E-mail: zhanghuanhuan2014@126.com。
[基金项目]浙江省卫生高层次创新人才项目,浙江省科技厅院所专项(2014F10033)。
