清醒挪威褐鼠过敏性哮喘发作全程记录模型
2016-01-28陶婧婧徐燕锋韩云林徐玉环张星东
陶婧婧,徐燕锋,韩云林,徐玉环,秦 川,高 虹,张星东
(卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,
中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京 100021)
清醒挪威褐鼠过敏性哮喘发作全程记录模型
陶婧婧,徐燕锋,韩云林,徐玉环,秦川,高虹,张星东
(卫生部人类疾病比较医学重点实验室,国家中医药管理局人类疾病动物模型三级实验室,
中国医学科学院医学实验动物研究所,北京协和医学院比较医学中心,北京100021)
【摘要】目的建立卵蛋白(OVA)致敏激发后,在挪威褐鼠无创且清醒的状态下,可观察和记录到过敏性哮喘发作全过程(速发相和迟发相)的动物模型。方法 66只挪威褐鼠按致敏液[OVA和Al(OH)3]不同平均分为11组,单纯注射OVA的4组(0.01、0.1、1.0和10.0 mg/只);OVA混合Al(OH)3干粉的5组(0.1+100、1.0+100、10.0+100、1.0+52和1.0+4 mg/只);OVA 混合Al(OH)3胶体的1组(10.0+4 mg/只);正常对照组1组。10个致敏组分别于第0天和第5天背部皮下2点注射相应致敏液,每点注射0.2 mL,正常对照组注射等量生理盐水。在第37天雾化吸入5% OVA激发10 min。然后立即放入体积描记器中连续记录16 h 呼气相延长参数(penh)值。采集第0、7、14、21、28、35、38天血清,ELISA法检测特异性IgE含量。HE染色观察肺病理变化。结果除单纯注射OVA 0.01 mg组外,其他各组大鼠血清特异性IgE含量均比正常对照组显著升高(P<0.05),且在致敏1周后IgE开始大量产生,直到第5周均呈持续增长趋势。观察到了哮喘发作的速发和迟发双相气道反应,其特点表现在Penh值的显著增高,且与正常对照组相比,模型组(以OVA 10.0 & Al(OH)3100、OVA 10.0 & Al(OH)3gel 4组为例)的速发相/迟发相峰值、面积均显著增大(P<0.05)。模型组(以OVA 10.0 & Al(OH)3100组为例)有以气道周围嗜酸性粒细胞浸润为主的炎症表现。结论 成功建立了无创、清醒状态下挪威褐鼠过敏性哮喘发作全程记录模型。
【关键词】过敏性哮喘;挪威褐鼠;呼气相延长参数;速发相反应;迟发相反应
过敏性哮喘(以下简称哮喘),是一种以可逆性支气管痉挛和气道高反应性为特点的气道慢性炎症。临床表现为反复发作性喘息、带有哮鸣音的呼气性呼吸困难、胸闷、咳嗽等。临床上给患者做特异性抗原激发试验时发现哮喘发作时可出现速发相(early-phase asthmatic response, EAR)和迟发相(late-phase asthmatic response, LAR)。EAR发生在接触抗原数分钟内,一般持续1~2 h,肥大细胞释放预合成的活性介质从而导致支气管痉挛和气道黏膜水肿及血管通透性增加进而引起喘息症状;LAR时喘息症状加重,持续时间比EAR长,可达10 h甚至更久,主要是EAR时期趋化、募集来的以嗜酸性粒细胞为主的炎症细胞浸润而形成的炎症反应过程[1]。
目前对哮喘的研究日益增多,但无论是机理研究还是药物筛选,都需要先选择合适的模型才能获得有意义的研究成果。目前用于哮喘研究的模型有麻醉模型和清醒模型。麻醉模型的动物需要在麻醉状态下进行气管插管,接呼吸机后进行气道阻力的检测,主要分为麻醉哮喘模型和麻醉气道高反应性模型2种。二者的区别在于麻醉哮喘模型是用致敏时的抗原特异激发后进行气道阻力的检测,麻醉气道高反应性模型在抗原特异激发时不作检测,乙酰胆碱等非特异激发时检测[2]。清醒模型中的动物在检测时为清醒状态,气道无机械损伤,主要以清醒气道高反应性模型为主。清醒气道高反应性模型在特异激发时亦不作检测,乙酰胆碱等非特异激发后检测[3],与麻醉气道高反应性模型原理相同。气道高反应性模型关注的是哮喘发作后气道过度敏感的状态,而不是哮喘发作时的状态,所以无法真正说明喘息的变化。而且气道高反应性不是哮喘独有的特异性的反应,在慢性阻塞性肺疾病等疾病中也可能发生,所以在未排除上述干扰因素的情况下,检测精确度会降低。麻醉模型虽然观察了哮喘发作时的变化,但动物处于麻醉状态,可持续记录时间短,主要用于EAR阶段的研究,不易观察到几小时后的LAR[4-6]。而LAR持续时间长,喘息更剧烈,是哮喘发作过程中的重要部分,对LAR的研究有利于进一步探索哮喘发病机理和开发有效治疗措施。
本工作正是基于LAR的研究需要,拟建立一个能连续观察EAR和LAR的动物模型。采用挪威褐鼠为模型动物,卵蛋白(ovalbumin, OVA)为变应原,记录并分析OVA特异性激发后哮喘发作全过程(EAR和LAR),评价不同造模方法的特点,确立挪威褐鼠过敏性哮喘发作全程记录模型构建方案。
1材料和方法
1.1实验动物
雄性SPF级挪威褐鼠 66只,6 ~ 8周,体重140 ~ 150 g。购自北京维通利华实验动物技术有限公司【SCXK(京)2012-0001】,在本实验室屏障环境的饲养间【SYXK(京)2013-0014】饲养。饲喂无OVA的普通灭菌饲料。动物购入后,在屏障设施内适应1周后开始实验。本实验涉及的动物饲养及动物实验方案已得到中国医学科学院医学实验动物研究所实验动物使用与管理委员会的批准【ILAS-PL-2013-001】。
1.2主要试剂和仪器
OVA、牛血清蛋白(albumin from bovine serum, BSA)、氢氧化铝(Al(OH)3)、吐温-20均购自美国Sigma公司。氢氧化铝胶体购自美国Invivogen公司。辣根过氧化物酶偶联的羊抗大鼠IgE抗体购自美国Novus Biologicals公司。TMB购自美国Thermo Fisher Scientific公司。PBS缓冲液购自北京中杉金桥生物技术有限公司。PARI Turbo BOY N压缩雾化吸入机购自德国百瑞公司。Buxco WBP大鼠体积描记器购自美国DSI公司。FLUOstar Omega酶标仪购自德国BMG Labtech公司。
1.3动物分组及致敏方法
66只挪威褐鼠按致敏液(OVA和Al(OH)3)不同平均分为11组,单纯注射OVA的4组(0.01、0.1、1.0和10.0 mg/只);OVA混合Al(OH)3干粉的5组(0.1+100、1.0+100、10.0+100、1.0+52和1.0+4 mg/只);OVA 混合Al(OH)3胶体的1组(10.0+4 mg/只);正常对照组1组。且于第0天和第5天,在每只挪威褐鼠背部皮下2点注射相应致敏液,每点注射0.2 mL,正常对照组注射等量生理盐水。
1.4血液采集
正常对照组和OVA 10.0 & Al(OH)3100组于第0、7、14、21、28、35、 38 天 7个时间点,其余组于第35天,使用0.1 mL/只(10 mg)盐酸氯胺酮麻醉后,剪尾采血200 μL/只,4℃,3 000 r/min离心10 min得血清。
1.5激发及取材
所有组于第37天,给予5 mL 5 % OVA雾化吸入10 min。激发后立即放入体积描记器中,每30 s记录一个呼气相延长参数(enhanced pause, Penh)值,连续不间断记录16 h[7]。动物于第38天记录结束后,用0.5 mL/只(10%)戊巴比妥钠过量麻醉处死,摘取左肺放入4 %中性甲醛溶液中固定。
1.6ELISA法检测IgE抗体
先用OVA包被96孔板,再用BSA封闭抗原,然后结合1.4血清样本(第35天样本稀释比例:正常对照组为1∶100,其余组为1∶4 000; 7个时间点样本稀释比例:正常对照组为1∶100,OVA 10.0 & Al(OH)3100组为1∶16 000),再结合辣根过氧化物酶偶联的羊抗大鼠IgE抗体(1:25 000),然后用TMB显色,最后用2 mol/L硫酸终止反应,用酶标仪检测450 nm波长时的吸光度(absorbance, A),A值与板中结合的IgE含量成正比[8]。
1.7HE染色观察肺病理变化
使用1.5中4%中性甲醛固定24 h后的左肺,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片(5 μm)。HE染色后在光镜下观察肺组织嗜酸性粒细胞浸润情况及其他病理变化。
1.8数据处理及统计分析方法
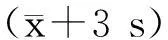
2结果
2.1 特异性IgE
由表1可以看出,除OVA 0.01组,OVA 0.1、OVA 1.0、OVA 10.0、OVA 0.1 & Al(OH)3100、OVA 1.0 & Al(OH)3100、OVA 10.0 & Al(OH)3100、OVA 1.0 & Al(OH)352、OVA 1.0 & Al(OH)34、OVA 10.0 & Al(OH)3gel 4组血清IgE含量与正常对照组相比均显著升高(P<0.05),且随OVA剂量增大,IgE含量升高,加入佐剂组比单一OVA组抗体含量高。OVA 10.0组与相当于其1 % OVA含量但加入了一定佐剂的OVA 0.1 & Al(OH)3100组产生的抗体含量相当,差异无统计学意义。OVA 10.0 & Al(OH)3100组与OVA 10.0 & Al(OH)3gel 4组的IgE含量差异无显著性,均较其他组高,以OVA 10.0 & Al(OH)3100组为最高。以OVA 10.0 & Al(OH)3100组为例,从图1 IgE含量随时间变化曲线可以看出,致敏后IgE水平呈现时间依赖性增长,在第1周内与正常对照组无明显差异,1周后IgE水平开始快速升高,在第2周内剧烈增长,2周后涨幅变缓慢呈现稳定的持续增长,在第5周达峰值,第 38天时略有下降。

表1 不同致敏方法对第35天IgE含量的影响
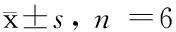
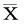

注:前60 min Penh曲线(图2B),16 h Penh曲线(图2A)。图2 正常对照组Penh移动平均曲线Note. 2A: 16 hours Penh curve, 2B: The first 60 minutes of Penh curve.Fig.2 The Penh running average curve of the normal control group
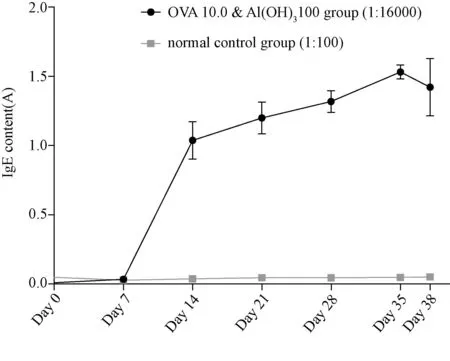
图1 OVA注射后血清特异IgE水平变化Fig.1 Time course of serum specific IgE levels after OVA immunization
2.2 哮喘发作速发相和迟发相
正常对照组激发后的Penh曲线在16 h内较稳定,没有明显波动(图2A)。其Penh限值为1.14(0.90+3*0.08),大于1.14即为Penh值升高。与正常对照组相比(图2B),致敏组(OVA 10.0 & Al(OH)3100组为代表)激发后Penh值立即升高,其Penh曲线在前1 h内有明显上升(图3B)。之后曲线有轻度下降,再开始剧烈上升达峰值后剧烈下降再缓慢下降至基线水平(图3A)。如表2所示,单一OVA 0.1 mg至10 mg致敏,激发后均出现气道反应。低剂量时仅有EAR,随剂量增加,反应加重,LAR发生的比例增加。加入Al(OH)3佐剂致敏后反应进一步加强,EAR和LAR都出现的动物可达半数以上。如表3所示,正常对照组和OVA 10.0 & Al(OH)3100、OVA 10.0 & Al(OH)3gel 4组的EAR峰值和LAR峰值都有差异,两个模型组没有差异。两个模型组的EAR面积、LAR持续时间、LAR面积也无明显差异。OVA 10.0 & Al(OH)3100组连续出现EAR和LAR的动物数为整组6只,OVA 10.0 & Al(OH)3gel 4组为5只,另1只仅有EAR。
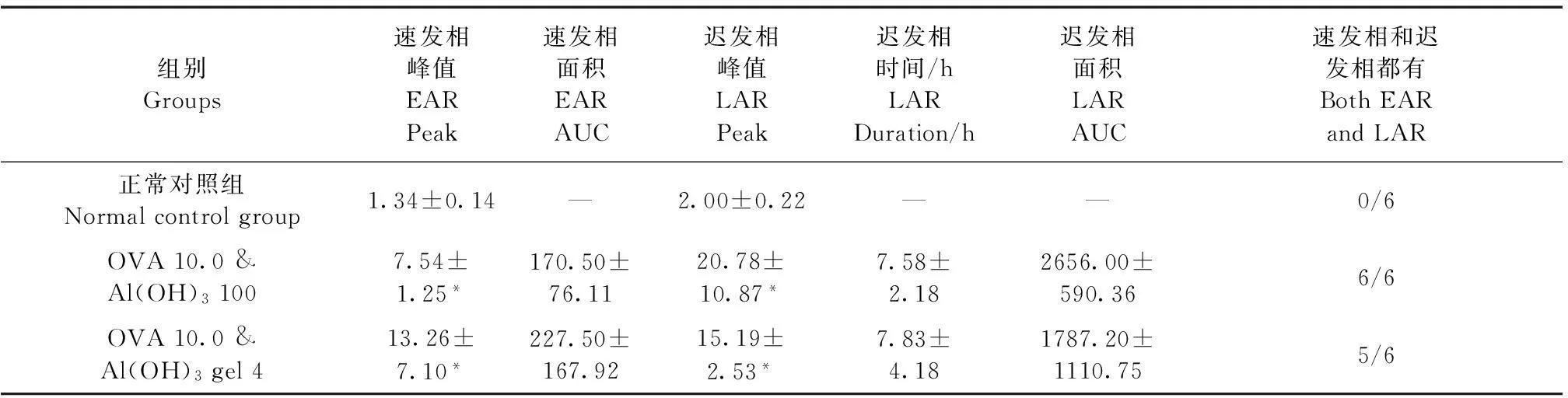
表3 OVA 10.0 & Al(OH)3 100、OVA 10.0 & Al(OH)3 gel 4组速发相和迟发相
2.3肺组织病理检测结果
如图4,与正常对照组相比(图4C、D),OVA 10.0 & Al(OH)3100组(图4A、B)显示血管充血,肺组织有灶性出血,肺泡间隔增宽,肺泡腔内有渗出,分泌物增多(箭头所示),且以嗜酸性粒细胞为主的炎细胞也增多(图4见封二)。
3讨论
哮喘造模动物有大鼠、小鼠、豚鼠、羊和狗等[9],以啮齿类动物最为常用,大鼠与豚鼠相比不易在哮喘发作中死亡,与小鼠相比更容易出现喘息症状,更利于进行喘息的研究。近交系挪威褐鼠是哮喘研究中常用的大鼠品系,挪威褐鼠与人类在哮喘发作时具有很多类似的特点,如EAR和LAR状态、对乙酰胆碱非特异激发的反应、IgE的产生和炎症细胞浸润等方面[10-11],符合本研究关注哮喘发作全过程的特点,适合作为本研究的模型动物。
OVA致敏激发引起动物哮喘是现在哮喘动物模型造模最常用的方法[12],使用“通用变应原”OVA造模符合本研究拟建立普适性哮喘动物模型的要求。文献中报道的致敏方式多样,有腹腔注射、足底注射、皮下注射等不同注射部位[13]、OVA多种不同浓度,Al(OH)3佐剂[14]和弗氏佐剂[15]等不同佐剂,致敏的次数也有不同。本研究以观察到典型的EAR和LAR为目的,参考文献资料,初步确立了采用OVA和Al(OH)3佐剂混合作为致敏液在第0天首次皮下注射,第5天再次强化致敏,第37天雾化激发的实验方案,探索最佳造模方法。
LAR时期是哮喘炎症反应的主要阶段[16]。可稳定观察LAR的动物模型对哮喘机理研究和治疗药物研究的意义重大。鉴于目前没有合适的稳定观察LAR的OVA致敏哮喘动物模型,本研究建立了国内首个OVA作为变应原的无创、清醒挪威褐鼠过敏性哮喘发作全程记录模型,可记录和分析哮喘发作时EAR和LAR的变化,其主要指标Penh的升高和气道阻力的增加有很好的相关性[17-18],可以间接反映支气管的狭窄程度,而且和哮喘发作时呼气相延长也有一致性,本研究发现,Penh值的变化能很好的反映哮喘发作两相的强弱,可将其作为呼气相延长参数,用于喘息状态判定。
本研究对激发后哮喘发作状态的相关数据进行了16 h连续记录,每只动物获得1920个Penh数值。根据哮喘发作时人类EAR的特点为变应原吸入后10 min内发生,持续1至2 h,和对挪威褐鼠激发后Penh曲线的分析,将本模型的EAR定义为激发后前1 h。在EAR结束后立即进入LAR时期,可持续十几小时,此时的Penh值开始剧烈升高,动物喘息增加,达峰值后开始下降,喘息缓解,最后下降到基线或接近基线水平,降至基线水平以下为哮喘发作状态完全缓解。本模型的LAR部分定义为EAR结束后至Penh曲线与基线交叉时止。基线定义为正常对照组16 h的Penh均值加上3倍标准差,EAR和LAR的有效Penh值为高于基线的部分。
IgE在哮喘激发中起重要作用,是致敏成功的关键,本研究发现加入Al(OH)3佐剂的致敏液比单纯OVA致敏产生的IgE更多,在一定剂量范围,IgE含量均随OVA浓度增加而增加,与文献报道相同[19-20];还发现致敏液中加入等量Al(OH)3佐剂后,IgE含量亦均随OVA浓度增加而增加。本研究发现,致敏后IgE含量在一定时间范围内,有时间依赖性增长的趋势,在1周后IgE水平开始快速升高,2周后涨幅变缓慢呈现稳定的持续增长,第5周达到高峰后开始下降。所以在d 0致敏后,二次强化致敏的时间应选择在7 d以内,此时IgE抗体水平较低,机体再次接触OVA时仍属于致敏阶段,而不会激发哮喘发作。鉴于已有文献证实高IgE含量对哮喘发作有促进作用[21],所以根据本模型观察哮喘发作的特点,造模的激发时间应控制在第5周左右,可在较高IgE水平下激发,以获得较好的EAR和LAR反应图像。在第38天时IgE含量略有下降,可能是由于第37天激发时消耗了一些抗体,也可能是抗体在5周后就会出现下降的趋势,其具体原因还需要进一步研究。
本研究发现在低IgE含量时,很难观察到哮喘EAR和LAR,高IgE含量时,更易观察到哮喘发作,且EAR和LAR更易连续出现,表明在一定范围内,随IgE含量增长,哮喘发作增强,与文献报道的IgE含量对哮喘发作有促进作用相符。但IgE并不是唯一影响因素,致敏除了产生IgE对哮喘发作造成影响外,致敏条件本身也会影响哮喘发作。本研究发现IgE含量相当的两组,其中添加Al(OH)3佐剂的组比未添加组更能促进EAR和LAR的出现,本研究还发现添加了Al(OH)3佐剂致敏的6组中,每组有超过一半的动物可连续观察到EAR和LAR,未添加组则很难观察到,说明Al(OH)3佐剂除了促进IgE生成,加强致敏反应外,也能促进哮喘发作。与文献报道的Al(OH)3能促进Th2反应增强,即Al(OH)3有利于哮喘发展[22]相一致。所以本模型适宜选择能产生较高IgE且添加Al(OH)3佐剂的方法来致敏。
在最佳造模方法的确立方面,本研究发现OVA 0.01组显示出低IgE水平,与正常对照组没有明显差异,提示单纯使用0.01 mg OVA致敏效果欠佳,且激发后无法观察到EAR和LAR,该方法不适合进行造模。IgE含量高且添加Al(OH)3佐剂的OVA 10.0 & Al(OH)3100和OVA 10.0 & Al(OH)3gel 4组相比其他组更易连续观察到EAR和LAR,两组均能产生较好的EAR,但LAR部分,使用Al(OH)3胶体时有的动物不能出现LAR,而使用干粉组全部出现LAR。二组虽然IgE水平相近,但使用的佐剂剂型和含量不同,胶体与OVA需按照一定体积比混合才能保证稳定性,其最大使用量即为OVA 10.0 & Al(OH)3gel 4组的用量(含Al(OH)34 mg),干粉只能配成混悬液不受稳定性限制可以按需使用,所以干粉组能全部出现LAR可能与其使用的Al(OH)3含量高,而使Th2反应增强有关。同时,在其他组中,OVA剂量相同佐剂剂量不同时,高剂量佐剂组更易连续观察到EAR和LAR,也从一定程度上说明Al(OH)3佐剂含量高时更利于促进哮喘发作。对于本研究的模型,想要观察到好的EAR和LAR图像,不仅要选择较高的IgE含量同时还要选择合适的佐剂。当研究主要关注LAR,特别是关注炎症反应部分的研究时,推荐使用本研究中OVA 10.0 & Al(OH)3100组的造模方法。主要关注EAR时,也可将Al(OH)3干粉换成Al(OH)3胶体,使用OVA 10.0 & Al(OH)3gel 4组的造模方法,相比使用干粉,胶体使用量少,且易与OVA混合,方便注射,但某些动物有无法产生LAR的风险,对EAR无影响,所以需根据实际情况选择。
本研究发现,OVA混合Al(OH)3联合致敏,其注射点处会形成持久性结节,一直到第38天处死时,仍不消退,透过皮肤触摸时结节质硬,不能移动。切开皮肤后看到结节薄膜完整,剪开后内部为湿润粉状,可能是聚集在一起的Al(OH)3,起到对OVA缓释的作用,减少注射后OVA扩散,达到持久致敏的效果(图5,见封二),此现象也可能与文献报道的铝佐剂能吸附抗原,形成抗原贮存库,增强抗原免疫原性[23]相关。
本研究遵循哮发病机制即I型超敏反应,变应原致敏激发后观察到了哮喘发作全过程,和嗜酸性粒细胞浸润为主的炎症反应,成功建立了OVA致敏的,在挪威褐鼠无创且清醒的状态下,可观察和记录到过敏性哮喘发作全过程的动物模型。确立了最佳致敏液配比为OVA10 mg/只混合Al(OH)3100 mg/只,第2次致敏强化时间为7 d以内,激发时间为第35天左右。
本模型作为国内首个以OVA作为抗原,在动物清醒状态下记录哮喘发作全过程的挪威褐鼠模型,弥补了以往哮喘动物模型需要麻醉的不足,更加贴近人类患者进行哮喘激发试验的情况,能完整模拟哮喘患者发病到缓解的全过程,可连续观察EAR和LAR反应,进行长达16 h或更长的记录,其数值和图像也可同步展示出来,方便进行实时观测。而且,应用该方法可对同一动物进行多次无创伤的检测,可进行手术、药物等干预因素施加前后的自身对比。本模型不仅可用于哮喘机理研究,也为哮喘治疗药物研究提供了一种新的工具和方法。有望在将来的哮喘研究中发挥重要作用。
参考文献:
[1]Twentyman OP, Finnerty JP, Holgate ST. The inhibitory effect of nebulized albuterol on the early and late asthmatic reactions and increase in airway responsiveness provoked by inhaled allergen in asthma [J]. Am Rev Respir Dis, 1991, 144(4): 782-787.
[2]莫碧文, 王昌明, 张珍祥,等. 雷公藤对哮喘大鼠气道重构及磷脂酰肌醇3激酶表达的影响 [J]. 中国应用生理学杂志, 2007, (3):359-364.
[3]Chen CG, Wang HY, Dai Y, et al. Tripterygium polyglycosid attenuates the established airway inflammation in asthmatic mice [J]. Chin J Integr Med, 2013, 19(4): 282-288.
[4]Zhao H, Zhang XD, Welinder H, et al. Anaphylactic bronchoconstriction in immunized guinea pigs provoked by inhalation and intravenous administration of hexahydrophthalic anhydride and methyltetrahydrophthalic anhydride [J]. Allergy, 1997, 52(1): 18-26.
[5]Zhang XD, Lötvalt J, Arakawa H, et al. Relationship between IgG1 levels and airway responses in guinea pigs actively and passively sensitized to hexahydrophthalic anhydride [J]. Allergy, 1998, 53(1): 20-27.
[6]Moy LY, Jia Y, Caniga M, et al. Inhibition of spleen tyrosine kinase attenuates allergen-mediated airway constriction [J]. Am J Resp Cell Molecular Biol, 2013, 49(6): 1085-1092.
[7]Zhang XD, Fedan JS, Lewis DM, et al. Asthma-like biphasic airway responses in Brown Norway rats sensitized by dermal exposure to dry trimellitic anhydride powder [J]. J Allergy Clin Immunol, 2004, 113(2): 320-326.
[8]ZhangXD, Murray DK, Lewis DM, et al. Dose-response and time course of specific IgE and IgG after single and repeated topical skin exposure to dry trimellitic anhydride powder in a Brown Norway rat model [J]. Allergy, 2002, 57(7): 620-626.
[9]Zosky GR, Sly PD. Animal models of asthma [J]. Clin Exp Allergy, 2007, 37(7): 973-988.
[10]Haczku A, Chung KF, Sun J, et al. Airway hyperresponsiveness, elevation of serum-specific IgE and activation of T cells following allergen exposure in sensitized Brown-Norway rats [J]. Immunology, 1995, 85(4): 598-603.
[11]Martin JG, Tamaoka M. Rat models of asthma and chronic obstructive lung disease [J]. Pulm Pharmacol Ther, 2006, 19(6): 377-385.
[12]Hylkema MN, Hoekstra MO, Luinge M, et al. The strength of the OVA-induced airway inflammation in rats is strain dependent [J]. Clin Exp Immunol, 2002, 129(3): 390-396.
[13]Wu CJ, Chou HW, Liou CJ, et al. Prophylactic vaccination with adjuvant monophosphoryl lipid A prevents Th2-mediated murine asthmatic responses [J]. J Asthma, 2013, 50(4): 327-333.
[14]Spiess PC, Kasahara D, Habibovic A, et al. Acrolein exposure suppresses antigen-induced pulmonary inflammation [J]. Respir Res, 2013, 14(1): 107.
[15]Noviello MLM, Batista NV, Dourado LPA, et al. Prolonged ingestion of ovalbumin diet by OVA sensitized mice suppresses mBSA-induced arthritis [J]. Cell Immunol, 2013, 284(1): 20-28.
[16]Taher YA, Henricks PAJ, van Oosterhout AJM. Allergen-specific subcutaneous immunotherapy in allergic asthma: immunologic mechanisms and improvement [J]. Libyan J Med, 2010, 5: 5303 - DOI: 10.3402/ljm.v5i0.5303
[17]Hamelmann E, Schwarze J, Takeda K, et al. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography [J]. Am J Respir Crit Care Med,1997; 156(3): 766-775.
[18]谢敏, 刘先胜, 徐永健, 等. 一种无创性检测哮喘大鼠气道高反应性的方法[J]. 华中科技大学学报:医学版, 2007, 36(1): 138-140.
[19]Pauwels R, Bazin H, Platteau B, et al. The influence of different adjuvants on the production of IgD and IgE antibodies [C]. Ann Immunol (Paris). 1979, 130(1): 49-58.
[20]崔红花, 郭娇, 杨超燕, 等. 不同剂量卵蛋白对豚鼠血清中IgE的影响 [J]. 中国实验方剂学杂志, 2010, 16(6): 141-143.
[21]Tanaka A, Jinno M, Hirai K, et al. Longitudinal increase in total IgE levels in patients with adult asthma: an association with poor asthma control [J]. Respir Res, 2014, 15(1): 144.
[22]Brewer JM, Conacher M, Hunter CA, et al. Aluminium hydroxide adjuvant initiates strong antigen-specific Th2 responses in the absence of IL-4-or IL-13-mediated signaling [J]. J Immunol, 1999, 163(12): 6448-6454.
[23]湛琳丽, 温昊, 祝明, 等. 铝佐剂的特性及影响因素 [J]. 畜牧市场, 2009, 5: 13-15.
〔修回日期〕2015-04-25
研究报告
Evaluation of asthma exacerbation in an ovalbumin-sensitized
conscious Brown Norway rat model
TAO Jing-jing, XU Yan-feng, HAN Yun-lin, XU Yu-huan, QIN Chuan, GAO Hong, ZHANG Xing-dong
(Key Laboratory of Human Disease Comparative Medicine, Ministry of Health; Key Laboratory of Human Diseases Animal Model,
State Administration of Traditional Chinese Medicine; Institute of Laboratory Animal Sciences, Chinese Academy of
Medical Sciences (CAMS) & Comparative Medical Center, Peking Union Medical College (PUMC), Beijing 100021, China )
【Abstract】ObjectiveTo establish an animal model in which both early-phase asthmatic response (EAR) and late-phase asthmatic response (LAR) can be observed after sensitization and subsequent inhalation challenge with ovalbumin (OVA). Animals were conscious with no narcotic used, unrestricted, and fed ad libitum. Methods Sixty-six SPF 6-8-week old male Brown Norway rats were divided into eleven equal groups. All groups of rats except normal control group were injected subcutaneously with 0.4 mL (sc in back, 2 sites, 0.2 mL/site) OVA or OVA + Al(OH)3solution on day 0 and day 5. Four groups were given OVA only at the dose of 0.01, 0.1, 1.0 or 10.0 mg/rat, five groups were given OVA + Al(OH)3powder at the dose of 0.1+100, 1.0+100, 10.0+100, 1.0+52 and 1.0+4 mg/rat, one group was given OVA+Al(OH)3gel at the dose of 10.0+4 mg/rat. Normal control group was injected subcutaneously with the same volume of saline. All the groups were challenged for 10 minutes with 5 mL 5%OVA aerosol on day 37. Enhanced pause (Penh) was recorded for 16 hours in a whole-body plethysmography system after challenge. Specific IgE of the serum samples on day 0, 7, 14, 21, 28, 35, 38 were measured by ELISA. Pulmonary pathological changes were observed using HE staining. ResultsCompared with the normal control group, immunized rats except the group given 0.01 mg OVA produced specific IgE (P<0.05), and the content of IgE grew sharply after 7 days, and always kept growing until 5 weeks. The whole course of asthma exacerbation was recorded successfully. The rats developed EAR and/or LAR within 16 hours following OVA challenge. Especially the groups injected with 10 mg OVA and 100 mg Al(OH)3or 4 mg Al(OH)3gel showed steady pattern of biphasic airway responses and their EAR or LAR peak, and the area under the curve were increased significantly compared with those of the normal control group (P<0.05). Inflammation characterized by eosinophil infiltration was observed in the rat lung of model group (OVA 10.0 & Al(OH)3100 group as a representative case). ConclusionsIn this work we successfully developed a new model using conscious rats, and the whole time course of asthma exacerbation in this model can be observed after OVA challenge. This model may become a useful tool for further asthma research.
【Key words】Allergic asthma; Brown Norway rats; Enhanced pause; Early-phase asthmatic response; Late-phase asthmatic response
doi:10.3969.j.issn.1671.7856. 2015.006.001
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2015) 06-0001-08
[通讯作者]张星东,教授,Email: zhangxd@cnilas.org;高虹,教授,硕士生导师,E-mail: gaohongdws@aliyun.com。
[作者简介]陶婧婧,女,硕士研究生,研究方向:过敏性哮喘治疗研究。
[基金项目]中国医学科学院医学实验动物研究所人才引进基金(编号: DWS201202);973计划(2011CB504903);863计划(2013AA020106)。
