慢性束缚应激模型致焦虑和抑郁共病的行为学研究
2016-01-28孙秀萍宋铭晶
孙秀萍,张 楠,高 杰,宋铭晶,秦 川
(1. 北京协和医学院比较医学中心 中国医学科学院北京协和医学院实验动物研究所,
卫生部人类疾病比较医学重点实验室,国家中医药管理局人类动物模型三级实验室 北京 100021)
慢性束缚应激模型致焦虑和抑郁共病的行为学研究
孙秀萍,张楠,高杰,宋铭晶,秦川
(1. 北京协和医学院比较医学中心 中国医学科学院北京协和医学院实验动物研究所,
卫生部人类疾病比较医学重点实验室,国家中医药管理局人类动物模型三级实验室 北京100021)
【摘要】目的建立焦虑抑郁共病动物模型,为焦虑抑郁共病的神经生物学机制及治疗方法的研究奠定基础。方法C57BL/6J小鼠随机分为正常组、模型组和西酞普兰组。采用慢性束缚加孤养方法建模,模型组和西酞普兰组每日束缚4 h(10:00~14:00),连续进行35 d,单笼饲养。造模14 d后,正常组和模型组给予生理盐水,西酞普兰组给予西酞普兰10 mg/kg,腹腔注射,注射剂量为0.1 mL/10 g,给药时间为21 d。应用糖水偏爱实验和强迫游泳实验评价模型抑郁症状的转化效度,应用空场实验和高架十字迷宫实验评价模型焦虑症状的转化效度,同时观察西酞普兰对焦虑抑郁模型行为学改善作用。结果糖水偏爱实验和强迫游泳实验结果显示,慢性束缚模型组糖水偏爱指数明显下降,强迫游泳不动时间明显延长,与正常组比较差异具有显著性(P<0.01,P<0.01)。空场实验结果显示,模型组小鼠在中央区停留时间和运动路程明显减少,与正常组比较差异具有显著性(P<0.01,P<0.05)。西酞普兰增加模型小鼠的中央区时间及中央区运动路程(P<0.05,P<0.05)。高架十字迷宫实验结果显示,模型组动物进入开臂次数比例及时间比例下降,与正常组比较具有显著性差异(P<0.05,P<0.05)。西酞普兰未能逆转这种行为学改变。结论慢性束缚应激模型表现为焦虑抑郁共病,转化效度稳定,可作为焦虑抑郁共病动物模型,用于焦虑抑郁共病生物学机制及其治疗研究。
【关键词】慢性束缚;应激;小鼠,焦虑症,抑郁症
近年来,焦虑症和抑郁症发病率不断攀升。二者虽是相互独立的疾病单元,但在临床上共病发生率很高,约有一半的抑郁症患者伴发焦虑症[1]。应激因素是这两种精神疾患的重要风险因子,因此应激动物模型广泛应用于焦虑症和抑郁症神经生物学机制及其治疗策略研究[2]。但目前,尚缺乏转化效度稳定的焦虑、抑郁共病应激动物模型。动物实验研究表明,非社会应激因素引起明显的抑郁症状,但焦虑行为表现不稳定,而社会应激因素更多产生焦虑行为,所伴发的抑郁症状不稳定[3]。建立转化效度更为稳定的焦虑抑郁共病动物模型,对临床焦虑抑郁共病的治疗具有重要意义。慢性束缚应激,作为非社会应激因素,广泛应用于应激相关疾病的研究[4]。孤养,即将动物单笼饲养,对于群居动物,是一种社会应激因素。本研究复合非社会应激因素和社会应激因素,采用慢性束缚加孤养应激方式,研究小鼠的焦虑和抑郁共病行为,建立稳定的焦虑、抑郁共病动物模型,为焦虑抑郁共病的病理生理机制及治疗研究奠定基础。西酞普兰(citalopram)是选择性5-羟色胺再摄取抑制剂,具有抗焦虑和抗抑郁双重作用。本研究同时观察西酞普兰对焦虑抑郁共病动物模型行为的改善作用。
1材料和方法
1.1动物
C57BL/6J雄性小鼠,SPF级,体重25 g,30只。由北京华阜康生物科技股份有限公司提供。许可证号:SCXK(京)2014-0004。动物使用许可证号:SYXK(京)2014-0029。动物自由进食进水,室内温度:(23~25)℃,相对湿度:(55±10)%。维持12 h光照/12 h黑暗的昼夜节律。动物适应环境1周进行实验。
1.2仪器
动物行为学视频跟踪系统(Noldus Information Technology,EthoVision XT,The Netherlands).
1.3实验方法
动物随机分为正常组、慢性束缚组、西酞普兰组,每组10只。模型组和西酞普兰组动物单笼饲养,慢性束缚方法参照文献[5],将动物置于50 mL 离心管(离心管上烙制直径2 mm小孔数十个,用于通风),每日束缚4 h(10:00~14:00),连续进行35 d。正常组动物5只/笼,不给予任何干预,放置在另一房间。造模14 d后,正常组和模型组给予生理盐水,西酞普兰组给予西酞普兰10 mg/kg。三组均腹腔注射,注射剂量为0.1 mL/10 g,给药时间为21 d。造模结束,进行行为学实验。
1.3.1糖水偏爱实验:根据文献报道[6],糖水偏爱测试方法分为训练期和测试期。训练期内,使动物适应蔗糖饮水,第1个24 h,给予动物两瓶1%蔗糖水,第2个24 h,给予动物1瓶1%蔗糖水,1瓶纯水。测试前不禁食禁水,测试期,同样给予动物1瓶1%蔗糖水,1瓶纯水,测试时间为15 h。为避免位置偏爱影响因素,测试中间,将两瓶位置互换。测试结束,计算糖水偏爱指数(糖水偏爱指数=糖水消耗/ 总液体消耗 × 100%)。
1.3.2空场实验:方形空场环境尺寸为50 cm × 50 cm × 30 cm(长×宽×高)。中央区是以空场中心点为中心,边长20 cm的正方形区域,边缘区宽8 cm。将小鼠置于空场,观察5 min 内的自发活动及在中央区和边缘区的停留时间。实验采用动物行为学视频跟踪系统,记录动物的运动路程、速度及在各区的停留时间等。
1.3.3强迫游泳实验:动物在测试房间适应1 h后,进行强迫游泳实验。根据文献[7],将小鼠放入高20 cm,直径12 cm,水深10 cm的圆形玻璃容器中,水温25℃,观察6 min,记录后4 min内动物的累计不动时间。判定不动的标准是动物在水中停止挣扎,呈漂浮状态,仅有细小的肢体运动以保持头部浮在水面。
1.3.4高架十字迷宫实验:高架十字迷宫由两对相对开臂和两对相对闭壁成十字交叉型组成,开壁尺寸为30 cm × 5 cm(长×宽),闭臂尺寸为30 cm × 5 cm × 15 cm(长×宽×高),中央区尺寸为5 × 5 cm,连接四壁。四壁距离地面100 cm。根据文献[8],将动物面对开臂方向,放在中央区,观察动物在开臂和闭臂中的活动情况。实验采用动物行为学视频跟踪系统,记录动物进入开壁时间(open arm time,OT)和次数(open arm entry,OE),进入闭壁的时间(close arm time,CT)和次数(close arm entry,CE)。计算动物进入开壁次数比例(OE%=OE/(OE + CE) × 100%)以及开壁时间比例(OT%=OT/(OT + CT) × 100%)。
1.4统计学方法
2结果
2.1 慢性束缚模型对小鼠糖水偏爱实验的影响
如图1所示,慢性束缚模型组糖水偏爱指数下降,与正常组比较,差异具有极显著性(P<0.01)。西酞普兰提高模型组糖水偏爱指数,差异具有显著性(P<0.05)。
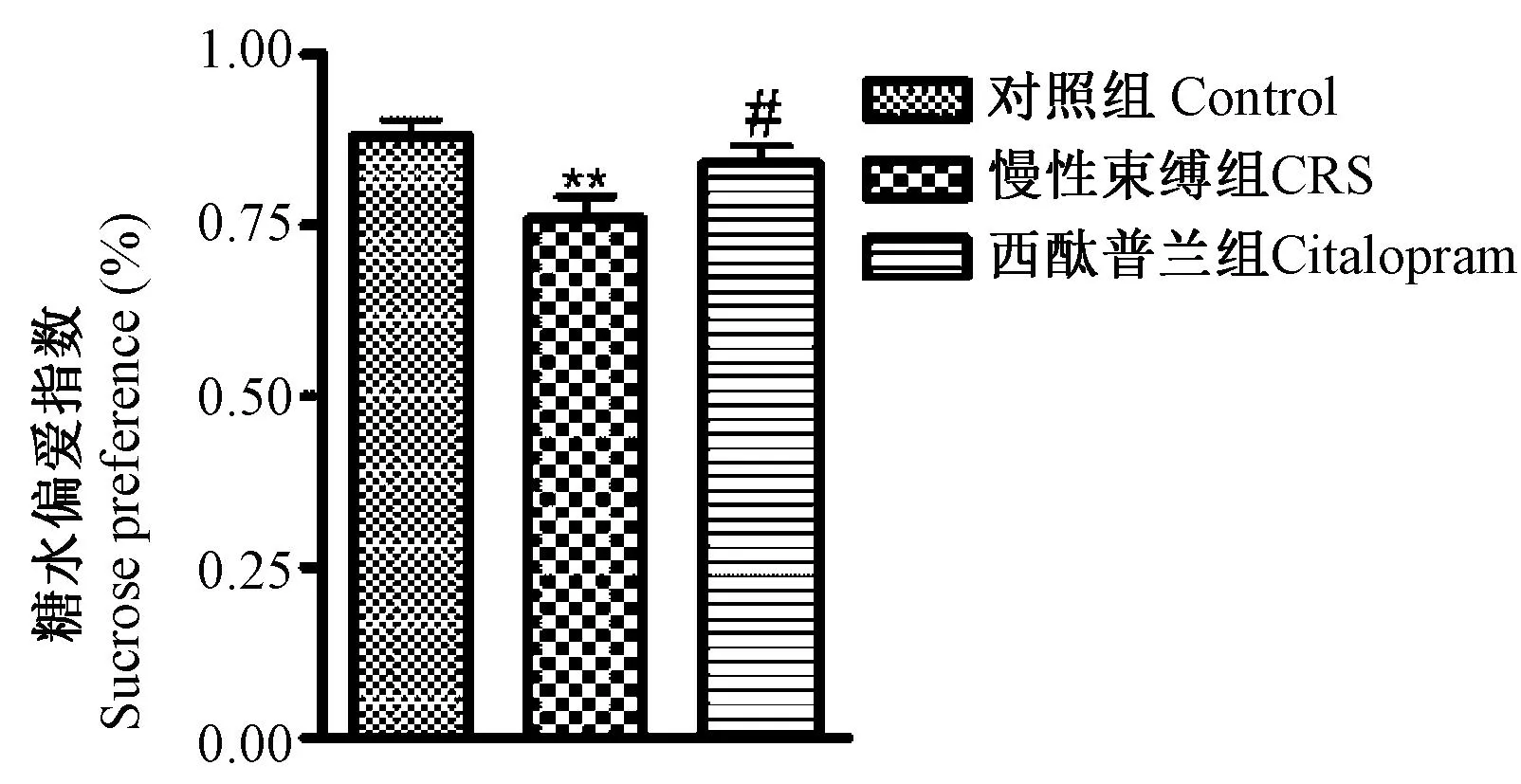
图1 慢性束缚模型对糖水偏爱指数的影响,与正常组比较;# P<0.05,与模型组比较)Fig.1 Effect of chronic restraint stress on the sucrose preference test in the mice ±s, ** P<0.01, compared with the control group; # P<0.05, compared with the model group)
2.2 慢性束缚模型对小鼠强迫游泳实验的影响
如图2所示,慢性束缚模型组强迫游泳不动时间显著延长,与正常组比较,差异具有极显著性(P<0.01)。西酞普兰缩短强迫游泳不动时间,与模型组比较,差异具有显著性(P<0.05)。
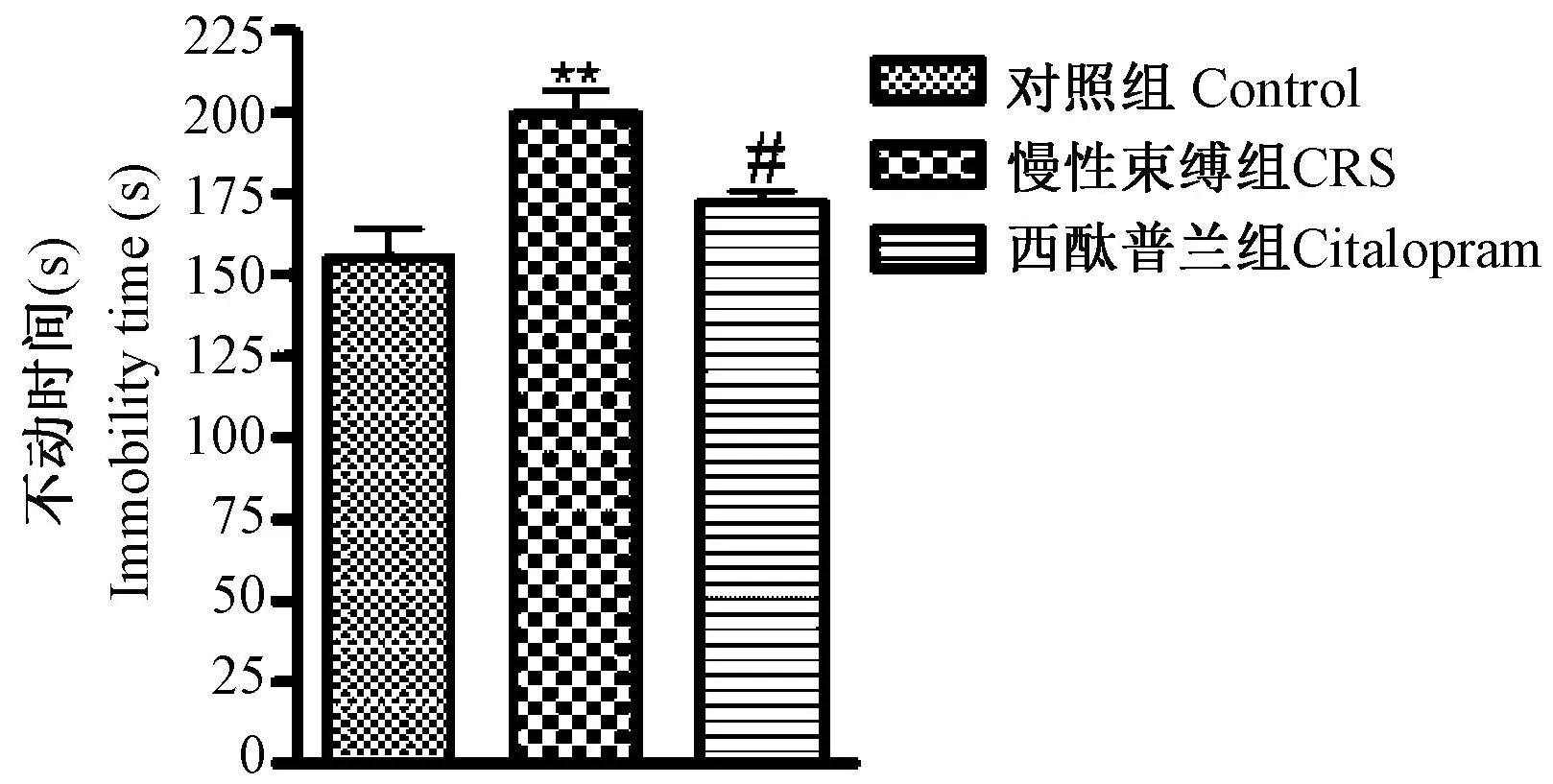
图2 慢性束缚模型对强迫游泳实验的影响,与正常组比较;# P<0.05,与模型组比较)Fig.2 Effect of forced swim test on the immobility time in the compared with the control group; # P<0.05, compared with the model group)
2.3 慢性束缚模型对小鼠空场实验的影响
如图3A和3B所示,慢性束缚模型组和正常组小鼠的运动路程和运动速度无显著性差异,表明慢性束缚的应激方式未影响动物的运动能力。如图3C所示,模型组小鼠在中央区时间明显减少,与正常组相比,差异具有极显著性(P<0.01);西酞普兰增加小鼠的中央区时间,与模型组相比,差异具有显著性(P<0.05)。如图3D所示,模型组小鼠在中央区运动路程明显减少,与正常组相比,具有显著差异(P<0.05);西酞普兰增加小鼠的中央区运动路程,与模型组相比,具有显著性差异(P<0.05)。
2.4 慢性束缚模型对小鼠高架十字迷宫的影响
如图4A所示,慢性束缚模型减少小鼠进入开臂次数比例,与正常组相比,差异具有显著性(P<0.05);西酞普兰组进入开臂次数比例增加,但与模型组相比差异无显著性(P=0.055)。如图4B所示,慢性束缚模型减少小鼠进入开臂时间比例,与正常组相比,差异具有显著性(P<0.05);西酞普兰组进入开臂次数比例增加,但与模型组相比差异无显著性。
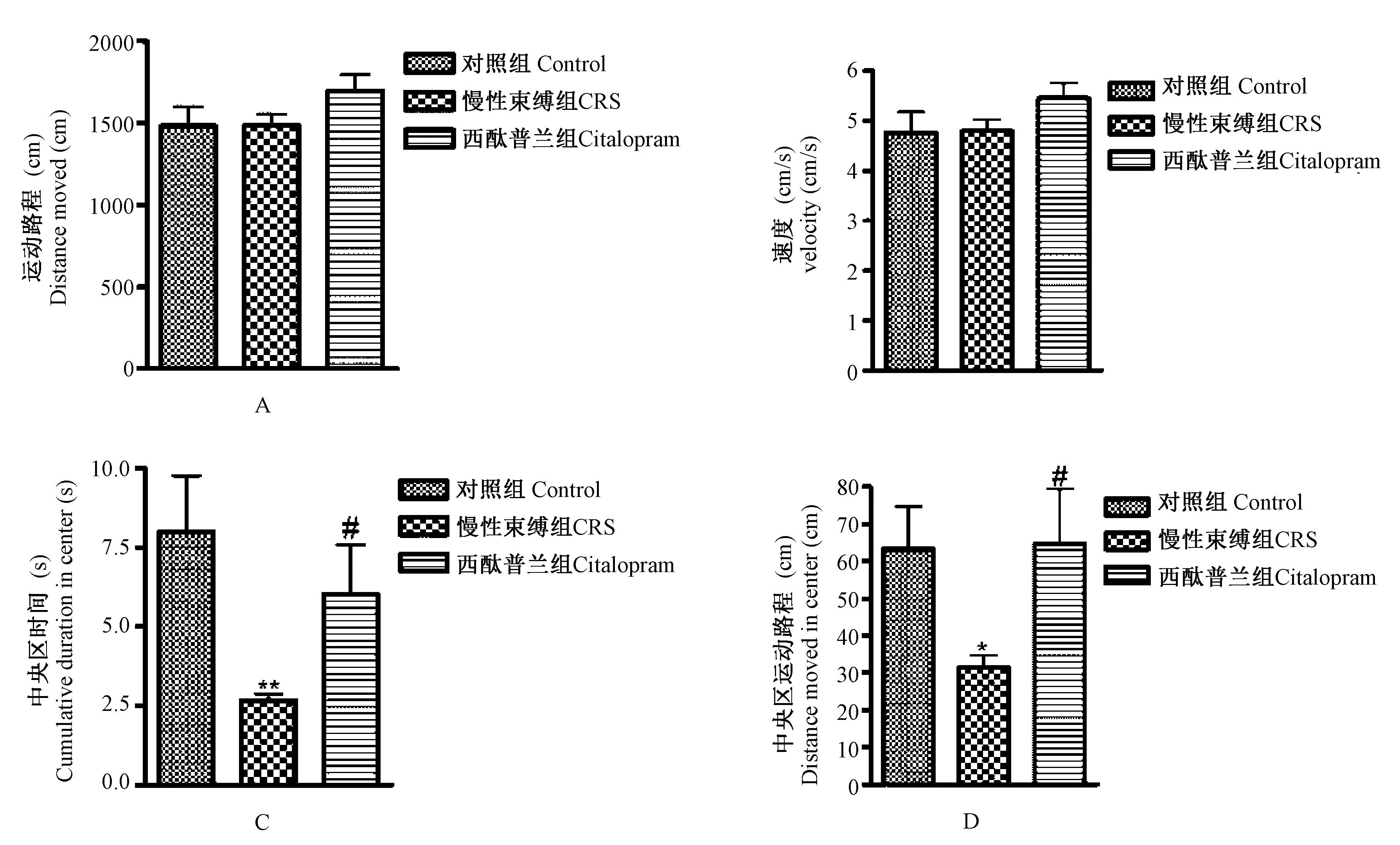
图3 慢性束缚模型对空场实验的影响,与正常组比较;# P<0.05,与模型组比较)Fig.3 Effect of chronic restraint stress on open field test in the mice ±s ** P<0.01, compared with the control group; # P<0.05, compared with the model group)

图4 慢性束缚模型对高架十字迷宫实验的影响±s, * P<0.05,与正常组比较)Fig.4 Effect of chronic restraint stress on elevated plus maze test in the mice ±s, * P<0.05,compared with the control group)
3讨论
动物模型的转化效度评价包括表观效度(face validity)、预测效度(predictive validity)和结构效度(construct validity)三个层面[9]。表观效度指动物模型中动物和人类之间症状学的相似性。预测效度指治疗药物能有效干预动物模型的相应症状表现,结构效度指模型与某个假说理论的符合程度。本研究基于应激是焦虑症、抑郁症等精神疾患的重要风险因子理论,研究了小鼠接受非社会因素(慢性束缚)和社会因素(孤养)叠加应激后的焦虑及抑郁行为表现,并观察西酞普兰(具有抗抑郁和抗焦虑双重作用)对模型焦虑和抑郁行为的改善作用。因此本研究从表观效度、预测效度和结构效度三个方面考察了慢性束缚小鼠模型的转化效度。
快感缺失是动物抑郁行为最为核心的症状之一,啮齿类动物快感缺失的定量评价方法主要为糖水偏爱实验 (sucrose preference test)[10]。该行为学评价方法基于啮齿类动物(主要为大小鼠)喜好糖水的天性, 是目前使用最为广泛的用于评价快感缺失的动物行为学测试方法。本研究结果显示,经过35 d的慢性束缚应激,模型小鼠的糖水偏爱指数明显下降,与正常组比较差异具有极显著性。强迫游泳实验是动物被迫在一个局限的空间游泳,首先试图挣扎逃跑,随后处于一种间歇性不动状态,这种状态被称为“行为绝望”,与人类抑郁症相似[11]。本研究结果表明,模型小鼠强迫游泳的不动时间显著延长。糖水偏爱实验和强迫游泳实验结果提示模型小鼠出现抑郁样行为。
动物焦虑行为学评价方法主要基于动物对新环境既产生恐惧又产生探究的矛盾心理冲突[12]。空场实验中,中央区对动物来说,是未知的威胁情景,焦虑水平高的动物由于对陌生环境的恐惧,主要在边缘区域活动,而在中央区域活动较少[13]。本研究结果显示,慢性束缚应激模型小鼠在中央区的停留时间及运动路程明显减少,提示模型出现焦虑行为。高架十字迷宫实验中,由于开臂和外界相通,对动物来说具有一定的新奇性同时又具有一定的威胁性,焦虑水平高的动物会离开开臂退缩到闭臂中,反之则在开臂停留更多的时间,对开臂的探究次数也增多。本研究结果显示,慢性束缚应激模型小鼠进入开壁的时间比例和次数比例均显著下降,提示产生焦虑行为,与空场实验结果一致。
以上实验结果提示,经过35 d的慢性束缚加孤养,小鼠同时表现出抑郁和焦虑行为,提示慢性束缚应激模型具有较好的抑郁焦虑共病表观效度。
西酞普兰为选择性5-羟色胺再摄取抑制剂,具有抗抑郁和抗焦虑双重作用[14]。本研究中,西酞普兰可提高慢性束缚模型的糖水偏爱指数,缩短强迫游泳不动时间,显示其良好的抗抑郁作用。同时,西酞普兰可增加模型小鼠空场实验中在中央区的停留时间和运动路程,显示其抗焦虑作用。但是,西酞普兰对高架十字迷宫中,模型小鼠进入开臂的次数和时间比例无影响,这可能与动物在高架十字迷宫实验中的个体差异较大有关。西酞普兰的上述作用提示慢性束缚应激模型具有较好的预测效度。
综上所述,慢性束缚应激模型表现为焦虑抑郁共病,西酞普兰可逆转这些行为学改变。该模型可作为焦虑抑郁共病动物模型,用于焦虑抑郁共病神经生物学机制及其治疗研究。
参考文献:
[1]Hirschfeld RMA. The comorbidity of major depression and anxiety disorders: recognition and management in primary care [J]. Prim Care Companion J Clin Psychiatry. 2001,3(6): 244-254.
[2]Bouwknecht JA. Behavioral studies on anxiety and depression in a drug discovery environment: Keys to a successful future [J]. Eur J Pharmacol. 2014, 753(2015): 158-176.
[3]Yoon SH, Kim BH, Ye SK, et al. Chronic non-social stress affects depressive behaviors but not anxiety in mice [J]. Korean J Physiol Pharmacol. 2014, 18(3): 263-268.
[4]Barha CK, Brummelte S, Lieblich SE, et al. Chronic restraint stress in adolescence differentially influences hypothalamic-pituitary-adrenal axis function and adult hippocampal neurogenesis in male and female rats [J]. Hippocampus. 2011, 21(11): 1216-1227.
[5]Zhang W, Rosenkranz JA. Repeated restraint stress enhances cue-elicited conditioned freezing and impairs acquisition of extinction in an age-dependent manner [J]. Behav Brain Res. 2013, 248(0): 12-24.
[6]Schweizer MC, Henniger MS, Sillaber I. Chronic mild stress (CMS) in mice: of anhedonia, ‘anomalous anxiolysis’ and activity [J]. PLoS ONE. 2009, 4(1): e4326.
[7]Chhillar R, Dhingra D. Antidepressant-like activity of gallic acid in mice subjected to unpredictable chronic mild stress [J]. Fundam Clin Pharmacol. 2012, 27(4): 409-418.
[8]Colla AR, Rosa JM, Cunha MP, et al. Anxiolytic-like effects of ursolic acid in mice [J]. Eur J Pharmacol. 2015, 758(2015): 171-176.
[9]Willner P. Validity, reliability and utility of the chronic mild stress model of depression: a 10-year review and evaluation [J]. Psychopharmacology (Berl). 1997, 134(4): 319-329.
[10]Strekalova T, Spanagel R, Bartsch D, et al. Stress-induced anhedonia in mice is associated with deficits in forced swimming and exploration [J]. Neuropsychopharmacology. 2004, 29(11): 2007-2017.
[11]Porsolt R, Bertin A, Jalfre M. Behavioral despair in mice: a primary screening test for antidepressants [J]. Arch Int Pharmacodyn Ther. 1977, 229(2): 327-336.
[12]亓晓丽, 林文娟. 焦虑和抑郁动物模型的研究方法和策略[J]. 心理科学进展, 2005, 13(03): 327-332.
[13]Prut L, Belzung C. The open field as a paradigm to measure the effects of drugs on anxiety-like behaviors: a review [J]. Eur J Pharmacol. 2003, 463(1-3): 3-33.
[14]Andreasen JT, Fitzpatrick CM, Larsen M, et al. Differential role of AMPA receptors in mouse tests of antidepressant and anxiolytic action [J]. Brain Res. 2015, 1601(2015): 117-126.
〔修回日期〕2015-05-07
研究报告
Chronic restraint stress produces comobidity behavior of
anxiety and depression disorders in mice
SUN Xiu-ping, ZHANG Nan, GAO Jie, SONG Ming-jing, QIN Chuan
(1.Comparative Medicine Center,Peking Union Medical College (PUMC), and Institute of
Laboratory Animal Science, Chinese Academy of Medical Sciences (CAMS); Key Laboratory of
Human Disease Comparative Medicine, Ministry of Health; Key Laboratory of Human
Disease Animal Models, State Administration of Traditional Chinese Medicine, Beijing 100021, China)
【Abstract】ObjectiveTo investigate the effect of chronic restraint stress on the comobidity behavior of anxiety and depression disorders in mice. MethodC57BL/6J mice were randomly divided into 3 groups (n=10 per group): control (normal saline), chronic restraint stress (normal saline), and positive control (citalopram, 10 mg/kg). Citalopram and normal saline were administered by intraperitoneal injection. Chronic restraint stress and individual housing was applied to establish the stress model. The mice were individually housed and restrained for 4 h per day in a 50-mL polypropylene conical tube with ventilation holes. This daily restraint was repeated for 35 consecutive days. Sucrose preference test and forced swim test were applied to evaluate the depressive behavior of the mice. Open field test and elevated plus maze test were used to assess the anxiety effect of chronic restraint stress in the mice. ResultsThe sucrose intake was significantly reduced in the chronic restraint stress models compared with the control mice (P<0.01). The immobility time was increased in the forced swim test (P<0.01). The cumulative duration and distance moved in the center were decreased in the open field test(P<0.01,P<0.05). Chronic treatment with citalopram reversed the above mentioned behavior change. The open arm entry and open arm time were decreased in the elevated plus maze test (P<0.05,P<0.05). Citalopram did not reverse this behavior change. ConclusionsMouse models created by chronic restraint and individual housing stress display both anxiety and depressive behavior making them a potent animal model in the treatment of comorbidity of anxiety and depression disorders.
【Key words】chronic restraint; stress; mice; anxiety; depression
doi:10.3969.j.issn.1671.7856. 2015.006.004
【中图分类号】R-33
【文献标识码】A
【文章编号】1671-7856(2015) 06-0018-05
[通讯作者]秦川,研究员,E-mail: qinchuan@pumc.edu.cn。
[作者简介]孙秀萍(1974-),女,助理研究员,博士,研究方向:神经精神疾病药理及方法学。
[基金项目]北京市自然科学基金资助项目(资助编号:7142105)。
