氟比洛芬酯对食管癌患者围术期外周血树突状细胞亚群数量的影响
2015-02-01柴小青疏树华张晓琳谢言虎
王 迪,柴小青,疏树华,张晓琳,魏 昕,谢言虎
氟比洛芬酯对食管癌患者围术期外周血树突状细胞亚群数量的影响
王迪,柴小青,疏树华,张晓琳,魏昕,谢言虎
(安徽医科大学附属省立医院,安徽省立医院麻醉科,安徽 合肥230001)
摘要:目的观察氟比洛芬酯对食管癌患者围术期外周血中天然树突状细胞(dendritic cells,DCs)亚群数量的影响。方法纳入健康志愿者20例和拟行开胸食管中段癌根治切除术患者40例(对照组20例、干预组20例)。干预组术前(切皮前30 min)给予氟比洛芬酯(2 mg·kg-1),术毕(缝皮前30 min)给予氟比洛芬酯(2 mg·kg-1),对照组术前、术毕给予脂肪乳。两组患者术后均使用舒芬太尼+昂丹司琼行自控静脉镇痛(patient-controlled intravenous analgesia, PCIA)。流式细胞术检测术前、术毕24、48 h外周血中髓样DC(myeloid-DCs, mDCs)和浆细胞样DC(plasmacytoid-DCs, pDCs)两个主要亚群在外周血单个核细胞(peripheral blood mononuclear cells, PBMCs)中所占比例及其变化。记录术后48 h内的视觉模拟评分(visual analogue scale, VAS)和舒芬太尼消耗量。结果与健康志愿者相比,食管癌患者外周血mDCs和pDCs亚群在PBMCs中所占比例均显著降低。与对照组相比,干预组患者使用氟比洛芬酯后,术毕24 h外周血中mDCs和pDCs亚群数量显著升高;术毕48 h对照组和干预组患者外周血中mDCs、pDCs亚群数量无显著差异。术毕12、24、36、48 h的对照组和干预组患者VAS评分无显著差异;与对照组相比,干预组患者术毕48 h消耗的舒芬太尼显著减少。结论 使用氟比洛芬酯进行围术期镇痛时可以一定时间内上调食管癌患者外周血中DCs亚群水平。
关键词:氟比洛芬酯;食管癌;树突状细胞
树突状细胞(dendritic cells,DCs)是机体功能最强的专职抗原呈递细胞(antigen-presenting cells,APCs),外周血中存在的主要是未成熟DCs,其数量不足外周血单个核细胞(peripheral blood mononuclear cells,PBMCs)的1%,但是具有较强的吞噬、迁移能力。外周血DCs在接触肿瘤相关抗原(tumor-associated antigens,TAAs)刺激时即分化为成熟DCs并迁移至外周淋巴器官,激活以1型辅助性T细胞(helper T cells,Th1)和细胞毒T细胞(cytotoxic T lymphocytes,CTLs)为主体的细胞免疫反应,启动、调控和维持抗肿瘤免疫应答[1-2]。DCs与食管癌的发生、发展存在密切关系,肿瘤组织浸润DCs数量多则患者预后好[3-5]。既往研究表明,从外周血中分离单核细胞体外诱导的DCs(monocytes-induced DCs,MoDCs),利用TAAs致敏后回输或免疫接种于载瘤宿主,可诱发特异性抗肿瘤免疫反应[6-7]。近期研究发现,直接将外周血天然DCs分离后富集,体外负载TAAs回输至恶性肿瘤患者体内,可以显著改善患者预后,延长生存时间,提示外周血中的未成熟天然DCs具有强大的抗肿瘤潜力[8-9]。围术期使用非甾体抗炎药物(non-steroidal anti-inflammatory drugs,NSAIDs)氟比洛芬酯不仅可以显著缓解手术应激和疼痛、节俭阿片类镇痛药物的用量,还可以进一步改善对Th1和CTLs介导抗肿瘤免疫的抑制[10-12]。根据其表面标记和功能,外周血中的DCs可分为髓样DC(myeloid-DCs,mDCs)和浆细胞样DC(plasmacytoid-DCs,pDCs)两个主要亚群[13-14]。本课题即观察围术期使用氟比洛芬酯对食管癌患者外周血mDCs、pDCs亚群数量的影响。
1资料和方法
1.1病例纳入本课题经我院伦理委员会批准,受试者签署知情同意书,研究方案报中国临床试验注册中心审核通过(注册号ChiCTR-IPR-15006482)。纳入45~65岁,健康志愿者20例和拟行开胸食管中段癌根治切除术患者40例(对照组20例、干预组20例),美国麻醉医师协会(American Society of Anesthesiologists,ASA)评分Ⅰ~Ⅱ级,由同一组医生行同一术式(右进胸,胸腹两切口),排除肺、肝、肾功能障碍,近期接受放、化疗,长期使用激素,自身免疫病及围术期输注异体血制品者。
1.2分组及处理干预组术前(切皮前30 min)给予氟比洛芬酯(2 mg·kg-1)预处理,术毕(缝皮前30 min)给予氟比洛芬酯(2 mg·kg-1)。对照组术前、术毕给予安慰剂脂肪乳。两组患者术后均使用舒芬太尼+昂丹司琼行自控静脉镇痛(patient-controlled intravenous analgesia,PCIA)。术中常规使用舒芬太尼、瑞芬太尼镇痛。于术前30 min、术毕24、48 h收集外周静脉血待测。
1.3麻醉处理患者入室后开放外周静脉,常规监测有创动脉血压、中心静脉压、心电图、脉搏血氧饱和度,呼气末CO2分压及鼻咽核心温度。两组患者全麻诱导均给予咪唑安定(0.1 mg·kg-1)、依托咪酯(0.3 mg·kg-1)、舒芬太尼(0.4 mg·kg-1)、罗库溴铵(0.6 mg·kg-1)后行双腔支气管内插管,纤支镜确定导管位置无误,气道压小于30 cmH2O,吸入氧浓度为100%,吸呼比=1∶2,调节通气频率每分钟10~15次,维持呼气末CO2分压为30~40 mmHg。全麻维持期间泵注丙泊酚和瑞芬太尼,间断吸入七氟烷,监测麻醉深度。
1.4分离PBMCsFicoll-Hypaque密度梯度离心法分离PBMCs。外周静脉血2 mL与等量无菌生理盐水稀释混匀,缓慢沿离心管壁铺在4 mL淋巴细胞分离液上,室温下水平离心(1 500 rpm,20 min),离心后管内分为四层,自上而下依次为血浆、血液稀释液及绝大部分血小板层,云雾状的PBMCs层,淋巴细胞分离液层,红细胞及粒细胞层。将PBMCs转移至另一离心管中待测。
1.5检测mDCs、pDCs亚群比例向PBMCs中加入FITC标记的Lin抗体(CD3, CD14, CD19, CD20, CD56),APC标记的HLA-DR抗体,PE标记的CD11c和CD123抗体,37°C下避光孵育2 h,上流式细胞仪(FCM)检测,以PBMCs中mDCs(Lin-HLA-DR+CD11c+)和pDCs(Lin-HLA-DR+CD123+)所占比例代表mDCs和pDCs亚群数量,以Lin-的PBMCs设门(见图1a),(HLA-DR+CD11c+)和(HLA-DR+CD123+)分别代表mDCs和pDCs。
1.6PCIA评价记录术后48 h内的视觉模拟评分(visual analogue scale, VAS)和舒芬太尼消耗量。
1.7统计学分析采用SPSS17.0统计学软件进行分析。计量资料以均数±标准差表示,组间比较采用单因素方差分析或t检验。计数资料用例数或率表示,组间比较为卡方检验。P<0.05认为差异有统计学意义。
2结果
2.1一般情况两组患者年龄、性别构成比、体质量、ASA构成比、手术时间比较,差异无统计学意义(P>0.05),见表1。
2.2食管癌患者外周血DCs数量变化与健康志愿者相比,食管癌患者外周血mDCs亚群在PBMCs中所占比例显著降低(P<0.01),进一步研究表明,食管癌患者外周血pDCs亚群在PBMCs中所占比例也显著降低(P<0.01)。图1b中可见食管癌患者外周血的天然未成熟DCs数量呈现显著下降趋势,提示患者体内介导抗肿瘤免疫的抗原呈递环节出现障碍。

表1 入组患者的一般情况

2.3氟比洛芬酯对外周血DCs的影响在对照组中,与术前相比,患者术毕24 h的外周血中mDCs在PBMCs中所占比例显著降低(P<0.01),同时患者术毕24 h的外周血中pDCs在PBMCs中所占比例也显著降低(P<0.01);进一步研究表明,患者术毕48 h的外周血中mDCs所占比例与术前相比无显著差异(P>0.05),同时患者术毕48 h的外周血中pDCs所占比例与术前相比也无显著差异(P>0.05)。图2a和图2b中可见对照组中患者术毕24 h外周血的天然DCs数量显著下降,术毕48 h外周血中的天然DCs数量恢复至与术前水平无差异,这可能与手术本身引起的创伤和应激导致的免疫抑制有关,但是这种抑制效应维持的时间有限。
在干预组中,与术前相比,患者术毕24 h的外周血中mDCs在PBMCs中所占比例显著升高(P<0.01),同时患者术毕24 h的外周血中pDCs在PBMCs中所占比例显著降低(P<0.01);进一步研究表明,患者术毕48 h的外周血中mDCs所占比例与术前相比无显著差异(P>0.05),同时患者术毕48 h的外周血中pDCs所占比例与术前相比也无显著差异(P>0.05)。图2a和图2b中可见干预组中患者术毕24 h外周血中的天然mDCs亚群数量显著升高,pDCs亚群数量显著下降,术毕48 h外周血中的天然DCs数量恢复至与术前水平无差异,提示氟比洛芬酯可以一定时间内调节外周血中的天然DCs数量。
与对照组相比,干预组患者术前外周血中mDCs和pDCs亚群数量无显著差异(P>0.05);与对照组相比,干预组患者术毕24 h外周血中mDCs亚群所占比例显著升高(P<0.01),同时术毕24 h干预组患者外周血中pDCs亚群所占比例也显著升高(P<0.01);术毕48 h的对照组和干预组患者外周血中mDCs和pDCs亚群所占比例无显著差异(P>0.05)。图2a和图2b中可见术毕24 h干预组中患者外周血中的天然mDCs和pDCs亚群数量相较于对照组患者显著升高,术毕48 h干预组中患者外周血中的天然DCs数量恢复至与对照组水平无差异,提示氟比洛芬酯可以一定时间内上调外周血中的天然DCs数量。
2.4PCIA评价如图3a所示,术毕12、24、36、48 h的对照组和干预组患者VAS评分无显著差异(P>0.05)。与对照组相比,干预组患者术毕48 h消耗的舒芬太尼显著减少(P<0.05)(见图3b)。
3讨论
我国是食管癌高发国家,每年死于食管癌的患者约占我国恶性肿瘤死亡人数的五分之一。食管癌发病隐匿,诊断时病程已至晚期,手术五年生存期短,预后差。食管癌根据组织形态学主要分为食管鳞癌(ESCC)和食管腺癌(EAC),我国食管癌患者以ESCC居多,约占90%。长期的慢性炎症刺激引起食管上皮细胞增生、恶变是食管癌重要的致病机制。在食管癌的炎—癌转化病理机制中,异常高表达的环氧化酶(COX)及其催化产生的主要炎症介质前列腺素E2(PGE2)发挥至关重要的作用。PGE2可以通过增强癌细胞的侵袭和转移,促进癌细胞增殖,抑制癌细胞凋亡,促进肿瘤血管生成等多方面的作用参与肿瘤的发生发展。PGE2主要以自分泌或旁分泌的形式通过与G蛋白偶联的PGE2受体(EP)相互作用发挥生物学功能。因此,对食管癌的术前化疗和术后复发、转移的预防,通过使用以氟比洛芬酯为代表的NSAIDs抑制COX及其下游产物PGE2发挥病理作用被认为是一种非常有希望的治疗策略。

图2氟比洛芬酯对外周血DCs的影响
注:(a)与术前相比,对照组中患者术毕24 h的外周血中mDCs亚群在PBMCs中所占比例显著降低(P<0.01);与术前相比,干预组中患者术毕24 h的外周血中mDCs亚群所占比例显著升高(P<0.01);与对照组相比,干预组患者使用氟比洛芬酯后,术毕24 h外周血中mDCs亚群所占比例显著升高(P<0.01);(b)与术前相比,对照组中患者术毕24 h的外周血中pDCs亚群在PBMCs中所占比例显著降低(P<0.01);与术前相比,干预组中患者术毕24 h的外周血中pDCs亚群所占比例显著降低(P<0.01);与对照组相比,干预组患者使用氟比洛芬酯后,术毕24 h外周血中pDCs亚群所占比例显著升高(P<0.01)。与对照组比较,**P<0.01;与术前比较,##P<0.01。
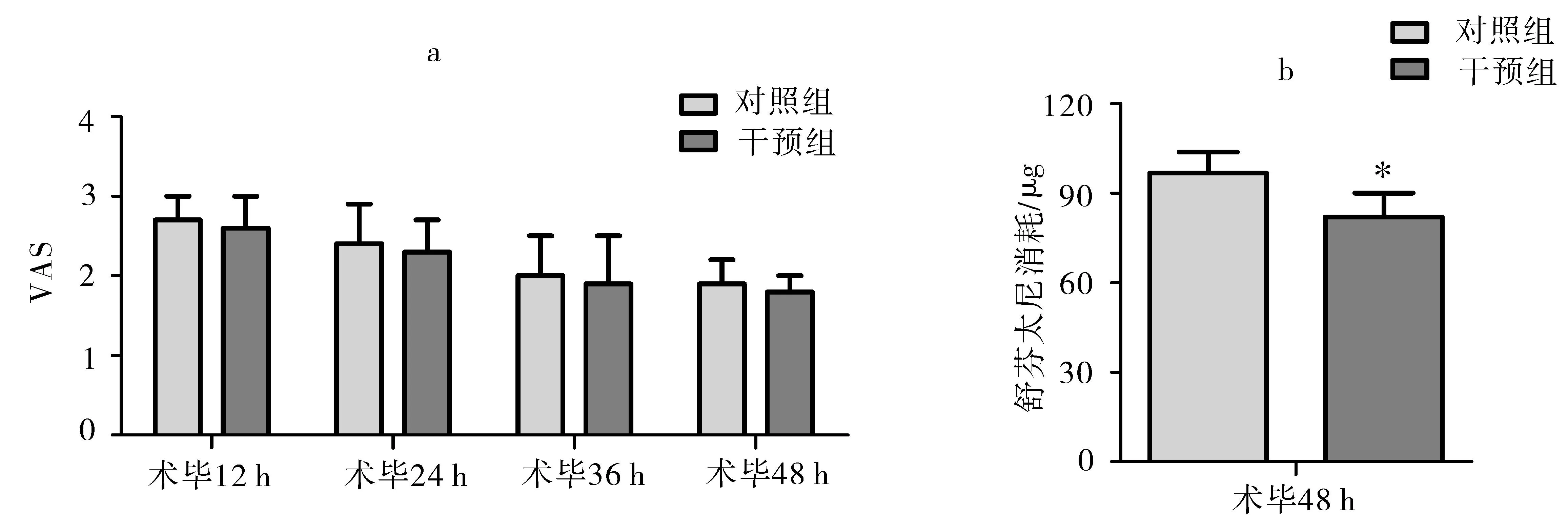
图3PCIA评价
注:(a)术毕12、24、36、48 h的对照组和干预组患者之间VAS评分无显著差异(P>0.05);(b)与对照组相比,干预组患者术毕48 h消耗的舒芬太尼显著减少(P<0.05)。与对照组比较,*P<0.05。
外周血中的天然未成熟DCs以 mDCs和pDCs两个主要亚群存在,传统的观点认为前者与单核细胞、粒细胞有共同的祖细胞,能够引发Th1 和CTLs反应,主要参与抗肿瘤免疫;pDC与T细胞、B细胞有共同的前体细胞,激发Th2 型反应,主要参与免疫耐受。近年的研究发现,富集后的外周血mDCs被Toll样受体(toll-like receptors, TLRs)-3或-9激活,通过分泌干扰素-γ(IFN-γ)和白介素-12(IL-12)等细胞因子诱导Th1 和CTLs介导的抗肿瘤免疫反应,显著延长病人生存期,改善预后[9]。pDCs不仅参与免疫耐受,最近的研究发现,pDCs虽然吞噬、迁移功能弱于mDCs,但pDCs高表达MHC-Ⅰ类和MHC-Ⅱ类分子,MHC分子与其捕获加工的肿瘤抗原结合,形成肽-MHC分子复合物,更加有效的进行抗原呈递,启动MHC-I类限制性CTLs反应和MHC-Ⅱ类限制性的Th1反应[14]。临床研究表明,富集后的外周血pDCs负载TAA后回输给黑色素瘤患者,患者体内IFN-γ和IL-12水平增高,启动Th1 和CTLs抗肿瘤免疫反应[8]。以MoDCs为代表的传统细胞免疫治疗特异性差、疗效低,因此,与MoDCs相比,外周血中的未成熟天然DCs功能强大、体外培养周期短、毒副作用少,是DCs免疫治疗的理想选择。
我们的研究发现,与健康志愿者相比,食管癌患者外周血中mDCs和pDCs亚群数量显著减少,这与肿瘤患者体内的免疫功能低下可能具有密切联系。开胸食管中段癌根治切除手术时间长,创面大,手术应激反应极大地抑制食管癌患者的术后免疫功能,进而引起肿瘤扩散、转移及术后感染等相关的术后并发症[15-16]。我们的研究发现,对照组中术毕24 h的外周血mDCs和pDCs亚群数量显著减少,这可能与肿瘤术后患者体内的免疫功能被抑制有关。围术期麻醉和镇痛可以有效缓解手术创伤应激和术后免疫抑制、感染,然而作为镇痛药物的代表,阿片类镇痛药本身对患者机体细胞免疫和体液免疫有广泛的抑制作用。氟比洛芬酯是以脂微球为载体的NSAIDs,药物进入体内靶向分布到创伤及肿瘤部位后,氟比洛芬酯从脂微球中释放出来,在血中脂酶的作用下迅速水解生成活性代谢物氟比洛芬,通过抑制局部异常高表达的COX,阻断既是致痛物质又是炎性介质的PGE2合成,阻断受伤部位的痛觉向脊髓的传导。氟比洛芬酯与阿片类镇痛药联合使用不仅镇痛效果确切、安全,而且节俭阿片类药物用量[10]。
肿瘤组织中异常高表达COX及其下游产物PGE2不仅直接参与肿瘤的发生发展,还可以促进肿瘤细胞的免疫逃逸、抑制抗肿瘤免疫反应。氟比洛芬可以阻断PGE2对T细胞和巨噬细胞的抑制作用,减少炎症介质缓激肽的升高,调节细胞因子的释放,减轻手术创伤部位的炎症反应,参与保护免疫功能。最近研究发现,围术期使用氟比洛芬酯可以缓解手术创伤应激对自然杀伤细胞和CTLs、Th1介导抗肿瘤免疫反应的抑制[11-12]。但是,氟比洛芬酯对外周血中未成熟的天然mDCs和pDCs亚群的影响尚未有研究报道。我们的研究发现,氟比洛芬酯上调了患者术后24 h时被抑制的外周血mDCs和pDCs亚群数量,但是术毕48 h干预组的mDCs和pDCs亚群数量又恢复至与对照组水平无差异,这可能是和药物代谢的半衰期(T1/2=5.8 h)有关。
综上,我们的研究提示氟比洛芬酯围术期镇痛时可以在一定时间内上调食管癌患者外周血中天然mDCs和pDCs亚群水平,但是氟比洛芬酯上调外周血DCs数量的作用对食管癌根治术患者术后长期预后的影响有待进一步的研究。
参考文献:
[1]Pfeiffer IA,Hoyer S,Gerer KF,et al.Triggering of NF-κB in cytokine-matured human DCs generates superior DCs for T-cell priming in cancer immunotherapy[J]. Eur J Immunol,2014,44(11):3413-3428.
[2]Teramoto K,Ohshio Y,Fujita T,et al.Simultaneous activation of T helper function can augment the potency of dendritic cell-based cancer immunotherapy[J].J Cancer Res Clin Oncol,2013,139(5):861-870.
[3]Ni YH,Huang XF,Ding L,et al.Accumulation of CD208 mature dendritic cells does not correlate with survival time in oral squamous cell carcinoma patients[J].J Oral Maxillofac Surg,2014,72(11):2178-2185.
[4]Liu J,Lu G,Li Z,et al.Distinct compartmental distribution of mature and immature dendritic cells in esophageal squamous cell carcinoma[J].Pathol Res Pract,2010,206(9):602-606.
[5]Yang W,Yu J.Immunologic function of dendritic cells in esophageal cancer[J]. Dig Dis Sci,2008,53(7):1739-1746.
[6]Liu X,Song N,Liu Y,et al.Efficient induction of anti-tumor immune response in esophageal squamous cell carcinoma via dendritic cells expressing MAGE-A3 and CALR antigens[J].Cell Immunol,2015,295(2):77-82.
[7]Lin L,Wei J,Chen Y,et al.Induction of antigen-specific immune responses by dendritic cells transduced with a recombinant lentiviral vector encoding MAGE-A3 gene[J].J Cancer Res Clin Oncol,2014,140(2):281-289.
[8]Tel J,Aarntzen EH,Baba T,et al.Natural human plasmacytoid dendritic cells induce antigen-specific T-cell responses in melanoma patients[J].Cancer Res,2013,73(3):1063-1075.
[9]Bol KF,Tel J,De Vries IJ,et al.Naturally circulating dendritic cells to vaccinate cancer patients[J].Oncoimmunology,2013,2(3):e23431.
[10] Lin X,Zhang R,Xing J,et al.Flurbiprofen axetil reduces postoperative sufentanil consumption and enhances postoperative analgesic effects in patients with colorectal cancer surgery[J].Int J Clin Exp Med,2014,7(12):4887-4896.
[11] Shen JC,Sun HL,Zhang MQ,et al.Flurbiprofen improves dysfunction of T-lymphocyte subsets and natural killer cells in cancer patients receiving post-operative morphine analgesia[J].Int J Clin Pharmacol Ther,2014,52(8):669-675.
[12] Chai XQ,Ma J,Xie YH,et al.Flurbiprofen axetil increases arterial oxygen partial pressure by decreasing intrapulmonary shunt in patientsundergoing one-lung ventilation[J].J Anesth,2015[Epub ahead of print].
[13] Wimmers F,Schreibelt G,Sköld AE,et al.Paradigm shift in dendritic cell -based immunotherapy:From in vitro generated monocyte-derived DCs to naturally circulating DC subsets[J].Front Immunol,2014,5:165.
[14] Tel J,Schreibelt G,Sittig SP,et al.Human plasmacytoid dendritic cells efficiently cross-present exogenous Ags to CD8+T cells despite lower Ag uptake than myeloid dendritic cell subsets[J].Blood,2013,121(3):459-467.
[15] Reinhardt R,Pohlmann S,Kleinertz H,et al.Invasive surgery impairs the regulatory function of human CD56 bright natural killer cells in response to staphylococcus aureus.Suppression of interferon-γ synthesis[J].PLoS One,2015,10(6):e0130155.
[16] Kimura F,Shimizu H,Yoshidome H,et al.Immunosuppression following surgical and traumatic injury[J].Surg Today,2010,40(9):793-808.
基金项目:国家自然科学基金青年项目资助(No 81503080;No 31200675)
通信作者:柴小青,男,教授,硕士生导师,研究方向:临床麻醉学和麻醉药理学,E-mail:xiaoqingchai@163.com
doi:10.3969/j.issn.1009-6469.2015.12.043
(收稿日期:2015-10-20,修回日期:2015-11-08)
Peri-operative treatment with flurbiprofen axetil modulates the
naturally circulating dendritic cells subsets from patients with
esophageal carcinoma undergoing thoracic surgery
WANG Di,CHAI Xiao-qing,SHU Shu-hua,et al
(DepartmentofAnesthesiology,AffiliatedProvincialHospitalof
AnhuiMedicalUniversity,Hefei,Anhui230001,China)
Abstract:ObjectiveTo investigate whether flurbiprofen axetil (FA) modulates the naturally circulating dendritic cells (DCs) subsets in patients with esophageal carcinoma undergoing thoracic surgery. Methods 20 healthy subjects were enraued 40 patients undergoing esophageal radical resection for carcinoma were randomly assigned into two groups, group C (control group, n=20) and group F (intervention group, n=20). FA (2 mg·kg-1) was administered i.v. 30 min before skin incision and at the end of surgery in group F while placebo was adopted in group C. Both groups received postoperative (post-OP) patient-controlled intravenous analgesia (PCIA) using sufentanil. The percentages of plasmacytoid (p)DCs and myeloid(m)DCs subtypes among peripheral blood mononuclear cells (PBMCs) were measured by flow cytometry (FCM). Furthermore, visual analogue scale (VAS) scores, sufentanil consumption during post-OP 48 h were recorded. Results FCM results showed that percentages of pDCs and mDCs in patients preoperatively (pre-OP) were significantly lower compared to those in healthy donors. In comparison with group C, treatment with FA significantly up-regulated the depressed percentages of pDCs and mDCs in patients after surgery (post-OP 24 h). It also provided a similar analgesic effect on patients according to VAS score, and brought a significantly less sufentanil consumption during post-OP 48 h. Conclusion Peri-operative treatment with FA alleviated the surgery-induced suppressed circulating pDCs, and mDCs percentages in patients with esophageal carcinoma undergoing esophageal radical resection.
Key words:flurbiprofen axetil;esophageal carcinoma;dendritic cells
欢迎订阅《安徽医药》
《安徽医药》是由安徽省食品药品监督管理局主管,安徽省药学会主办的综合性学术期刊。本刊是中国科技论文统计源期刊(中国科技核心期刊)、中国核心期刊(遴选)数据库期刊、中国学术期刊综合评价数据库统计源期刊,并被中国期刊网、中国学术期刊光盘版、万方数据库、中文科技期刊数据库、中文生物医学期刊文献数据库、美国化学文摘收录。主要栏目有综述、药学研究、药物分析、临床医学、药物与临床、医院药学、药品监督、药品不良反应等。内容丰富,编辑规范,排印精致。读者对象为全国各地医院、药监系统、药品生产经营单位、医药类大专院校、科研机构和有关单位。
本刊为月刊,大16开,204页,国内统一刊号CN 34-1229/R,国际标准刊号ISSN 1009-6469。国内外公开发行,邮发代号26-175,每期定价12元,全年144元。欢迎在全国各地邮局订阅,也可直接到本编辑部订阅。
地址:安徽省合肥市包河大道与乌鲁木齐路交口,安徽省食品药品检验研究院内技术检测楼6楼安徽医药编辑部。邮编:230051,电话:0551-64672615,网址:www.ahyyzz.cn,E-mail:ahyyzz@126.com。
◇药物与临床◇
