光动力学处理对宫颈癌细胞的miRNA的影响
2015-02-01兰艳丽
兰艳丽,刘 韵
(湖北文理学院附属襄阳市中心医院妇产科,湖北 襄阳 441021)
光动力学处理对宫颈癌细胞的miRNA的影响
兰艳丽,刘韵
(湖北文理学院附属襄阳市中心医院妇产科,湖北 襄阳441021)
摘要:目的研究光动力学(PDT)处理对宫颈癌细胞的miRNA的影响。方法 将HeLa细胞接种到黑色透明底的96孔微Optilux板(1×10 4细胞/孔)。24 h后,当细胞附着在培养板上,除去培养基,并将培养物在磷酸盐缓冲盐溶液(PBS,pH 7.4)中洗涤3次,进行不同浓度的光敏剂PDT处理。评价PDT对HeLa细胞活力影响,并进行细胞计数,以评估其对PDT灵敏度。激光照射1 h后,所有HeLa细胞的总细胞RNA经Quick Gene RNA细胞培养试剂盒提取后,进行DNA酶处理,使用大容量cDNA逆转录试剂盒进行逆转录(RT)。实时PCR定量测定凋亡相关的miRNA(MIR-7,miR-148a,miR-204,miR-210,miR-216和miR-296的表达水平。结果 PDT处理1 h后,与未做任何干预处理的对照组比较,HeLa细胞存活率显著降低至78%。PDT处理24 h后,HeLa细胞全部死亡。此外,PDT处理1 h后,HeLa细胞内聚半胱天冬酶活性,显著增高。另外,PDT处理1 h后,miR-210和miR-296的表达水平显著高于对照组。然而,其他miRNA的表达水平包括miR-7,miR-148a,miR-204和miR-216与对照组无差异。结论 PDT处理宫颈癌细胞后,miRNA表达水平不同,miR-210和miR-296的表达水平最高,可以作为宫颈癌PDT疗效的标记物。
关键词:光动力疗法;小分子RNA;细胞凋亡;HeLa细胞;5氨基乙酰丙酸
宫颈癌是世界上第二大常见妇女肿瘤,在发展中国家尤为常见,我国宫颈癌的发生率高居女性恶性肿瘤的第一位,是引起妇女癌症相关死亡的重要原因。近年来我国宫颈癌发病率总体偏高,宫颈癌低龄化的趋势十分显著,严重威胁着广大妇女的身心健康。其中肿瘤转移是导致患者死亡的主要原因。宫颈癌早期可以发生转移,转移患者愈后不佳。目前宫颈癌常用的治疗手段主要是手术、放疗和化疗等,这些方法创伤大,毒副反应重,而且可能剥夺年轻患者的生育功能。因此积极开展宫颈癌浸润转移机制的研究对于宫颈癌的防治具有重要的现实意义。近年来发展起来光动力疗法是的一种新的肿瘤治疗方法,该方法是通过光敏化反应直接作用达到杀伤肿瘤细胞的目的,是一种光化学技术,用于新血管形成相关的多种癌症和疾病的治疗。该方法的其最大优点在于对体内的肿瘤细胞高度的筛选选择性并具有组织特异性,在杀伤肿瘤细胞情况的同时对健康组织的伤害及损伤达到最小。研究较热门的小RNA(miRNA)是一类小分子非编码进行调控的单链RNA。目前几年来,关于miRNA与子宫颈癌症之前关系的研究已经成为了肿瘤研究热点。光动力疗法(PDT)miRNA是由基因编码、转录成单个或群集的初级转录子,随后产生成熟miRNA。人类癌症细胞的变化与miRNA表达相关。据最新报道,miRNA的表达模式因肿瘤类型的不同而不同,并且miRNA表达谱反映了肿瘤的发育谱系和分化状态[1]。大量的研究表明,该小分子物质miRNA在细胞增殖、凋亡表现出及肿瘤形成等方面具有广泛而精确地调控蛋白质分解以及合成的重要作用。miRNA的异常表达可表现出被认为与宫颈癌症的发生与发展具有密切的相关性。光动力学是宫颈癌症的有效方法已经被证实,因此,更好地理解PDT治疗肿瘤细胞的机制,将有助于设计新的干预措施和改善患者的长期生存情况。在这项研究中,重点研究PDT处理HeLa细胞后癌细胞内miRNA的变化。本课题通过筛选以及筛查对宫颈癌症光动力学治疗前及治疗之后差异性表达的miRNA,旨在为差异miRNA对疾病的预测以及预后判断,且为功能分析提供前提以及基础。
1资料和方法
1.1资料光敏剂5-ALA(5氨基乙酰丙酸)购自美国Sigma公司。宫颈癌细胞系Hela由中国医学科学院,中国协和医科大学北京协和医院妇科肿瘤实验室提供。连续波半导体激光发生器用于激发光敏剂(664±1)nm波长(JENOPTIK公司,德国)。
1.2细胞培养物,光敏剂,PDTHeLa细胞接种到黑色透明底96孔的微Optilux板(BD生物科学公司,加利福尼亚州)(1×104细胞/孔)。24 h后,当细胞附着在培养板上,除去培养基,并将培养物在磷酸盐缓冲盐溶液(PBS,pH 7.4)中洗涤3次,进行PDT处理。简言之,光敏剂ALA:分子量167.6,使用前药物用PBS配成25 mmol·L-1,5 mol·L-1NaOH 调pH值至7.0,滤过除菌,避光保存。细胞经由连接于培养板底部的光纤进行激光照射。激光照射后,将培养基替换为完全生长基。试剂:Platinum SYBR Green qPCR SuperMix-UDG(美国Invitroge公司),蛋白酶 K( 默克生物公司),TaqMix(东盛生物公司),PCR试剂盒、TaqMan miRNA试剂盒(美国Santa Cruz公司),RNA提取试剂盒采用(美国Sigma),DEPC(上海碧云天生物),乙醇、异丙醇、氯仿(上海硕盟生物)。
仪器:高速冷冻离心机(德国BiofugeStratos),-8~4℃冰箱(日本松下), PCR仪(澳大利亚Rotor-gene),紫外分光光度仪(Beckman Coulter 公司)。
1.3HeLa细胞的PDT疗效评价评价PDT对HeLa细胞活力的影响,并进行细胞计数,以评估其对PDT的灵敏度。细胞计数板、盖玻片用70%酒精擦净,将盖玻片盖于血球计数板的计数室上,常规消化细胞,吹打成均匀的细胞悬液,用吸管吸一滴细胞悬液,由盖玻片边缘加入,计数室的四角的四个大 方格的细胞数(又各划分为16个中方格)。压线的只计上线和左侧,按下式计数:细胞数/mL= PDT诱导的细胞凋亡评价, 采用FLICA聚半胱天冬检测方法测量蛋白酶活性水平。
1.4RNA提取和实时PCR 激光照射1 h后,所有HeLa细胞的总细胞RNA经Quick Gene RNA细胞培养试剂盒提取。所有样品进行DNA酶处理,以避免DNA污染,接着使用大容量cDNA逆转录试剂盒进行逆转录(RT)。采用RNA提取试剂盒进行RNA提取,采用TaqMan miRNA试剂盒检测MicroRNA的相对表达量。采用RNU6作为内参进行校正。对MicroRNA的表达水平采用二步法进行检测,第一步是通过茎环引物来合成互补DNA,再通过miRNA的逆转录系统对10 ng RNA进行逆转了反应体系进行反应,在PCR管加入10 μL的逆转录缓冲液,总的RNA浓度调整到2 μg·L-1,最后加入5 μL的逆转录引物,在冰上混匀之后反应5 min,接着进行梯度变性反应,94℃、30 s,60℃、30 s,72℃、60 s,72℃、7 min递减,第二步采用Platinum SYBR Green qPCR的反应体系,反应体系为2×的 PCR Taqman Universal的混合液以及Taqman miRNA的特异性引物(MicroRNA:上游5'-caca guaggc cuca aauguuuguuga uga-3',下游5'-gugu cguccg gggu uuacagacaacu acu-3'),通过逆转录体系进行反应,cDNA共5 μL加入到RNA的去酶的水当中,将体积扩增至20 μL,通过循环反应94℃、30 s,60℃、30 s,72℃、60 s,72℃、7 min递减的扩张40个循环之后,对实验结果进行分析,采用荧光实时定量反应,按照PCR操作说明,Ct的检测值应当在20~32之外的需要进行第二次检测。应用△Ct=Ct microRNA-CtRNU6的计算公式计算microRNA的相对表达量。测定凋亡相关的miRNA(miR-7,miR-148a,miR-204,miR-210,miR-216和miR-296的表达水平。
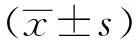
2结果
2.1HeLa细胞的PDT疗效PDT处理1 h后,与未做干预处理的相比对照组,HeLa细胞存活率显著降低至78%。PDT处理24 h后,HeLa细胞全部死亡。此外,PDT处理1 h后,HeLa细胞内聚半胱天冬酶活性,显著增高。细胞存活率与PDT诱导细胞凋亡的结果,见表1。这些结果表明,PDT处理宫颈癌后,癌细胞凋亡将立即启动。

表1 不同处理对HeLa细胞存活率及凋亡的影响
注:光敏剂浓度0mg·L-1为对照组。
2.2PDT处理后癌细胞的miRNA表达情况PDT处理1 h后,miR-210和miR-296的表达水平显著高于对照组,然而,其他miRNA的表达水平包括miR-7,miR-148a,miR-204和miR-216与对照组无差异。见图1和图2。
3讨论
宫颈癌是常见的女性生殖道恶性肿瘤,是引起妇女癌症死亡的主要原因。近年来我国宫颈癌发病率总体偏高,每年新发病例近13万,接近于发达国家的6倍,宫颈癌低龄化的趋势也十分显著,严重威胁着广大妇女的身心健康[2]。宫颈癌早期肿瘤组织发生转移,导致患者术后治愈效果不佳,是导致患者死亡的主要原因。通过对宫颈癌光动力学治疗前后差异表达microRNA的研究,可以更好的发现其发生机制并为相关研究提供新思路,同时也可以为新的治疗方法和提早预防提供新方向[3]。希望本研究中的研究思路和结论对今后更深入机制研究提供新的思路,同时也希望本研究为治疗宫颈癌光动力学治疗提供新的靶点。光动力疗法是近年来发展起来的一种较新肿瘤治疗方法,是通过光敏化反应达到杀伤肿瘤细胞的目的,其最大优点在于对肿瘤细胞高度的选择性和组织特异性,在杀伤肿瘤细胞的同时对健康组织的损伤达到最小[4-5]。目前,PDT已经被批准用于治疗局部疾病和癌前病变,如子宫颈癌,膀胱癌,垂体瘤,胶质母细胞瘤,同时作为姑息治疗早期肺癌和食道癌及基底细胞癌的一种治疗手段[6]。
目前正在进行的临床研究目的是为了优化PDT的条件。研究较热门的小RNA(miRNA)是一类小分子非编码进行调控的单链RNA[7]。是一类能够调节多种靶基因发挥生物学效应的重要分子,也是目前肿瘤分子机制的研究热点内容[8]。miRNA作为新型的非编码的单链RNA,其长度仅为22个核苷酸序列,但是该分子广泛存在于各类生物的真核细胞当中,随着生物信息学的发展,miRNA在肿瘤中的相关研究越来越深入,研究发现miRNA参与者各类肿瘤的生长、发育,与肿瘤细胞的增殖凋亡以及侵袭转移密切相关,涉及到各类肿瘤的发生发展,且miRNAs的表达谱还决定着肿瘤的基因反省,在肿瘤亚型、转移等临床病理因素中发挥着重要作用,尤其对于术后的生存期及预后具有一定的相关性,研究提示了miRNA可以用于对肿瘤预后的评估,其表达量与肿瘤的预后有着一定的相关性[9-10]。关于miRNA与子宫颈癌症之前关系的研究已经成为了肿瘤研究热点[11]。大量的研究表明,该小分子物质miRNA在细胞增殖、凋亡表现出及肿瘤形成等方面具有广泛而精确地调控蛋白质分解以及合成的重要作者用[12]。本研究选用的microRNA表达谱芯片共筛选出170个与宫颈癌放化疗敏感性相关的差异表达的microRNAs,治疗抗拒组与敏感组相比表达显著增高者144个,显著降低者26个。选取两组患者中统计学差异较为显著,同时根据靶基因预测网站的预测分析,如预测发现表皮生长因子受体EGFR上有两个miR-296的结合位点,并结合microRNA及其祀基因在其他肿瘤中的研究,如己有研究显示miR-216作用于DNA-PKcs或ATM发挥作用,而DNA-PKcs和ATM是体内DNA双链断裂修复的两种主要方式[13]。因此选取miR-7,miR-148a,miR-204,miR-210,miR-216和miR-296这6个microRNAs,作为区分敏感组和抗拒组的目标microRNAs。经进一步的hierarchical聚类分析,从聚类图上可以直观的看出在敏感组和抗拒组中这6个microRNA表达差异明显,能够将两组很明显的区分开来。因此将这6个microRNA进一步在小样本中选用TaqMan Real-time PCR方法进行初步的验证。虽然miR-886-3p、miR-125a-5p、miR-365和miR-489这4个microRNA未能在初步的验证中显示出差异,但是由于验证的标本量较少,敏感组和抗拒组均只有10例患者,因此可能存在偏倚和不足,如果能扩大样本量进行进一步的研究,可能会有更有说服力的结果。miR-101曾经在宫颈癌中被报道表达下降,但并没有它与治疗相关方面的研究[14]。了解这些microRNAs在其他肿瘤中的研究,包括表达、作用的靶基因和相关作用机制等,可能对其在宫颈癌治疗敏感性相关中的研究得到一定的启示。
miRNA的异常表达可表现出被认为与宫颈癌症的发生与发展具有密切的相关性[15]。然而,除了细胞活力本身之外,评估细胞死亡和PDT疗效,没有其他标准化的生物标记物。已有研究通过高通量筛选技术的筛查出了与宫颈癌相关的MicroRNA,研究还提示了多指教MicroRNA基因的上调与宫颈癌的发生转移有着密切的关系,但特定区域的单核苷酸多态性(single nucleotide polymorphisms, SNPs)可以使人更易罹患疾病[16],已有研究提示MicroRNA-421的+60位点上存在着基因多态性位点,该位点存在在种子序列当中,可以调控该基因的成熟体,Cheng等[4]发现,抑制miRNA-95,124,125,133,134,144,150,152,187,190,191,192,193,204,211,218,220,296和299会减缓癌细胞的生长,而抑制miR-21和的miR-24显著促进HeLa细胞的生长。此外,他们发现miRNA(miR-7,148,204,210,216和296)促进癌细胞凋亡。这些数据表明,特定miRNA参与了细胞死亡应答过程。本课题通过实时PCR定量测定凋亡相关的miRNA(miR-7,miR-148a,miR-204,miR-210,miR-216和miR-296的表达水平,旨在为差异miRNA对疾病的预测以及预后判断,且为功能分析提供前提以及基础。
miR-210是缺氧条件刺激下,最多的miRNA。由于PDT固有的后果是缺氧和稳定细胞内的HIF。本研究也观察到miR-210的表达与其缺氧环境有关。已有报道HIF信号传导途径参与miR-210的调节。为了研究miR-210功能部分或完全丧失导致的生物学效应,他们还确定了miR-210的靶mRNA。根据该报告,miR-210作为一种重要的调节因子,参与基因转录,细胞代谢,分化和发育[17]。miR-210作为重要的细胞过程调节器,以及参与肿瘤基因高频拷贝过程,可以推测miR-210参与肿瘤的发生、肿瘤细胞缺氧及细胞周期调控之间存在潜在联系。
研究报道miR-296在促进肿瘤血管生成中发挥重要作用。他们发现,血管内皮生长因子单独能够增加miR-296的表达。此外该结果发现了一个有趣的反馈机制, VEGF诱导miR-296的表达,其靶点为肝细胞生长因子调控的酪氨酸激酶底物(HGS),这反过来又导致血管内皮生长因子受体2和血小板衍生生长因子(PDGF)受体β蛋白水平的增加,最终提高血管内皮生长因子的生成[18]。PDT处理后的固有后果之一,就是肿瘤细胞的血管内皮生长因子的敏感性增加[19],因此我们的研究结果表明,抑制miR-296的表达,阻碍反馈机制,减少VEGF,应该能够改善PDT疗效。
综上所论, PDT导致缺氧,后者诱导miR-210的表达,随后增加VEGF表达和miR-296的表达。因此,miR-210和miR-296的表达水平,可作为衡量PDT治疗宫颈癌疗效的生物标记物。
参考文献:
[1]车万民,董涛,赵全华,等.立体定向光动力疗法治疗恶性脑肿瘤[J].中华神经外科杂志,2013,29(7):724-726.
[2]许文伟,付俊武,阚文宏.缺氧诱导因子-1α对肿瘤调控机制的研究进展[J].广东医学,2012,32(22):3015-3017.
[3]罗红敏, 胡森.脓毒症患者缺氧诱导因子-1及其靶基因表达下降[J].中华危重病急救医学,2013,25(4):210-210.
[4]Cheng AM,Byrom MW,Shelton J,et al.Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis[J].Nucleic Acids Research,2005,33(4):1290-1297.
[5]Giannakakis A,Sandaltzopoulos R,Greshock J,et al.miR-210 links hypoxia with cell cycle regulation and is deleted in human epithelial ovarian cancer[J].Cancer Biology & Therapy,2008,7(2):255-264.
[6]Ritchie W,Flamant S,Rasko JE.mimiRNA:a microRNA expression profiler and classification resource designed to identify functional correlations between microRNAs and their targets[J].Bioinformati cs,2010,26(2):223-227.
[7]Würdinger T,Tannous BA,Saydam O,et al.miR-296 regulates growth factor receptor overexpression in angiogenic endothelial cells[J].Cancer Cell,2008,14(5):382-393.
[8]Gomer CJ,Ferrario A,Luna M,et al.Photodynamic therapy:combined modality approaches targeting the tumor microenvironment[J].Lasers in Surgery and Medicine,2006,38(5):516-521.
[9]Gocze K,Gombos K,Juhasz K,et al.Unique microRNA expression profiles in cervical cancer[J].Anticancer Res,2013,33(6):2561-2567.
[10] Ouyang G,Wang Z,Fang X,et al.Molecular signaling of the epithelial to mesenchymal transition in generating and maintaining cancer stem cells[J].Cell Mol Life Sci,2010,67(15):2605-2618.
[11] Zhang Y,Li M,Wang H,et al.Profiling of 95 microRNAs in pancreatic cancer cell lines and surgical specimens by real-time PCR analysis[J].World J Surg,2009,33(4):698-709.
[12] Wu J,Li G,Yao Y,et al.MicroRNA-421 is a new potential diagnosis biomarker with higher sensitivity and specificity than carcinoembryonic antigen and cancer antigen 125 in gastric cancer[J].Biomarkers,2015,20(1):58-63.
[13] Siva AC,Nelson LJ,Fleischer CL,et al.Molecular assays for the detection of microRNAs in prostate cancer[J].Mol Cancer,2009,8:17-25.
[14] Ohashi S,Natsuizaka M,Naganuma S,et al.A NOTCH3-mediated squamous cell differentiation program limits expansion of EMT-competent cells that express the ZEB transcription factors[J].Cancer Res,2011,71(21):6836-6847.
[15] Jiang Z,Guo J,Xiao B,et al.Increased expression of miR-421 in human gastric carcinoma and its clinical association[J].J Gastroenterol,2010,45(1):17-23.
[16] Mitchell PS,Parkin RK,Kroh EM,et al.Circulating microRNAs as stable blood-based markers for cancer detection[J].Proc Natl Acad Sci USA,2008,105(30):10513-10518.
[17] Laurson J,Khan S,Chung R,et al.Epigenetic repression of E-cadherin by human papillomavirus 16 E7 protein[J].Carcinogenesis,2010,31(5):918-926.
[18] Khanamiryan L, Li Z,Paulin D,et al.Self-assembly incompetence of synemin is related to the property of its head and rod domains[J].Biochemistry,2008,47(36):9531-9539.
[19] Ning S,Ted WH,Denise P,et al.Synemin interacts with the LIM domain protein zyxin and is essential for cell adhesion and migration[J].Exp Cell Res,2010,316:491-505.
关于文稿中法定计量单位的书写要求
本刊法定计量单位实行国务院1984年2月颁布的《中华人民共和国法定计量单位》,并以单位符号表示,具体使用参照1991年中华医学会编辑出版部编辑的《法定计量单位在医学上的应用》一书。注意单位名称与单位符号不可混合使用,如ng·kg-1·天-1应改为ng·kg-1·min-1;组合单位符号中表示相除的斜线多于1条时,应采用负数幂的形式表示,如ng/kg/min应采用ng·kg-1·min-1的形式;组合单位中斜线和负数幂亦不可混用,如前例不宜采用ng/kg·min-1的形式。在首次出现不常用的法定计量单位处用括号加注与旧制单位的换算系数,下文再出现时只列法定计量单位。人体及动物体内的压力单位使用mmHg或cmH2O,但文中首次出现时用括号加注(1 mmHg=0.133 kPa)。正文中时间的表达,凡前面带有具体数据者应采用d、h、min、s,而不用天、小时、分钟、秒。量的符号一律用斜体字母,如吸光度(旧称光密度)的符号为A,“A”为斜体字。
doi:10.3969/j.issn.1009-6469.2015.12.020
通信作者:刘韵,女,副主任医师,研究方向:妇产科疾病诊断与治疗,E-mail:59210257@qq.com
(收稿日期:2015-05-04,修回日期:2015-07-09)
Photodynamic Treatment on miRNA in cancer cells
LAN Yan-li,LIU Yun
(XiangyangCentralHospitalAffiliatedtoHubeiCollegeofArtsandSciences,Xiangyang,Hubei441021)
Abstract:Objective To study the photodynamic (PDT) effect on ervical cancer cells, miRNA expression.Methods HeLa cells were seeded into a black with clear bottom 96-well micro Optilux plates (BD Biosciences, CA) (1 × 104 cells / well).24 h later, when cells were attached to the culture plate, the medium was removed, and the cultures were washed 3 times in phosphate buffered saline (PBS, pH 7.4),PDT treatment with different concentrations of photosensitizer.HeLa cell viability evaluation PDT on impact, and cell count to assess their sensitivity for PDT.After laser irradiation 1 h, total cellular RNA of all HeLa cells Use Quick Gene RNA extraction cell culture kit.All DNA samples were enzymatically treated in order to avoid contamination of DNA, followed by the use of high capacity cDNA reverse transcription kit reverse transcription (RT).Apoptosis-related miRNA (miR-7, miR-148a, miR-204, miR-210, miR-216 and miR-296 expression levels were determined by quantitative real-time PCR.Results After PDT treatment 1h, compared with the control group without making any intervention treatment, HeLa cell viability was significantly reduced to 78%.24 hours after PDT treatment,HeLa cells all died. In addition, PDT poly caspase activity in HeLa cells within one hour after treatment, was significantly increased.In addition, the PDT treatment 1 h, miR-210 and miR-296 expression levels were significantly higher. However, the expression levels of other miRNA include miR-7, miR-148a, miR-204 and miR-216 no difference with the control group.
Conclusions Talaporfin sodium PDT photosensitizers treated as cervical cancer cells, distinct miRNA expression levels, the highest miR-210 and miR-296 expression levels can be used as markers of cervical cancer PDT efficacy thereof.
Key words:photodynamic therapy; small molecule RNA; apoptosis; HeLa cells; 5-ALA
