燕麦β-葡聚糖与沙蒿胶多糖对菌群人源化小鼠生理及肠道微生物调节比较研究
2015-01-30胡新中李俊俊郑建梅陈杏云唐凌云
张 静,胡新中*,李俊俊,郑建梅,陈杏云,唐凌云
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.陕西师范大学食品工程与营养科学学院,陕西 西安 710062)
沙蒿(Artemisia sphaerocephala Krasch.,ASP)是一种广泛生长于中国陕西、宁夏、甘肃、新疆和内蒙古等干旱半干旱省区的野生植物[1]。沙蒿作为中草药还具有消炎散肿、宽胸利气及杀虫之疗效,亦可用于医治腮腺炎、扁桃腺炎、疥疮红肿、肠梗阻和腹胀等症[2-3],作为食品添加剂,自古以来就被产区农牧民作为面制食品增筋剂、减肥食品和降血糖食品广泛食用[4-5]。沙蒿胶多糖来自沙蒿籽外皮层,是一种热稳定性好、黏度大、吸水性好,在pH 5~8范围内稳定的植物多糖[6],被广泛用作增稠剂、稳定剂、保水剂和成膜剂[7],分别由主链为木聚糖连接而成的高分子质量组分[8]和主链为(1→4)-β-D-吡喃甘露糖和吡喃葡萄糖组成的低分子质量组分构成[9],研究还发现ASP可显著降低Ⅱ型糖尿病大鼠空腹血糖值,提高Ⅱ型糖尿病大鼠的胰岛素敏感性[5]、血清和肝组织超氧化物歧化酶(superoxide dismutase,SOD)的活性[10],并且摄食剂量达到200 mg/kg时可以显著降低四氧嘧啶诱发的糖尿病小鼠血糖水平[11]。目前对沙蒿胶多糖的研究比较匮乏,且多集中在提取分离和生物活性方面。其对菌群人源化(human flora-associated,HFA)小鼠生理指标以及肠道的作用尚未见报道。
与沙蒿胶多糖相比,国内外对燕麦β-葡聚糖的研究已经相当多。燕麦β-葡聚糖是一种水溶性的非淀粉多糖,存在于胚乳和糊粉层细胞壁中,在籽粒的亚糊粉层中大量富集,燕麦麸中含量为6.6%~11.3%,在种胚中含量极少,在去皮的燕麦粉中含量为3.0%~5.4%,因此常从燕麦麸皮中提取[12-13]。燕麦β-葡聚糖是由β-(1→3)糖苷键和β-(1→4)糖苷键连接β-D-吡喃葡萄糖单位而形成的一种高分子无分支线性黏多糖[14]。大量的动物实验表明,燕麦β-葡聚糖具有预防和治疗糖尿病、缓解糖尿病并发症、调节血糖水平、降低血压[15-17]、降低胆固醇水平[18]、调节机体免疫功能和抗疲劳功能[19]。研究还发现燕麦β-葡聚糖具有益生元的作用,不仅能够改善肠道环境、调节肠道系统中微生物群落组成、改善消化系统,还可以使肠道蠕动增加,缩短粪便通过大肠的时间,减少有毒物质与肠壁的接触时间,从而预防和减少肠癌的发生[20-22]。
本实验中利用HFA小鼠,能比较真实地反映人体肠道环境,不仅有效避免了人体实验的伦理问题,而且已经证实该模型在肠道菌群研究方面是可行的[23-24]。燕麦β-葡聚糖和沙蒿胶多糖是否能改善HFA小鼠的生长以及糖脂指标还不清楚。本实验拟利用添加沙蒿胶多糖和燕麦β-葡聚糖的饲料饲喂HFA小鼠8 周,探究这两种植物多糖对HFA小鼠生理及肠道微生物结构的影响以及差异。
1 材料与方法
1.1 动物、材料与试剂
无菌KM小鼠,由第三军医大学基础部实验动物学教研室提供。
动物饲料均由第三军医大学新桥医院实验动物中心提供;燕麦β-葡聚糖和沙蒿胶多糖为本实验室提取纯化,纯度分别为81.9%和86.5%,分子质量分别为152、325.8 kD。
苯酚-氯仿-异戊醇(25∶24∶1,V/V)、RNase、去离子甲酰胺、尿素、聚合酶链式反应(polymerase chain reaction,PCR)引物 生工生物工程(上海)股份有限公司;N,N,N’,N’-四甲基乙二胺 美国Promega公司;2×Power Taq PCR Master Mix、Goldview 北京Bioteke公司;琼脂糖 天根生化科技有限公司;DNA Markers日本TaKaRa公司;其他试剂均为国产分析纯。
1.2 仪器与设备
无菌隔离器 苏州市冯氏实验动物设备有限公司;OneTouch血糖仪 美国强生公司;HR-15B热量计 长沙长兴高教仪器设备公司;HHS-85型电热恒温水浴锅 上海天平仪器厂;MiniBeadBeater-16磁珠研磨仪 美国BioSpec公司;GelDOC2000凝胶成像系统、PTC-200 PCR仪、1170-4486水平电泳仪、170-9081突变检测系统 美国Bio-Rad公司;D24 UV超纯水仪 美国Millipore公司;NanoDrop®Spectrophotometer核酸定量仪 美国NanoDrop公司。
1.3 方法
1.3.1 动物分组与处理
收集1 位健康志愿者(女,25 岁,3个月内未服用过抗生素,同期内未患腹泻及其他肠道疾病,自我感觉健康,为非素食主义者,典型中国饮食)清晨第一次排出的新鲜粪便,在厌氧无菌条件下称质量,以1∶9(m/V)加入Wilkins-Chalgren厌氧肉汤(Oxoid)稀释,振荡混匀后获得粪便悬液。给30 只无菌KM小鼠(3 周龄,雌雄各半)灌胃接种粪便悬液0.4 mL,3 周后能获得菌群结构稳定的HFA小鼠模型[25]。HFA小鼠饲育于温度20~23℃、相对湿度40%~70%的无菌隔离器中,接受12 h光照/12 h黑暗处理。饲料和垫料均经过60Co-γ 50 kGy射线辐照灭菌(第三军医大学辐照中心),饮水、鼠笼和饮水瓶等经过高温高压灭菌后传进无菌隔离器。
将30 只HFA小鼠(6 周龄)按体质量随机分为3 组,每组10 只,雌雄各半:普通组(CT组)、燕麦β-葡聚糖组(CT+OG组)、沙蒿胶多糖组(CT+ASP组),分别饲喂基础饲料(热量值15.97 kJ/g)、基础饲料+5%燕麦β-葡聚糖(在基础饲料中添加质量分数5%燕麦β-葡聚糖,热量值15.68 kJ/g),基础饲料+5%沙蒿胶多糖(在基础饲料中添加质量分数5%沙蒿胶多糖,热量值16.51 kJ/g),自由摄食饮水,饲喂8 周。在饲喂结束前2 d,将HFA小鼠过夜禁食12 h进行口服葡萄糖耐量实验(oral glucose tolerance test,OGTT)。以逼迫法采集小鼠新鲜粪便样品,于-80℃条件下保存备用。饲喂结束后,将HFA小鼠眼眶取血后处死,快速解剖取出肝脏组织、脂肪组织称质量并用10%福尔马林溶液固定后送至第三军医大学西南医院病理科进行苏木精-伊红(hematoxylin-eosin,HE)染色,血清生化指标均由第三军医大学西南医院检验科检测。
1.3.2 粪便细菌总DNA提取
取50 mg粪便样品置于2 mL螺口管中,加入700 μL的裂解缓冲液(500 mmol/L NaCl、50 mmol/L Tris-HCl(pH 8.0)、50 mmol/L乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、4%十二烷基硫酸钠(sodium dodecyl sulfate,SDS)),250 μL苯酚-氯仿-异戊醇和0.2 g锆珠(0.5 mm)混匀,并将研磨管放入Mini-BeadBeater-16研磨仪中以最大转速研磨2 min,12 000 r/min、4℃离心5 min后,向上清液中加入250 μL 10 mol/L乙酸铵,离心后取上清液用苯酚-氯仿-异戊醇抽提2次和氯仿提取2次后,加入异丙醇于-20℃条件下放置30 min后离心弃去上清液,70%乙醇洗涤沉淀2次,自然风干后,加入50 μL无菌ddH2O溶解DNA沉淀,加入2 μL RNase(10 mg/mL)37℃孵育15 min。取2 μL DNA溶液于核酸定量仪中测定DNA纯度及含量。
1.3.3 PCR扩增反应
本实验中PCR扩增体系均为25 µL:1 μL 100 ng/μL DNA模板、12.5 μL 2×Power Taq PCR Master Mix,上下游引物(10 μmol/L)各0.5 μL,加无菌ddH2O至25 μL。本实验所用16S rDNA基因PCR扩增引物序列为上游引物:5’-GC clamp-AACGCGAAGAACCTTAC-3’,下游引物:5’-CGGTGTGTACAAGACCC-3’,其中GC clamp序列为CGCCCGGGGCGCGCCCCGGGCGGGGCGGGG GCACGGGGGG,目的基因大小为489 bp[26]。V6~V8可变区16S rDNA基因PCR扩增采用Touch-down PCR程序为:94℃预变性5 min;94℃变性30 s,62℃退火30 s,72℃延伸1 min,之后每一个循环退火温度下降0.5℃,共循环20次;94℃变性30 s,53℃退火30 s,72℃延伸8 min,10个循环;72℃ 终端延伸8 min,4℃结束。
1.3.4 变性梯度凝胶电泳(denaturing gradient gel electrophoresis,DGGE)、染色以及凝胶回收、测序
参照Muyzer等[27]的方法,对16S rDNA基因的扩增产物进行DGGE分析。DGGE使用质量分数6%或8%聚丙烯酰胺凝胶,将100%变性梯度定义为包含体积分数40%甲酰胺和7 mol/L尿素的体系,电泳采用DCodeTMUniversal Mutation Detection System,电泳缓冲液为1×Tris-acetate-EDTA(TAE,pH 8.0)。首先在220 V电压下预电泳5 min,随后在85 V的固定电压下电泳16 h。电泳结束后,进行银染、拍照。将DGGE凝胶上的特定条带切割下来并将其捣碎,加入 40 µL 1×PCR Buffer,4℃过夜[25]。然后取上清液作为PCR模板重新进行扩增,取5 µL PCR产物进行1%琼脂糖凝胶电泳,阳性结果取10 µL用于DGGE检测,将在DGGE图谱上为单一条带的PCR产物进行测序处理。测序由生工生物工程(上海)股份有限公司测序部完成,序列的同源性在GenBank公共数据库进行BLAST分析。
1.3.5 采用Quantity One软件对DGGE图谱进行数字化处理和多样性分析
丰富度指数S为每个泳带的条带总数。
多样性Shannon-Wiener指数H按照公式(1)计算。

式中:Pi为第i条条带占该泳道所有条带吸光度的比例。
均匀度指数E按照公式(2)计算。

1.4 统计学分析
2 结果与分析
2.1 多糖对HFA小鼠血清生化指标的影响

表1 普通组和多糖组HFA小鼠血清生化指标Table1 The contents of GLU, TG, Tch, HDL-C and LDL-C in serum of mice in CT, CT + OG and CT + ASP groups
普通组和多糖组HFA小鼠血清空腹血糖(glucose,GLU)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,Tch)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)及低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)的含量如表1所示,CT+OG组和CT+ASP组HFA小鼠血清GLU水平均低于CT组,但差异不显著(P>0.05);CT+OG组Tch含量与CT组无差异,但CT+ASP组却显著高于CT组和CT+OG组(P<0.05);各组TG含量高低顺序依次为CT+ASP组>CT组>CT+OG组,其中CT+OG组显著低于其他两组;CT+ASP组HDL-C含量显著高于其他组(P<0.05),CT+OG组与CT组间无差异;CT+OG组LDL-C含量高于CT组和CT+ASP组,但无显著差异(P>0.05)。
2.2 组织切片染色结果
2.2.1 肝脏HE染色结果
如图1所示,CT组和CT+OG组HFA小鼠肝组织结构完整,肝细胞呈多边形、排列整齐,肝小叶轮廓清晰,肝细胞条索围绕中央静脉呈放射状排列,细胞质丰富,核膜清晰;CT+ASP组与CT组和CT+OG组相比,细胞核体积增大,细胞排列更加紧密。
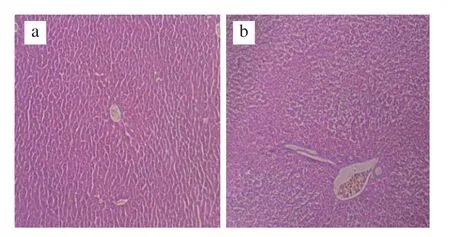

图1 HFA小鼠肝脏组织HE染色结果(HE,×100)Fig.1 Histological observation of liver tissue (HE, ×100)
2.2.2 脂肪HE染色结果

图2 HFA小鼠脂肪组织HE染色结果(HE,×200)Fig.2 Histological observation of adipose tissue (HE, ×200)
如图2所示,CT+ASP组HFA小鼠脂肪细胞较CT组和CT+OG组明显变得肥大,而CT+OG组脂肪细胞较CT组明显变小,表明沙蒿胶多糖会明显促进脂肪细胞的肥大,而燕麦β-葡聚糖可在一定程度上抑制脂肪细胞的肥大。
2.2.3 多糖对HFA小鼠肠道菌群的影响

图3 HFA小鼠16S rDNA V6~V8区DGGE指纹图谱Fig.3 DGGE fingerprint atlas of 16S rDNA V6–V8 regions of HFA mouse model
从每组小鼠中选取合格的6 只,进行16S rDNA V6~V8区DGGE指纹图谱分析。如图3所示,A1、A6、A8、A9、A10、A12、A13号条带在CT+ASP组中信号变强,测序结果表明A6、A8、A9、A10、A12、A13号条带可能分别为Clostridium citroniae、Clostridium saccharolyticum、Ruminococcus lactaris、Acinetobacter gyllenbergii、Acinetobacter calcoaceticus、Clostridium jejuense,相似性分别为92%、96%、94%、91%、96%、91%(表2),提示说明沙蒿胶多糖刺激这几种菌群的繁殖;A2、A4、A5、A7、A8、A9、A11、A13、A14号条带在CT+OG组中信号变强,测序结果表明A4、A5、A7、A8、A9、A11、A13、A14号条带可能分别为Acinetobacter gyllenbergii、Turicibacter sanguinis、Acinetobacter calcoaceticus、Clostridium saccharolyticum、Ruminococcus lactaris、Clostridium citroniae、Clostridium jejuense、Acinetobacter gyllenbergii,相似性分别为98%、90%、86%、96%、94%、94%、91%、98%(表2),说明饮食添加燕麦β-葡聚糖会刺激这几种菌群的增殖;A3号条带在CT+ASP组变弱,在CT+OG组中强度变得更弱,说明添加多糖饮食会导致该菌群数量减少,且燕麦β-葡聚糖的作用更明显,测序结果表明A3号条带可能为Acinetobacter calcoaceticus,相似性为98%。

表2 DGGE图谱中优势条带的种属鉴定结果Table2 Closest species associated with bands in DGGE profile
从UPGMA相似性聚类分析图上可以看出DGGE结果主要聚为三大簇(图4A)。各组能单独聚在一起,表明各组之间菌群结构有差异。由主成分分析图(图4B)也能看出各组组内基本能聚成一类,其中燕麦β-葡聚糖组和沙蒿胶多糖组相距较近,表明该两组菌群结构更为相近。
由图4B可知,CT组、CT+OG组和CT+ASP组数据基本聚集为三部分,表明组内相似性较高。而CT+OG组与CT+ASP组又能聚集到一起,说明组间相似性较高。这与UPGMA相似性聚类分析结果一致。
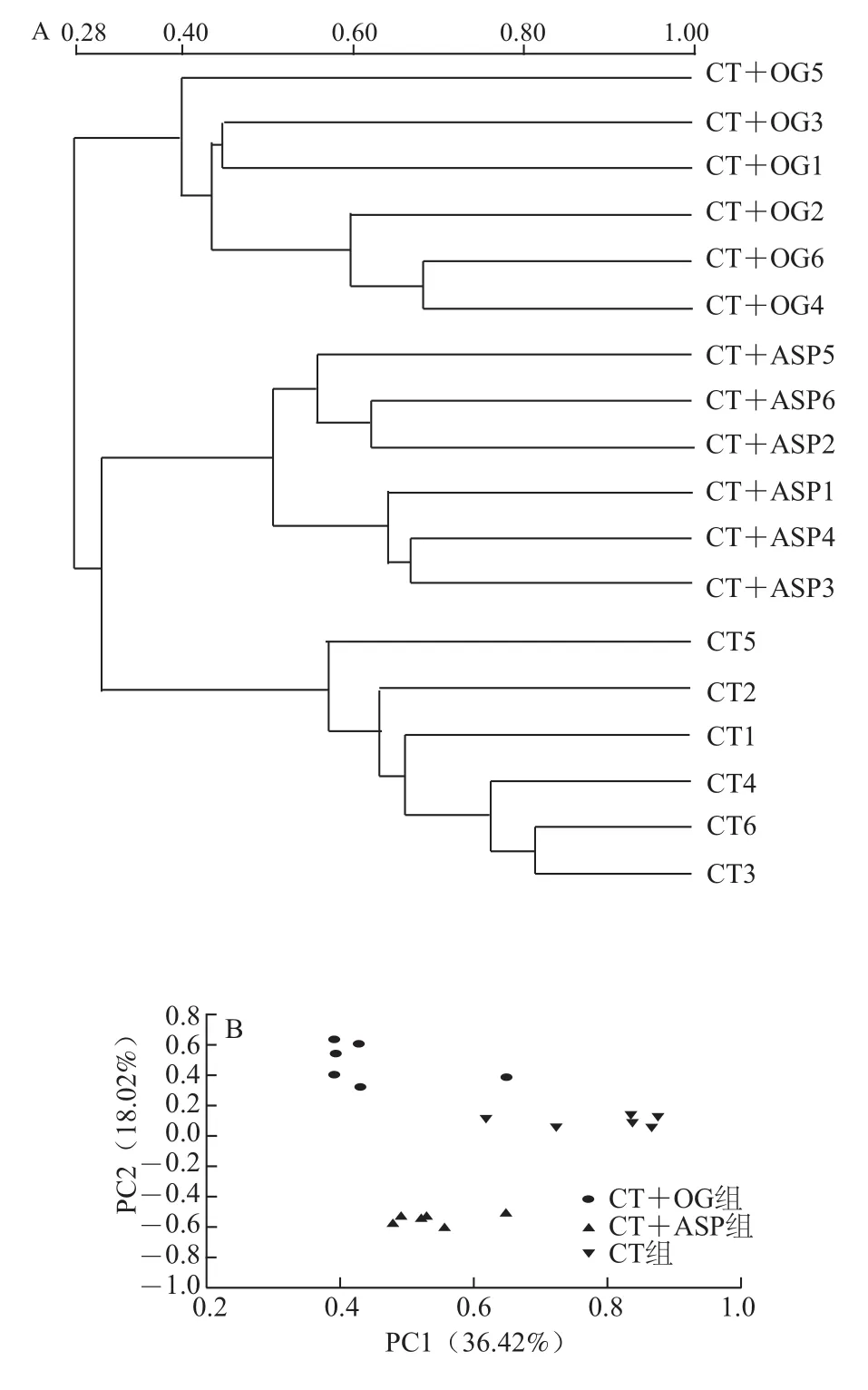
图4 DGGE结果的UPGMA相似性聚类分析(A)和主成分分析(B)Fig.4 UPGMA cluster analysis for similarity coefficients (A) and principal component analysis (B) of DGGE
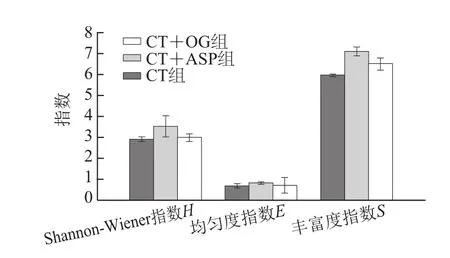
图5 微生物多样性指数分析Fig.5 Diversity indices calculated from the V6–V8 DGGE banding profile
如图5所示,对V6~V8区DGGE图谱进行多样性分析,沙蒿胶多糖组Shannon-Wiener指数H、均匀度指数E、丰富度指数S均高于普通组和燕麦β-葡聚糖组,但无统计学差异(P>0.05)。说明沙蒿胶多糖能增加微生物多样性、增加HFA小鼠肠道微生物种类以及总菌分配均一性,而燕麦β-葡聚糖能增加肠道微生物种类,但对微生物多样性以及总菌分配多样性基本无影响。
3 结论与讨论
本实验分别用含燕麦β-葡聚糖与沙蒿胶多糖饲料饲喂HFA小鼠8 周后,HFA小鼠的血清生化指标、肝脏组织、脂肪组织以及肠道菌群结构都发生了不同的变化,这说明两种多糖对HFA小鼠的生理以及肠道微生物有调节作用,并且二者的作用存在差异。
燕麦β-葡聚糖和沙蒿胶多糖这两种多糖对于降低血清空腹血糖(GLU)含量的作用基本一致,但在对甘油三酯(TG)、总胆固醇(Tch)、高密度脂蛋白胆固醇(HDL-C)及低密度脂蛋白胆固醇(LDL-C)的作用上却完全相反。燕麦β-葡聚糖在降低TG、Tch和LDL-C含量方面表现更突出(P<0.05)。甘油三酯是被贮藏起来的热量源,是脂肪成分,而总胆固醇是指血液中所有脂蛋白所含胆固醇的总和,胆固醇和甘油三酯升高都会导致高脂血症。高密度脂蛋白胆固醇是抗动脉粥样硬化的胆固醇,它可减少患冠状动脉性心脏病的危险。低密度脂蛋白胆固醇水平升高会增加患冠状动脉性心脏病的危险,对健康不利。尽管选用模型不同,本实验中燕麦β-葡聚糖对于血液生化指标的影响与许多报道基本一致,具有降低血糖、胆固醇和体脂等生理功能[17,28-30],从而减少心血管疾病、糖尿病的危险。沙蒿胶多糖对血清生化指标的影响却与许多报道不同,相关研究证明沙蒿胶多糖可缓解Ⅱ型糖尿病大鼠高血糖、高血压和胰岛素抵抗症状,提高血清和肝组织SOD活性[12],并且一定摄食剂量可以显著降低四氧嘧啶诱发的糖尿病小鼠血糖水平[11],最近还有很多专利声称沙蒿胶多糖不仅对Ⅰ型糖尿病大鼠具有降血脂、抗氧化功效,还对肥胖小鼠有降血脂的功能[6]。且中国古代医书记载沙蒿籽粒可用来医治糖尿病[31],这可能与所选的动物模型不同有关。血液生化指标是反映人体健康的重要指标,血液生化指标紊乱会引起心脑血管方面的疾病。甘油三酯升高会导致冠心病和动脉粥样硬化的发生,总胆固醇含量的升高预示着心脑血管疾病发生机率大大提高[29],这提示沙蒿胶多糖有诱发疾病的危险。前人对于β-葡聚糖的保健功能以及作用机理猜想很多,而且也有很多实例证明[15,32]β-葡聚糖具有降低餐后血脂水平、降低胰岛负担、降低脂类成分吸收等功能,通常认为这与其抗营养性能和能在肠内形成高黏度环境有关[33-34],但是沙蒿胶多糖的黏度特性并没有使其具有相应的功能,这说明肠道对于沙蒿胶多糖的吸收率高,但是黏性多糖对于血液生化指标的影响途径是复杂多样的,仍需进一步探究。
从肝脏组织形态学也可看出,多糖饮食对HFA小鼠的肝组织结构没有明显作用,但从脂肪组织形态学观察可看出,沙蒿胶多糖饮食明显增加了脂肪组织的肥大程度,而燕麦β-葡聚糖却可明显避免脂肪细胞肥大,这说明燕麦β-葡聚糖有保肝护肝和减肥作用,而沙蒿胶多糖会引起脂肪沉积和脂肪细胞肥大。
近年来,越来越多的学者关注到肠道菌群对人类健康的重要性。人类与微生物共同进化了数百万年,在此过程中人体肠道形成大量正常菌群,这些菌群在肠道中通过特定的方式形成与宿主相互作用的生理性统一体,发挥营养、免疫、代谢等一系列生理作用[35]。人类的某些疾病是微生物失衡造成的,而不是由于某种致病微生物的存在,如过敏性疾病、肥胖、炎症性肠病等疾病等[36]。对于Ⅰ型糖尿病小鼠模型,肠道微生物群与先天免疫系统的交互会降低患糖尿病的倾向[37]。与无自身免疫个体相比,高遗传糖尿病风险的孩子会表现出不同的肠道微生物群组成,随着时间的推移多样性会下降,并且椭圆形拟杆菌相对丰度升高[38]。肥胖已成为一个主要的健康问题,已有研究表明肥胖与西方式饮食和微生物群密切相关[39]。研究发现导致动物模型肥胖的原因是占主导地位肠道菌群中拟杆菌门的减少和厚壁菌门的增加[40]。然而针对人类双胞胎而言,肥胖个体拟杆菌门下降,但放线菌增加,而不是在于厚壁菌门[41]。究其原因可能是这些菌群丰度的相对改变会增加机体从食物中获取能量的能力,产生低级炎症。肥胖动物模型的诱导通常是通过一些宿主遗传和环境因素的变化来实现微生物群组成的变化。肝脏由于其独特的解剖结构,与肠道也有着密切联系,它是结肠和小肠静脉70%血流通过门静脉流入的第一个肠外器官,所以易受来自血流中肠腔细菌产物的影响。正常情况下,少量移位细菌产物抵达肝脏,但因肝脏免疫系统的“肝耐受”功能,可避免有害反应。但是如果肝脏处于疾病状态,那么这种耐受会被打破而降低肝功能、激活炎性反应并且因肠源性因素而进一步加剧了病理进程[42]。近年来,随着对肠道菌群的逐步重视以及相应技术的发展,通过移植外源肠道微生物群恢复微生物群落健康已经被证明可以作为对某些疾病治疗的有效手段[43]。研究如何通过饮食调控肠道菌群、保障宿主机体健康成为热点科学研究问题之一。本实验通过两种多糖饲喂HFA小鼠发现燕麦β-葡聚糖和沙蒿胶多糖均使肠道菌群结构发生了明显的变化,不仅改变HFA小鼠肠道的菌群组成,还会增加其肠道微生物的多样性,而且CT+ASP组效果比CT+OG组明显(P>0.05)。申瑞玲等[34,44-45]研究已证实,燕麦β-葡聚糖能够起到调节肠道菌群的作用,如促进双歧杆菌和乳酸杆菌的增殖,抑制大肠杆菌的繁殖等,可以作为益生元。但在HFA小鼠模型肠道菌群中这种效果不明显,这可能与模型不同和所提取的多糖分子质量的差异有关。但对于沙蒿胶多糖对肠道菌群的影响鲜有报道,需要进一步探究。上述HFA小鼠的血清、肝脏、脂肪等指标的变化与肠道菌群变化是否有关也需要更深入地研究探讨。
造成燕麦β-葡聚糖与沙蒿胶多糖对菌群人源化小鼠生理及肠道微生物调节方面的差异究其原因可能有:1)多糖组成、糖苷键种类不同导致多糖聚合度不同、结构不同,从而导致其溶解性、流变学特性乃至生理特性不同。结构是其生理功能的基础,溶解性是其发挥生物学活性的首要条件,黏度不仅在一定程度上与其溶解度呈正相关,还是临床上药效发挥的关键控制因素之一,如果黏度过高,则不利于多糖药物的扩散与吸收。Guo Qingbin等[46]认为提取的沙蒿胶多糖是一种由高分子质量沙蒿胶多糖(60P)、低分子质量沙蒿胶多糖(60S)以及游离蛋白质等组分组成的杂多糖,其中中性糖和糖醛酸质量分数分别为66.9%、15.8%。60P含有55.4%中性糖和25.8%糖醛酸,其中包括80.5%木糖、10.9%阿拉伯糖、5%葡萄糖、2.3%半乳糖和1.2%鼠李糖,其主链由木聚糖连接而成[8,47]。60S含有87.1%中性糖和10.4%糖醛酸,由38.3%葡萄糖、28.1%甘露糖、24.2%半乳糖和9.4%阿拉伯糖等单糖组成,主链由(1→4)-β-D-吡喃甘露糖和吡喃葡萄糖组成,且为不被人体消化的β型[9]。燕麦β-葡聚糖为由燕麦β-葡聚糖、蛋白质、脂肪等组成的混合物,燕麦β-葡聚糖是由β-(1→3)糖苷键和β-(1→4)糖苷键连接β-D-吡喃葡萄糖单位而形成的一种高分子无分支线性黏多糖[48-49],且糖苷键比例约为3∶7[14]。2)分子质量不同。燕麦β-葡聚糖和沙蒿胶多糖重均分子质量分别为152 kD和325.8 kD。分子的大小是多糖具备生物活性的必要条件,多糖分子质量越大、分子体积越大,越不利于多糖跨越多重细胞膜障碍进入生物体内发挥生物学活性。而分子质量大小不仅影响溶解度还影响黏度。可见分子质量对于生物活性的影响是至关重要的。3)多糖空间结构存在差异,造成其功能不同。虽然研究者已经清楚燕麦β-葡聚糖和沙蒿胶多糖的一级结构,但关于分子链形态、空间构象、以及聚集结构都还不了解。4)多糖中含有的杂质不同。提取的植物粗多糖多含有蛋白质、脂肪以及其他杂质。而这些杂质在多糖发挥生物活性过程中的作用如何尚不清楚,这就需要进一步提取纯化得到更纯的多糖。
本实验利用HFA小鼠模型,比较燕麦β-葡聚糖与沙蒿胶多糖对菌群人源化小鼠生理及肠道微生物调节的异同,发现二者的作用效果不尽相同:在降低HFA小鼠血清空腹血糖、总胆固醇、甘油三酯含量,脂肪细胞大小方面,分子质量小的燕麦β-葡聚糖功效明显优于分子质量大的沙蒿胶多糖;但在增加HFA模型小鼠肠道微生物多样性方面,分子质量大的沙蒿胶多糖显著优于分子质量小的燕麦β-葡聚糖。
[1]中国植物志编委会.中国植物志(第67卷)[M].北京: 科学出版社,1991: 189-280.
[2]全国中草药汇编编写小组.全国中草药汇编(上册)[M].北京:人民卫生出版社, 1983: 815.
[3]江苏新医学院.中药大词典(下册)[M].上海: 上海人民出版社,1977: 2358.
[4]张继, 高义霞, 武光朋, 等.沙蒿多糖的提取, 纯化工艺研究[J].食品科学, 2007, 28(5): 125-127.
[5]XING Xiaohui, ZHANG Zhengmao, HU Xinzhong, et al.Antidiabetic effects of Artemisia sphaerocephala Krasch.gum, a novel food additive in China, on streptozotocin-induced type 2 diabetic rats[J].Journal of Ethnopharmacology, 2009, 125(3): 410-416.
[6]HU Xinzhong, XING Xiaohui.Medical properties of Shahao in China[J].Ethnomedicine: Source & Mechanism, 2009, 27: 221-240.
[7]BAI S, YONG T, YUN X.Survey and prospect of the studies on the extraction of oil and glue from Artemisia[J].Packaging and Food Machine, 2000, 3: 17-23.
[8]GUO Qingbin, CUI S W, WANG Qi, et al.Structure characterization of high molecular weight heteropolysaccharide isolated from Artemisia sphaerocephala Krasch.seed[J].Carbohydrate Polymers, 2011, 86(2):742-746.
[9]GUO Qingbin, CUI S W, WANG Qi, et al.Structural characterization of a low-molecular-weight heteropolysaccharide (glucomannan)isolated from Artemisia sphaerocephala Krasch.[J].Carbohydrate Research, 2012, 350: 31-39.
[10]HU Xinzhong, XING Xiaohui, ZHANG Zhengmao, et al.Antioxidant effects of Artemis sphaerocephala Krasch.gum, on streptozotocin-induced type 2 diabetic rats[J].Food Hydrocolloids, 2011, 25(2): 207-213.
[11]ZHANG Ji, HUANG Yulong, HOU Tiande, et al.Hypoglycaemic effect of Artemisia sphaerocephala Krasch.seed polysaccharide in alloxan-induced diabetic rats[J].Swiss Medical Weekly, 2006,136(33/34): 529-532.
[12]胡新中, 魏益民, 任长忠.燕麦品质与加工[M].北京: 科学出版社,2009: 16-17.
[13]FRY S C.Polysaccharide-modifying enzymes in the plant cell wall[J].Annual Review of Plant Biology, 1995, 46(1): 497-520.
[14]张晖, 蔡秋声.谷物β-葡聚糖研究进展[J].粮食与油脂, 2010(5): 3-7.
[15]汪海波, 刘大川, 汪海婴, 等.燕麦β-葡聚糖对糖尿病大鼠的血糖及糖代谢功能的影响研究[J].食品科学, 2005, 26(8): 387-391.
[16]TAPPY L, GÜGOLZ E, WÜRSCH P.Effects of breakfast cereals containing various amounts of β-glucan fibers on plasma glucose and insulin responses in NIDDM subjects[J].Diabetes Care, 1996, 19(8):831-834.
[17]BRENNAN C S, CLEARY L J.The potential use of cereal (1→3,1→4)-β-D-glucans as functional food ingredients[J].Journal of Cereal Science, 2005, 42(1): 1-13.
[18]ANDON M B, ANDERSON J W.State of the art reviews: the oatmeal-cholesterol connection: 10 years later[J].American Journal of Lifestyle Medicine, 2008, 2(1): 51-57.
[19]徐超, 胡新中, 罗勤贵, 等.燕麦对小鼠抗疲劳作用的研究[J].中国粮油学报, 2009, 24(9): 36-39.
[20]MÄLKKI Y, VIRTANEN E.Gastrointestinal effects of oat bran and oat gum: a review[J].LWT-Food Science and Technology, 2001,34(6): 337-347.
[21]BYRNE B M, DANKERT J.Volatile fatty acids and aerobic flora in the gastrointestinal tract of mice under various conditions[J].Infection and Immunity, 1979, 23(3): 559-563.
[22]SHEN Ruiling, DANG Xueya, DONG Jilin, et al.Effects of oat β-glucan and barley β-glucan on fecal characteristics, intestinal microflora, and intestinal bacterial metabolites in rats[J].Journal of Agricultural and Food Chemistry, 2012, 60(45): 11301-11308.
[23]曾本华, 唐欢, 李文霞, 等.肥胖患者HFA小鼠模型的建立[J].中国微生态学杂志, 2012, 24(4): 289-291.
[24]李瑞, 廖振林, 方祥, 等.抗性淀粉对HFA小鼠肠道菌群的影响[J].中国微生态学杂志, 2013, 25(7): 762-765.
[25]HIRAYAMA K.Ex-germfree mice harboring intestinal microbiota derived from other animal species as an experimental model for ecology and metabolism of intestinal bacteria[J].Experimental Animals, 1999, 48(4): 219-227.
[26]NÜBEL U, ENGELEN B, FELSKE A, et al.Sequence heterogeneities of genes encoding 16S rRNAs in Paenibacillus polymyxa detected by temperature gradient gel electrophoresis[J].Journal of Bacteriology,1996, 178(19): 5636-5643.
[27]MUYZER G, de WAAL E C, UITTERLINDEN A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Applied and Environmental Microbiology,1993, 59(3): 695-700.
[28]裴素萍, 蔡东联, 朱昱, 等.燕麦β-葡聚糖治疗大鼠高脂血症[J].第二军医大学学报, 2006, 27(5): 510-513.
[29]申瑞玲, 王志瑞, 董吉林, 等.燕麦β-葡聚糖对高脂血症大鼠空腹和餐后脂代谢的影响[J].食品科学, 2009, 30(1): 258-260.
[30]张培培, 樊明涛, 胡新中, 等.燕麦全粉和燕麦β-葡聚糖对大鼠生长和血液生化指标的影响[J].中国粮油学报, 2010, 25(9): 27-31.
[31]ZHAO C X, HUANG Z S.Preliminary study of the drought-resistance structure of main xerophytic plants in Tenggeli Desert[J].Journal of Integrative Plant Biology, 1981, 4: 281.
[32]WANG Dongfeng, WANG Changhong, ZHAO Guiwen, et al.Composition, characteristic and activity of rare earth elementbound polysaccharide from tea[J].Bioscience, Biotechnology, and Biochemistry, 2001, 65(9): 1987-1992.
[33]王凤梅, 樊明寿, 郑克宽.燕麦β-葡聚糖的保健作用及影响其积累的因素[J].麦类作物学报, 2005, 25(2): 116-118.
[34]申瑞玲, 王章存, 姚惠源.燕麦β-葡聚糖对小鼠肠道菌群的影响[J].食品科学, 2005, 26(2): 208-212.
[35]SEKIROV I, RUSSELL S L, ANTUNES L C M, et al.Gut microbiota in health and disease[J].Physiological Reviews, 2010, 90(3): 859-904.
[36]CLEMENTE J C, URSELL L K, PARFREY L W, et al.The impact of the gut microbiota on human health: an integrative view[J].Cell, 2012,148(6): 1258-1270.
[37]WEN Li, LEY R E, VOLCHKOV P Y, et al.Innate immunity and intestinal microbiota in the development of type 1 diabetes[J].Nature,2008, 455: 1109-1113.
[38]GIONGO A, GANO K A, CRABB D B, et al.Toward defining the autoimmune microbiome for type 1 diabetes[J].The ISME Journal,2010, 5(1): 82-91.
[39]LEY R E.Obesity and the human microbiome[J].Current Opinion in Gastroenterology, 2010, 26(1): 5-11.
[40]LEY R E, BÄCKHED F, TURNBAUGH P, et al.Obesity alters gut microbial ecology[J].Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(31): 11070-11075.
[41]TURNBAUGH P J, HAMADY M, YATSUNENKO T, et al.A core gut microbiome in obese and lean twins[J].Nature, 2008, 457: 480-484.
[42]吴文明, 李帆, 杨云生.肠道菌群与肝病关系的研究进展[J].中华消化杂志, 2013, 33(7): 500-502.
[43]BAKKEN J S.Fecal bacteriotherapy for recurrent Clostridium difficile infection[J].Anaerobe, 2009, 15(6): 285-289.
[44]申瑞玲, 王章存, 董吉林, 等.燕麦β-葡聚糖对小鼠结肠菌群及其功能的影响[J].营养学报, 2006, 28(5): 430-433.
[45]申瑞玲, 董吉林, 姚惠源.燕麦β-葡聚糖体内外发酵的研究[J].中国粮油学报, 2006, 21(3): 97-101.
[46]GUO Qingbin, CUI S W, WANG Qi, et al.Extraction, fractionation and physicochemical characterization of water-soluble polysaccharides from Artemisia sphaerocephala Krasch seed[J].Carbohydrate Polymers, 2011, 86(2): 831-836.
[47]GUO Qingbin, WANG Qi, CUI S W, et al.Conformational properties of high molecular weight heteropolysaccharide isolated from seeds of Artemisia sphaerocephala Krasch[J].Food Hydrocolloids, 2013,32(1): 155-161.
[48]LAZARIDOU A, BILIADERIS C G, IZYDORCZYK M S.Molecular size effects on rheological properties of oat β-glucans in solution and gels[J].Food Hydrocolloids, 2003, 17(5): 693-712.
[49]JOHANSSON L, TUOMAINEN P, ANTTILA H, et al.Effect of processing on the extractability of oat β-glucan[J].Food Chemistry,2007, 105(4): 1439-1445.
