南酸枣皮中酚类化合物体外模拟消化与溶剂提取的比较研究
2015-01-30翟宇鑫王谢祎刘继延刘成梅
李 俶,翟宇鑫,陈 军,*,王谢祎,刘继延,程 超,刘成梅
(1.南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047;2.江西齐云山食品有限公司,江西 赣州 341000)
南酸枣又名五眼果,是蒙药习用药材[1]。刘晓庚等[2]通过测定南酸枣果实中的营养成分发现,其含有丰富的单宁、皂苷、黄酮、多酚等生物活性成分。其中多酚类化合物是一种具有显著抗氧化性、抗肿瘤、抗炎症等作用的营养物质,近几年对其来源、功能性质的研究越来越受到关注[3]。目前,有关植物中多酚类化合物的研究比较活跃,主要集中于多酚类化合物提取研究方面[4-6]。然而伴随着日常饮食摄入,食品中的多酚类化合物在体内能否充分释放,并为人体利用进而发挥其各种功能,则需要进一步研究其在体内的消化、代谢和利用[7-8]。然而,体内消化研究面临着复杂度高和道德伦理两大难题,而体外模拟胃肠液消化实验具有简单、快速、成本低、重复性较高等优点,可用于替代体内消化实验而被广泛应用[9-10]。袁春龙等[11]利用体外实验发现葡萄籽多酚类化合物的消化主要发生在胃中。江慎华等[12]发现人工胃液处理后,丁香有效部位抗氧化活性得到显著提高,而人工肠液处理后,其抗氧化活性却显著降低。
近几年,随着江西齐云山食品有限公司对南酸枣系列产品的开发,使得综合利用富含多酚类化合物的南酸枣皮及工业化生产变得日益重要。本实验通过体外模拟胃肠液消化环境与溶剂提取相比较,考察不同处理方式对南酸枣皮中总多酚、总黄酮、原花青素释放的影响,以期为南酸枣皮类产品的开发利用提供科学依据,提高南酸枣皮的应用价值。
1 材料与方法
1.1 材料与试剂
南酸枣皮,由江西齐云山食品有限公司提供。
没食子酸标准品(纯度>99.9%)、牛胆盐 上海晶纯实业有限公司;儿茶素标准品、胃蛋白酶、胰蛋白酶 美国Sigma公司;MD44透析袋 北京Solarbio公司;乙醇、盐酸、甲醇为分析纯 天津市永大化学试剂有限公司;Folin-酚试剂 上海蓝季科技发展有限公司;无水Na2CO3、NaCl、NaHCO3、AlCl3、NaOH、NaNO2、C8H8O3(香草醛)均为分析纯 西陇化工股份有限公司。
1.2 仪器与设备
T6新世纪紫外-可见分光光度计 北京普析通用仪器有限公司;SHB-3型循环水多用真空泵 郑州杜甫仪器厂;HH-4型恒温数显水浴锅 金坛市城西晓阳电子仪器厂;AR1140型分析天平 美国Oahus公司;DFY-500型植物粉碎机 大德药剂有限公司;分样筛 思科仪器纱筛厂。
1.3 方法
1.3.1 样品处理
南酸枣去肉取皮,洗净,50℃条件下烘干,粉碎过100 目筛,20℃条件下保存待分析。
1.3.2 人工胃液制备[13]
分别于两个100 mL具塞锥形瓶中加入9 mg/mL NaCl溶液25 mL、0.1 mol/L盐酸溶液4 mL、4 mg/mL胃蛋白酶溶液4 mL(用0.1 mol/L盐酸配制),混合均匀后,调pH值为2~2.5。各加入1.000 0 g样品,于37℃、100 r/min水浴振荡1 h。一份过滤得上清液后于-20℃条件下保存待分析,另一份继续进行肠液消化。
1.3.3 人工肠液透析
将透析袋用9 mg/mL NaCl溶液内外清洗干净,一端用棉线系紧,加入 9 mg/mL NaCl溶液8 mL,0.5 mol/L NaHCO3溶液2 mL,后系紧另一端,放入上述胃消化液中,于37℃、100 r/min水浴振荡45 min,通过透析袋的选择透过性,缓慢改变消化液pH值,该过程是在模拟食物从胃部向肠道的过渡阶段。
此时,具塞锥形瓶中液体pH值为6.5~7.0附近,于透析袋外加入18 mL胰液胆汁混合液(0.2 mg/mL胰液,1.2 mg/mL胆汁),于37℃、100 r/min水浴振荡2 h,取出透析袋,将透析袋内液体于-20℃条件下保存待分析,具塞锥形瓶中液体过滤得上清液,后于-20℃条件下保存待分析。
1.3.4 生物利用率测定[14]
生物利用率是指从食物中释放出来,在小肠壁的阻碍及选择透过作用下,可进入血液被人体吸收利用的营养物质占食入食物总量的比例。按照公式(1)计算各成分的生物利用率。

式中:C透析为该成分在透析袋内的含量/(mg/g);C非透析为该成分在肠道内的总含量/(mg/g)。
1.3.5 溶剂提取方法
1.3.5.1 传统热水浸提法[15]
精确称取1.000 0 g样品于100 mL具塞锥形瓶中,加入30 mL蒸馏水,于90℃水浴锅中回流提取60 min,过滤,重复上述过程3次,合并滤液定容于250 mL,后于-20℃条件下保存待分析。
1.3.5.2 超声波辅助乙醇提取法[16]
精确称取1.000 0 g样品于100 mL具塞锥形瓶中,加入体积分数52%乙醇溶液30 mL,超声波提取40 min,过滤,重复上述过程3次,合并滤液定容于250 mL后于-20℃条件下保存待分析。
1.3.6 Folin-酚法测定总多酚释放量1.3.6.1 标准曲线的绘制
精密称量1.000 0 g没食子酸,用5 mL乙醇溶解,加水定容至50 mL,分别移取0.5、1.0、1.5、2.5、5.0 mL到50 mL容量瓶中,用水定容。从上述不同质量浓度的标准溶液中分别移取1 mL加入到50 mL容量瓶中,再分别加入30 mL蒸馏水,混合后加入2.5 mL Folin-酚试剂,混合后在5~8 min内加入7.5% Na2CO3溶液2 mL,混合后加水定容。用上述方法制备空白试样,将上述标准溶液和空白试样在20℃条件下避光放置2 h后,在760 nm波长处测定吸光度。以标准样品质量浓度为横坐标,以吸光度为纵坐标绘制标准曲线,线性方程为y=0.780 7x+0.073 7(R2=0.999 3)。
1.3.6.2 样品总多酚释放量测定
准确移取1 mL提取液于50 mL容量瓶中,按照1.3.6.1节方法进行操作,在760 nm波长处测定吸光度,并根据回归方程,按照公式(2)计算提取液中总多酚释放量(以没食子酸当量计)。

式中:ρ1为提取液中总多酚释放量/(mg/mL);V1为提取液总体积/mL;m为南酸枣皮样品质量/g。
1.3.7 NaNO2-AlCl3-NaOH显色法测定总黄酮释放量
1.3.7.1 标准曲线的绘制
准确吸取1 mg/mL儿茶素对照品溶液1、2、3、4、5、6 mL分别置于10 mL比色管中,用水定容。从上述不同质量浓度的标准溶液中分别移取1 mL加入到10 mL比色管中,加入适量蒸馏水,先加5 g/100 mL NaNO2溶液0.5 mL,摇匀放置6 min,再加10 g/100 mL AlCl3溶液0.5 mL,摇匀放置6 min,加4 g/100 mL NaOH溶液3 mL,用蒸馏水定容到10 mL,摇匀放置15 min,以试剂空白为参比,于510 nm波长处测定吸光度,以儿茶素对照品溶液质量浓度为横坐标,吸光度为纵坐标绘制标准曲线,线性方程为 y=3.116 9x-0.065 6(R2=0.999 8)。
1.3.7.2 样品总黄酮释放量测定
精密吸取1 mL提取液置于10 mL比色管中,按照1.3.7.1节方法进行操作,于510 nm波长处测定吸光度,并根据回归方程,按照公式(3)计算提取液中总黄酮的释放量(以儿茶素当量计)。

式中:ρ1为提取液中总黄酮释放量/(mg/mL);V1为提取液总体积/mL;m为南酸枣皮样品质量/g。
1.3.8 香草醛-甲醇-盐酸显色法测定原花青素释放量[17]
1.3.8.1 标准曲线的绘制
精密称量0.100 0 g儿茶素,加甲醇定容至100 mL,分别移取4、5、6、7、8、9 mL分别置于10 mL比色管中,用甲醇定容。从上述不同质量浓度的标准溶液中分别移取1 mL加入到10 mL比色管中,加入4 g/100 mL的香草醛-甲醇溶液6 mL混匀,加入浓盐酸3 mL混匀,30℃条件下避光静置10 min。用紫外分光光度计在500 nm波长处测定吸光度。以甲醇空白为参比,以儿茶素对照品溶液质量浓度为横坐标,吸光度为纵坐标,绘制标准曲线,线性方程为y=2.093 6x+0.046 1(R2=0.996 3)。
1.3.8.2 样品原花青素释放量测定
精密吸取1 mL提取液置于10 mL比色管中,按照1.3.8.1 节方法进行操作,于500 nm 波长处测定吸光度,并根据回归方程,按照公式(4)计算提取液中原花青素的释放量(以儿茶素当量计)。

式中:ρ1为提取液中原花青素释放量/(mg/mL);V1为提取液总体积/mL;m为南酸枣皮样品质量/g。
2 结果与分析
2.1 南酸枣皮中总多酚的释放情况

图1 南酸枣皮总多酚的释放量Fig.1 Amount of total polyphenols in Choerospondias axillaris fruit peels
由图1可知,南酸枣皮总多酚在模拟胃、肠液中的释放呈增加趋势。在模拟胃液的释放量为73.72 mg/g;在模拟肠液中消化后释放量增加10.29 mg/g,在模拟胃液中的释放量占模拟胃肠液总释放量的87.75%。可以看出酚类化合物主要在胃部消化释放。研究发现,胃、肠道消化环境较为复杂,蛋白质、碳水化合物等大分子物质易与多酚类化合物发生结合,形成结合态多酚,并且不同的pH值环境对多酚类化合物影响不同。在胃、肠道消化酶的作用下,结合态多酚化合物随大分子物质水解而分离释放;但胃肠道具有不同的pH值环境,胃液pH值较低呈强酸性,多酚类化合物在酸性环境中结构稳定,而肠道pH值偏碱性,消化液中的多酚类化合物在该环境下易发生聚合或降解,多酚类化合物种类的差异决定了其在消化过程中量变或质变的不同[18-22]。
溶剂提取结果表明,传统热水浸提得总多酚释放量为123.76 mg/g,是超声波辅助乙醇提取总多酚释放量的88.62%。模拟胃肠液中的总多酚释放量显著低于溶剂提取的总多酚释放量,分别为传统热水浸提和超声波辅助乙醇提取总多酚释放量的67.88%、60.16%。由于枣皮中含有丰富的膳食纤维,蛋白酶无法破坏其致密结构,可能对多酚类化合物的释放具有一定阻碍作用。因此直接食用枣皮无法使其中的多酚类化合物充分释放出来,使其随着枣皮残渣排出体外。热水浸提是中药传统口服给药形式,它利用高温促进传质过程,增加溶剂的渗透和多酚类化合物的扩散,但多酚类化合物在水中的溶解度小于在乙醇中,且高温长时加热易造成多酚类化合物降解,故将南酸枣皮以药用方式浸提仍无法实现其充分释放。而超声波技术可产生空化效用,通过机械作用破坏枣皮细胞壁,增加乙醇的渗透性,从而使多酚类化合物可与乙醇充分融合而溶出,释放量最高。
2.2 南酸枣皮中总黄酮的释放情况

图2 南酸枣皮总黄酮的释放量Fig.2 Amount of total flavonoids in Choerospondias axillaris fruit peels
由图2可知,总黄酮的消化释放与总多酚的变化相似。模拟胃液消化1 h后,南酸枣皮总黄酮的释放量为38.55 mg/g,模拟肠液消化2 h后释放量增加8.78 mg/g,增幅为22.79%,在模拟胃液中的释放量占模拟胃肠液总释放量的81.44%。与总多酚的变化趋势不同的是,在模拟肠液中黄酮类化合物释放量增幅较大,肠道对其影响较明显。Bouayed等[13]也发现“Jonaprinz”、“Jonagold”、“Golden”和“Mutzu” 4种苹果经消化后,肠液中的总黄酮释放量高于胃液中的释放量。以上结果可能是由于:1)肠道消化酶有益于黄酮类化合物的释放,可与南酸枣皮进一步作用释放黄酮类化合物;2)其他非黄酮类化合物在肠道消化酶及pH值环境的作用下发生结构重组或降解生成黄酮类化合物[13-14,22]。
传统热水浸提所得总黄酮的释放量为80.26 mg/g,是超声波辅助化学提取所得量的85.22%。模拟胃肠液中总黄酮释放量分别为传统热水浸提和超声辅助化学提取所得释放量的58.97%、50.26%。与南酸枣皮中总多酚的释放量相比,黄酮类化合物在模拟胃肠液中的释放量较低,与溶剂提取所得释放量相差较大,溶剂提取更有助于黄酮类化合物的释放。
2.3 南酸枣皮原花青素的释放情况
由图3可知,原花青素在模拟胃、肠液中的释放与总多酚、总黄酮趋势不同,呈下降趋势。经传统热水浸提后原花青素释放量为78.61 mg/g,是超声波辅助乙醇提取所得释放量的87.56%。模拟胃液消化后,南酸枣皮原花青素释放量为37.53 mg/g,占超声波辅助乙醇提取释放量的41.81%;经模拟肠液消化后,释放量显著下降,降幅为17.87%,与模拟胃液的释放量之间存在极显著差异(P<0.01)。在模拟肠液中,原花青素的降解易受两种因素影响:1)与胰蛋白酶、胆盐相互作用发生分解;2)pH值的升高会引起二聚体的分解,当pH值达到8时,所有的二聚体消失,降解为单体或转化为其他多酚类化合物[23]。由实验结果可推知,经模拟胃液消化后,从南酸枣皮中释放的原花青素可能由部分高聚物、大量二聚体和少量单体组成,模拟胃液消化促进其中原花青素的释放,其含量增加,随着消化到达肠道,南酸枣皮粉继续吸水膨胀,空间阻碍减少,在肠道消化酶的作用下仍有部分原花青素释放,但南酸枣皮中含有较多的二聚体,模拟肠液的pH值在7.0~7.5之间,引起二聚体发生分解,释放量小于分解量,从而引起原花青素含量降低。综合比较总多酚、总黄酮和原花青素的释放情况发现胃、肠道消化可促进多酚类化合物从枣皮中释放,对释放到消化液中的多酚类化合物也有较大影响,引起变化趋势不同,但三者在胃肠道中的释放量均小于溶剂提取的释放量。模拟胃肠液消化对原花青素的释放作用较小,溶剂提取更有利于原花青素的释放。比较3种处理方式发现,超声波辅助乙醇提取可充分释放枣皮中的多酚类化合物,热水浸提其次,模拟胃肠液消化最低,故南酸枣皮中多酚类化合物的释放顺序为:化学提取>中药口服>直接食用。
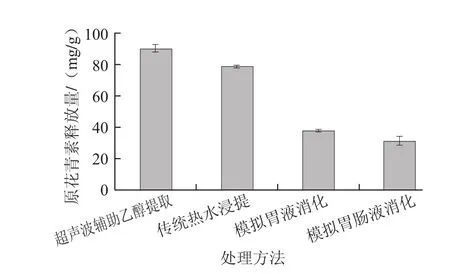
图3 南酸枣皮原花青素的释放量Fig.3 Amount of proanthocyanidins in Choerospondias axillaris fruit peels
2.4 模拟胃肠液消化各成分的生物利用率
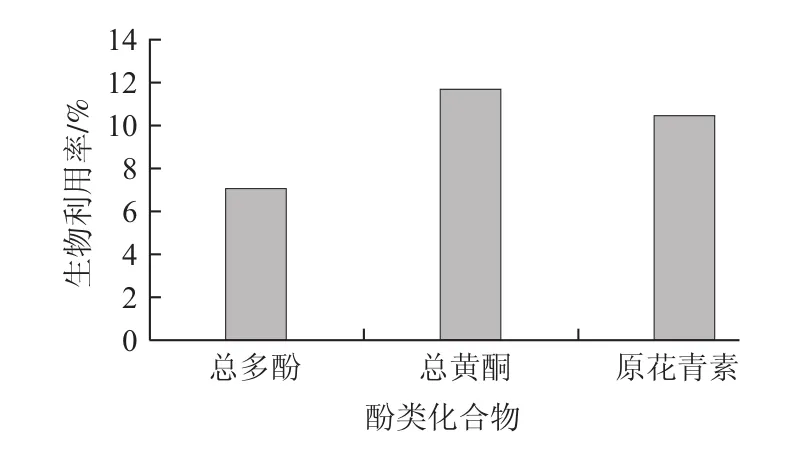
图4 南酸枣皮的生物利用率Fig.4 Bioavailability of Choerospondias axillaris fruit peels
为了模拟小肠上皮细胞对营养物质的吸收阻碍作用,在体外模拟胃肠液消化实验中,使用透析袋建立一个简单的力学模型来完成营养物质的可利用性[24]。由图4可知,透析袋内总多酚、总黄酮和原花青素释放量分别为5.94、5.48、3.21 mg/g,生物利用率分别为7.07%、11.59%和10.42%,分别占超声波辅助乙醇提取总量的4.25%、5.23%和3.58%,生物利用率均较低。肠液pH值偏碱性,消化释放的高含量多酚类化合物进入肠道后,在弱碱性和低温条件下,易分解生成小分子,或相互偶联生成大分子物质,或与其他原料组分之间聚合形成低溶解度或分子质量较大的物质,进而无法穿过透析袋,导致食品的生物利用率较低[25]。比较以上结果可以看出,虽然模拟胃肠液消化无法使黄酮类化合物完全释放,但是其生物利用率却高于总多酚,因此透析袋内以黄酮类化合物为主,可推测出人体对黄酮类化合物有较多吸收。
3 结 论
体外模拟胃肠液消化发现,消化过程中消化酶、pH值对南酸枣皮中总多酚、总黄酮、原花青素的释放有显著影响。总多酚、总黄酮、原花青素的释放主要在胃部发生。模拟胃液可促进多酚类化合物的释放;模拟肠液消化可少量增加总多酚、总黄酮释放量,其中总黄酮的增幅高于总多酚,但其引起原花青素释放量的下降。
透析袋具有选择透过性,根据其孔径大小,相对分子质量小的物质可穿过透析袋,而大分子物质则被截留在透析袋外。本实验通过透析袋来模仿小肠上皮细胞对营养物质的吸收阻碍作用,得出黄酮类化合物最可能被人体吸收利用。
综合比较3种处理方式发现,超声波辅助乙醇提取可充分释放枣皮中的多酚类化合物,热水浸提其次,模拟胃肠液消化仅可释放部分多酚类化合物,故南酸枣皮中多酚类化合物的释放量排序为:化学提取>中药口服>直接食用。
[1]连珠, 张承忠, 李冲, 等.蒙药广枣化学成分的研究[J].中药材, 2003,26(1): 23-24.
[2]刘晓庚, 陈优生.南酸枣果实的成分分析[J].中国野生植物资源,2000, 19(3): 35-40.
[3]TRESSERRA-RIMBAU A, MEDINA-REMON A, PEREZ-JIMENEZ J,et al.Dietary intake and major food sources of polyphenols in a Spanish population at high cardiovascular risk: the predimed study[J].Nutrition,Metabolism & Cardiovascula Diseases, 2013, 23(10): 953-959.
[4]BOTH S, CHEMAT F, STRUBE J.Extraction of polyphenols from black tea: conventional and ultrasound assisted extraction[J].Ultrasonics Sonochemistry, 2014, 21(3): 1030-1034.
[5]高品一, 金梅, 杨頔, 等.金樱子黄酮两种提取工艺优化及比较[J].食品工业科技, 2014, 35(1): 237-241.
[6]卢晓霆, 王田田, 王军.响应面法优化葡萄籽多酚提取工艺[J].食品工业科技, 2013, 34(24): 279-287.
[7]TENORE G C, CAMPIGLIA P, RITIENI A, et al.in vitro bioaccessibility, bioavailability and plasma protein interaction of polyphenols from Annurca apple (M.pumila Miller cv Annurca)[J].Food Chemistry, 2013, 141(4): 3519-3524.
[8]ACOSTA-ESTRADA B A, GUTIERREZ-URIBE J A, SERNASALDIVAR A O.Bound phenolics in foods: a review[J].Food Chemistry, 2014, 152(1): 46-55.
[9]HUR S J, LIM B O, DECKER E A, et al.in vitro human digestion models for food applications[J].Food Chemistry, 2011, 125(1): 1-12.
[10]周勇, 杜先锋, 江慎华, 等.荷叶活性物质超声、超声辅助提取比较及人工胃液处理对其抗氧化活性的影响[J].食品工业科技, 2012,33(17): 106-113.
[11]袁春龙, 李华, 张予林, 等.葡萄籽在模拟人体肠胃环境中的吸收状况[J].中国食品学报, 2011, 11(1): 14-19.
[12]江慎华, 蔡志鹏, 廖亮, 等.丁香抗氧化活性物质提取及人工胃肠液对其活性的影响[J].农业机械学报, 2012, 43(7): 149-155.
[13]BOUAYED J, HOFFMANN L, BOHN T.Total phenolics, flavonoids,anthocyanins and antioxidant activity following simulated gastrointestinal digestion and dialysis of apple varieties: bioaccessibility and potential uptake[J].Food Chemistry, 2011, 128(1): 14-21.
[14]RODRIGUEZ-ROQUE M J, ROJAS-GRAU M A, ELEZ-MARTINEZ P,et al.Soymilk phenolic compounds, isoflavones and antioxidant activity as affected by in vitro gastrointestinal digestion[J].Food Chemistry, 2013, 136(1): 206-212.
[15]WANG Hua, GAO Xiangdong, ZHOU Gaochao, et al.in vitro and in vivo antioxidant activity of aqueous extract from Choerospondias axillaris fruit[J].Food Chemistry, 2008, 106(3): 888-895.
[16]李勇, 黄昀, 陈娜, 等.超声辅助提取辣椒叶中多酚的工艺研究[J].食品工业科技, 2012, 33(13): 216-219.
[17]周秋枝, 黄蕾, 沈丹华, 等.火棘果中原花青素含量测定方法的建立[J].食品工业科技, 2013, 34(7): 314-318.
[18]VILLANUEVA-CARVAIAL A, BERNAL-MARTINE L R, GARCIAGASCA M T, et al.in vitro gastrointestinal digestion of Hibiscus sabdariffa L.: the use of its natural matrix to improve the concentration of phenolic compounds in gut[J].LWT-Food Science and Technology,2013, 51(1): 260-265.
[19]CHIANG C J, KADOUH H, ZHOU K.Phenolic compounds and antioxidant properties of gooseberry as affected by in vitro digestion[J].LWT-Food Science and Technology, 2013, 51(2): 417-422.
[20]SAURA-CALIXTO F, SERRANO J, GON I.Intake and bioaccessibility of total polyphenols in a whole diet[J].Food Chemistry, 2007, 101(2): 492-501.
[21]LOPEZ-NICOLAS R, GONZALEZ-BERNUDEZ C A, ROSBERRUEZO G, et al.Influence of in vitro gastrointestinal digestion of fruit juices enriched with pine bark extract on intestinal microflora[J].Food Chemistry, 2014, 157(15): 14-19.
[22]MARI A, TEDESCO I, NAPPO A, et al.Phenolic compound characterisation and antiproliferative activity of ‘Annurca apple’, a southern Italian cultivar[J].Food Chemistry, 2010, 123(1): 157-164.
[23]FERNANDEZ K, LABRA J.Simulated digestion of proanthocyanidins in grape skin and seed extracts and the effects of digestion on the angiotensin Ⅰ-converting enzyme (ACE) inhibitory activity[J].Food Chemistry, 2013, 139(4): 196-202.
[24]BOUAYED J, DEUBER H, HOFFMANN L, et al.Bioaccessible and dialysable polyphenols in selected apple varieties following in vitro digestion vs.their native patterns[J].Food Chemistry, 2012, 131(4):1466-1472.
[25]CLIFFORD M N.Diet-derived phenols in plasma and tissues and their implications for health[J].Planta Medica, 2004, 70(12): 1103-1114.
