直肠癌术后局部复发的诊治
2015-01-29胡洪梅妍陈功
胡洪 梅妍 陈功
(1云南省玉溪市人民医院普外二科 云南玉溪 653100;2武汉大学口腔医学院2011级本科生 湖北武汉 430072;3中山大学肿瘤医院结直肠科 广东广州 510060)
术后局部复发(local recurrence of rectal cancer)是直肠癌治疗失败的主要模式之一,除了影响生存,疼痛等局部症状对患者的生活质量影响更大,因此,对局部复发的预防和治疗,临床意义尤其重要。
结直肠癌术后局部复发的定义,是指在根治性手术切除(R0)以后,在原来肿瘤瘤床周围、肠周组织或系膜、区域淋巴结或肠道吻合口部位出现的与原发肿瘤病理学同源的肿瘤再生长[1~3],如果手术为R2或姑息切除,则不属“术后局部复发”范畴。根据这一定义,直肠癌的术后局部复发,主要指根治性切除后发生于盆腔内的肿瘤复发。
由于盆腔的特殊解剖特点及手术范围的局限性,直肠癌的术后局部复发率远远要比结肠癌高,在早年的研究里,各报道差异较大,从2.6%~32%[4、5],尽管随着 TME(直肠全系膜切除术)理念的推广、外科技术的提高及术前/术后辅助治疗的合理应用,直肠癌术后局部复发率明显下降,但仍然高达10%左右[6、7],依然是临床治疗面临的一大难题。
1 影响直肠癌术后局部复发的因素
55%~80%的直肠癌术后局部复发发生在术后头2年,而高峰期出现于术后6~12个月,也有少部分患者在术后5年以后才出现复发[4、8、9]。行前切除术(AR)的患者局部复发的诊断时间一般要比行腹会阴联合切除术(APR)者稍早一些,尤其是男性,这可能是因为保留了肠道的完整性,为诊断提供了便利条件。
影响直肠癌术后局部复发的原因是多方面的,危险因素可分为三大类:病理相关的、解剖相关的和手术相关的。病理相关因素主要包括T/N分期、肿瘤分化差、脉管浸润、诊断时伴有肠梗阻或肿瘤穿孔[4];解剖因素包括初始手术时CRM(环周切缘)阳性、远切缘太短或阳性;手术相关因素包括手术方式[10~12]、外科技术和手术量[13],以及并发症如吻合口漏[4]。
这些影响因素里,核心就是MRF(mesorectalfacia,直肠系膜筋膜)状态和手术切缘(包括CRM和远切缘)。肿瘤病理和解剖因素容易导致MRF受侵,从而导致阳性CRM或远切缘,而不当的外科技术、不适当的手术适应证或时机,可以直接导致阳性切缘,从而增加局部复发风险。这些风险因素可以通过规范化治疗来避免和减少。肿瘤T/N分期与外科标准手术层面的关系如图1所示,一方面,倡导标准的TME(直肠全系膜切除术)手术原则来最大限度的保证CRM阴性,另一方面,如果肿瘤为较晚的T/N分期,则应先行术前新辅助放化疗(CRT),来为外科创造阴性CRM的机会,这就是TME手术推广和术前CRT应用后大幅度降低直肠癌局部复发的主要原因。
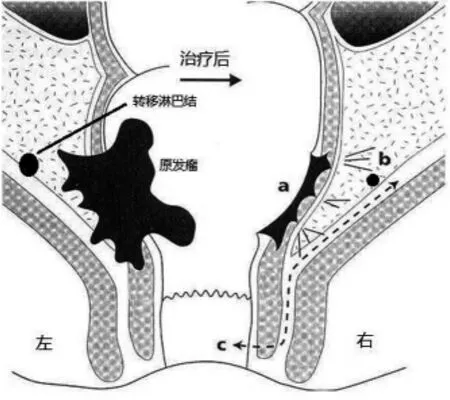
图1 直肠癌局部复发危险因素示意图左侧为治疗前,右侧为治疗后
2 直肠癌局部复发的分类
为了便于预后判断和治疗策略制定,多种方法尝试将直肠癌局部复发进行分类。比如基于疼痛和肿瘤固定程度的 Mayo Clinic分类法[14、15],基于复发病灶在盆腔内的位置和受累结构的MSKCC分类法[16],以及基于复发病灶在盆腔内累及范围的Leeds分类法[17]。分析各种分类法,核心就是复发肿瘤与盆腔脏器、结构的关系,因为这密切关系到能否获得二次手术切除,后者已经被证实是预后最主要的相关因素,也是直肠癌术后局部复发多学科综合治疗的核心内容。局部复发的分类,最大价值在于帮助临床处理决策的制定。目前,Leeds分类法是全球业界采用最广泛的分类方法。具体内容见表1。

表1 直肠癌术后局部复发的Leeds分类法[17]
3 直肠癌术后局部复发的诊断
直肠癌术后局部复发的诊断,主要来源于两个方面:一是患者出现症状后就诊发现,另一个在术后常规监测复查中发现。
3.1 对诊断有帮助的症状和体征 盆腔或会阴部疼痛、感觉异常、不适等是最常见的症状。这类症状的出现,主要是由于病灶在盆腔狭小的空间内对周围组织结构、神经等造成的占位压迫效应所致,随着疾病进展,会渐趋明显,严重影响患者的生存质量。在接受了根治性直肠癌手术后的患者,只要在监测随访的过程中出现上述症状,临床医生第一个想到的应该就是局部复发的问题。其他症状包括血便、便频等类似于原发性直肠癌的症状,这类症状主要见于AR术后的吻合口复发患者;部分患者会出现下肢水肿,由于复发肿瘤压迫导致下肢静脉/淋巴回流障碍所致。
会阴或盆腔肿块是最常见的体征。接受APR手术后,部分患者能在会阴触及肿物,多伴有触痛,这是与术后的疤痕组织最大的鉴别点;女性患者可以通过阴道检查触及到会阴、盆腔内的复发病灶;接受AR手术的患者,可以施行肛门指诊来探及盆腔内位置较低的复发病灶,如果是吻合口肿瘤复发,当然肛门指诊也是能探及肿物的。
3.2 血清癌胚抗原(CEA)水平 血清CEA水平是诊断肿瘤结直肠癌术后局部复发/远处转移最有价值的肿瘤标志物,而且,CEA进行性升高往往早于任何症状出现以前,是第一个信号[1、8]。血清 CEA对诊断复发转移具有很高的特异性,可高达84%,但敏感性则要低得多,约58%[19、20]。有意思的是,很早以前就有研究观察到血清CEA上升的类型与肿瘤复发的模式有关:如果CEA缓慢上升,往往是局部复发,而如果短期内出现明显升高,则往往是出现全身肿瘤的播散和转移[21]。总之,和远处转移的诊断一样,血清CEA水平是诊断直肠癌术后局部复发最有价值的肿瘤标志物。任何出现术后CEA持续升高的患者,均应排查肿瘤复发和转移。
3.3 对诊断有帮助的检查手段 除了病理确诊以外,对诊断直肠癌术后局部复发最有价值的方法当属影像学检查发现局部肿物。
CT和MRI检查:这是目前最有价值的检查手段,当患者出现症状或CEA升高,均应接受检查。对高危患者的术后随访,比如,Ⅲ期患者术后,也推荐每年一次的CT或MRI检查以除外局部复发。
影像学检查一可以发现局部占位,这是诊断复发的最主要征象;二可以帮助判断肿物与邻近结构、器官的毗邻关系,判断再次手术切除的可能性;三可以排除是否伴有远处转移。
对于排查是否出现新发的局部肿物,CT的敏感性和特异性是比较高的,分别是70%和85%[22],由于CT检查的方便及经济,应该作为筛查诊断的第一步。同时,CT的优势还在于排除其他的远处转移。CT最大的弱点在于无法鉴别复发肿瘤与疤痕组织、纤维化组织,而这在APR术后的会阴、骶前区域是很常见的现象[22]。由于该弱点,CT在判断复发肿瘤与重要结构的毗邻关系时,比如骶骨和髂血管,也就存在先天不足,因为很难鉴别肿物与这些结构是炎症粘连还是肿瘤浸润,所以,尽管在判断复发肿瘤的可切除性时,CT的预测度可高达85%,但对粘连处切缘阳性的预测就要差得多,假阳性率64%,假阴性率36%。
MRI是影像检查手段里最有价值的一个,敏感性一般在95%左右,而对于鉴别组织纤维化、疤痕和肿瘤,甄别复发肿瘤对邻近器官结构的浸润,其特异性最高,报道的介于76%~100%[22]。这主要得益于MRI对不同组织分辨率的差异。一般来说,绝大多数患者的纤维化组织在T1和T2加权像均表现为低信号影,但有活性的恶性肿瘤组织则会在T2加权像呈现为更高信号的占位。但如果在近期接受过放射治疗的患者,MRI对纤维化与肿瘤的鉴别,特异性有所降低[23]。MRI的另一个限制就是当组织存在炎症反应时其准确性受影响,尤其是在术后早期(比如1年以内)。
当给患者施行CT/MRI检查时,上述特殊情况要予以考虑。
直肠腔内超声(ERUS):价值主要局限于局部切除术后的直肠壁内复发或AR术后的吻合口复发,对其他的局部复发,诊断价值甚微。
PET/CT:主要价值在两方面,一,帮助判断局部病灶是否属恶性。主要根据SUV值来判断,[18]F-FDG PET/CT检查时,一般认为SUV 4~6时多为恶性,而SUV为3时,诊断价值则变得模棱两可[24]。PET/CT诊断局部复发的敏感性接近100%,特异性也高达96%。PET/CT的另外一个重要价值是发现其他影像学检查未能发现的远处微小转移,比如肝、肺、腹盆腔,从而改变了大约14%左右患者的既定治疗策略[25]。由于价格昂贵,PET/CT很难作为常规检查,因此,临床主要应用在两方面,一是其他检查难以确诊,无法取得组织学诊断时;二是当需要行创伤性较大的手术来根除局部复发肿瘤(比如,器官毁损性手术)时,行PET/CT来排除潜在转移从而避免过度手术。
3.4 获取组织学诊断的方法 如果患者确诊后有可能接受放疗、化疗,或根治性手术切除者,应该尽可能取得病理组织学的诊断,尤其是对那些需行器官毁损性手术者,则必须要有病理学证实为肿瘤复发。以下方法可以取得组织用于病理诊断:
(1)内窥镜活检:对于吻合口复发或直肠癌局部切除术后的腔内复发,此为病理活检的标准方法,只是该类患者仅占局部复发患者的很少比例。
(2)穿刺活检:对于绝大多数局部复发的患者,由于肿块位于下腹、盆腔深部,肠腔以外,内窥镜下直接活检是不可行的,穿刺活检是唯一手段,如有可能,应该尽可能使用套管针穿刺活检(true-cut biopsy,或core-needle biopsy),以保证能取到足够的组织用于病理分析。穿刺活检可以在影像学方法介导下完成。如果BUS能发现肿物,那应该优先考虑,因为简便易行,费用低廉,如果是邻近肠管的肠壁外复发,也可以在内镜超声引导下进行穿刺活检;CT引导下穿刺是成功率最高的方法,适用度很广,组织活检成功率最高,但操作繁琐,费用较贵。炎症反应、纤维化组织等因素会影响组织诊断的准确性。
(3)手术探查活检:如果临床无法排除复发,其他方法又无法取得组织学诊断,需病理确诊时,可考虑手术探查活检,但应主要用于那些手术切除可能性较大、手术不会涉及太广泛组织、器官毁损切除的时候,可考虑手术探查,直接手术切除。而对于肿瘤明显无法切除,或患者无法耐受手术、放化疗等强烈治疗时,应该尽量避免此类活检术,此时,可以根据病史、症状及影像学做出临床诊断。
3.5 诊断原则(中山大学肿瘤医院经验)
(1)临床诊断:影像学发现肯定的占位征象,结合上述的直肠癌病史、症状体征和CEA,可以做出局部复发的临床诊断,其中,影像学的阳性发现是临床诊断的必要条件,如果没有该证据,仅凭症状和CEA,不应该诊断局部复发,更不应据此开始治疗。获得临床诊断者,经过医院结直肠癌MDT(多学科团队)的综合讨论,知情同意后大多数患者可开始临床治疗而无需病理活检,但如下几种情形,需要病理。
(2)需要病理确诊的情形:由MDT讨论做出决策。①临床诊断不典型,但不能排除复发者;②组织学诊断容易获得,而且不会对患者造成过大损伤,如吻合口复发、局切后肠腔内复发者可通过内镜活检;③吻合口复发、局切后复发,估计再次手术需要行造口术者;④再次手术需行器官毁损性手术者;⑤放化疗部门要求者:如估计治疗并发症、后遗症较大者。
(3)观察性诊断:影像学可疑复发征象,但其他临床诊断依据不充分、组织学穿刺诊断阴性或不可获得、暂无治疗适应证者,可采取对疑似复发病灶进行观察和密切随访,比如通过影像学手段对比肿物大小的变化、再次活检等。
(4)如果患者无法接受针对复发肿瘤的进一步治疗(包括身体原因和主观治疗意愿),则应尽可能避免施行过多的诊断性检查。
4 直肠癌术后复发的治疗
4.1 治疗前评估
(1)患者接受治疗的潜在可能性:包括患者的治疗意愿、对手术/放化疗的身体耐受性、是否存在肿瘤相关症状。
(2)既往肿瘤治疗的详细信息:手术方式,放疗的总剂量、照射野分布、放疗结束时间,化疗的具体方案、剂量、疗程和结束时间。
(3)肿瘤范围的评估及分类:仅有局部复发,还是同时伴有远处转移?并对局部复发肿瘤按照Leeds分类法进行分类。
(4)复发肿瘤可切除性的判断:治疗前评估是最重要的环节。根治性外科切除仍然是直肠癌术后局部复发唯一的治愈手段,因此,应该对所有的适合治疗患者进行局部复发肿瘤的可切除性进行评估。
复发肿瘤的解剖部位和局部浸润程度与可切除性明显相关;患者伴随盆腔疼痛预示着肿瘤对盆壁的浸润严重,切除率显著降低[15];盆腔侧壁结构和高位骶骨(S3以上)是否受侵是复发肿瘤能否切除的最重要标志,因此,侧壁型和骶前型的切除率最低,而前侧型或中央型则切除率最高[16、26、27]。高位骶骨受侵尽管一般列为相对禁忌证,但由于在此范围骶1~2神经容易受侵,切除后并发症和生活质量很差,也应列为禁忌证。需要说明的是,很多时候,能否切除只有在手术台上探查后才能最终判断,因此,只要没有绝对的手术禁忌证,均应为患者保留手术探查的权利。表2列举了直肠癌局部复发的手术禁忌证。
可切除性的判断评估,还包括可能要一并切除的邻近受累组织和器官[28、29]。

表2 直肠癌局部复发的手术禁忌证
4.2 治疗的总体原则 根据治疗前评估,可将患者的治疗分为两大类:根治性治疗和姑息性治疗。前者指局部复发肿瘤和伴发的远处转移(如果有的话),均可以手术切除或通过新辅助放化疗后手术切除;而后者则是指患者无法耐受手术或者局部复发肿瘤或远处转移瘤绝对无手术切除指征。
对根治性治疗,目标是治愈,因此手术是核心,但应结合局部放射治疗(可以术前、术中和术后)和全身化疗来提高疗效,并注重治疗带来的毒性和对生活质量的影响。
对姑息性治疗,核心是缓解症状、保证生活质量,在此基础上尽量延长生存,主要方法应为局部放疗和全身化疗,手术仅应视为减状性。
应该要强调的是,由于疾病的特殊性,直肠癌局部复发,肿瘤本身和后续采取的治疗,均会对患者的正常器官生理功能、生活质量造成明显影响,需谨慎评估并和患者及家属充分知情。一旦判断需行造口(肠造口或泌尿造口),应该纳入造口治疗师对患者进行术前造口咨询、定位等准备。
目前在中山大学肿瘤医院,所有患者的治疗前评估,都由MDT来完成,尤其是关于可切除性的判断;所有患者接受MDT综合讨论,然后给出具体的治疗建议。图2为直肠癌术后局部复发的常规诊疗流程[29]。
4.3 根治性治疗
4.3.1 手术切除 获得阴性切缘的R0切除是根治性手术的主要标准,而这,往往需要行扩大手术切除范围,以下一些名词分别用来描述直肠癌局部复发的手术方式和范围[26]。
根治性切除术(radical resection):一般指将复发肿瘤完整切除而无需切除周围脏器。
扩大根治术(extended radical resection):指连同周围受累器官一并切除才能达到R0的根治性手术。由于直肠癌术后局部复发基本位于盆腔内,这类手术又被称为“盆腔廓清术”(pelvic exenterations),前盆腔廓清术指同期切除泌尿、生殖道等前盆腔内受累的脏器,后盆腔廓清术指一并切除骶骨。
(1)中央型复发的手术方式:图3概述了中央型复发的手术选择[29]。该型的手术切除率是最高的。
如果复发肿瘤位于吻合口或直肠系膜内,或者不累及前侧的任何一个泌尿生殖道器官,那腹会阴联合切除包括肛门和新直肠在内的结构是最好的手术方式。对有选择的病例如果原来的吻合口位置足够高,应争取再次吻合术。应尽量切除部分周围软组织以保证阴性切缘。
如果前侧泌尿生殖道器官受累,扩大根治的盆腔廓清术是唯一的选择。需要联合切除的器官视受累程度决定。
(2)骶前型复发的手术选择:如果肿瘤局限于骶前筋膜前方或仅累及骨外膜,可疑施行根治性整块切除而无需切除骶骨;一旦骶骨骨质受累,包含骶骨切除的扩大根治术是必须的。扩大根治术通常采用会阴-骶后联合入路[30、31],首先在截石位(改良Lloyd-Davies体位)下进行盆腔内操作,处理髂内血管、输尿管的关系,游离肿物的前方和侧方,将需要合并切除的器官和组织整块游离切断,仅剩肿物于后方与骶骨粘连;完成需要的造口、关闭/修复盆底,然后关闭腹腔。换“折刀状俯卧位”(prone jackknife position),从骶部后入路进行骶骨切除术。图4概述了骶前型/侧壁型复发的手术选择[29]。
(3)侧壁型复发的手术选择:侧壁型复发的手术切除率最低,预后最差,尤其是当髂血管和输尿管受侵犯时[16、32]。但近来有报道认为联合髂血管切除并人工血管修复的扩大根治术带来了令人满意的R0切除率(53%)和5年生存率[33],可以考虑严格挑选患者后在有经验的中心进行该类手术。侧壁的软组织受累,可以一并切除,但如果侧方的骨性骨盆受累,则几乎没有R0切除的可能性。
(4)手术中的组织修复和重建:直肠癌局部复发病灶广泛切除术后,往往需要盆腔、会阴的组织修复与重建。盆底重建可以采用大网膜填充、生物补片修复盆底,更大的盆腔缺损可以考虑带血管蒂的皮瓣转移修复。会阴缺损最常用的转移皮瓣修复是带血管蒂的腹直肌肌皮瓣。术前宜估计到缺损的范围,有可能请整形外科术前会诊,准备修复方案。
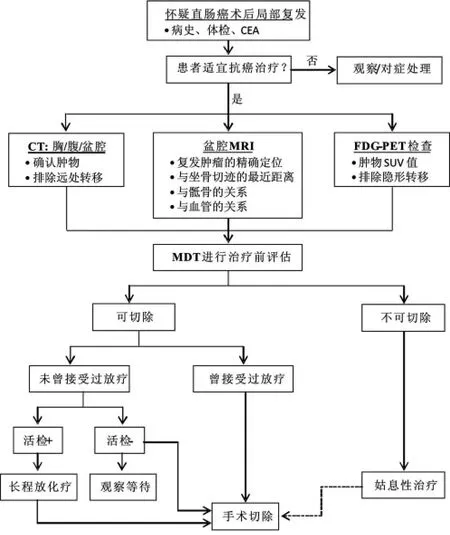
图2 直肠癌术后复发的诊疗流程
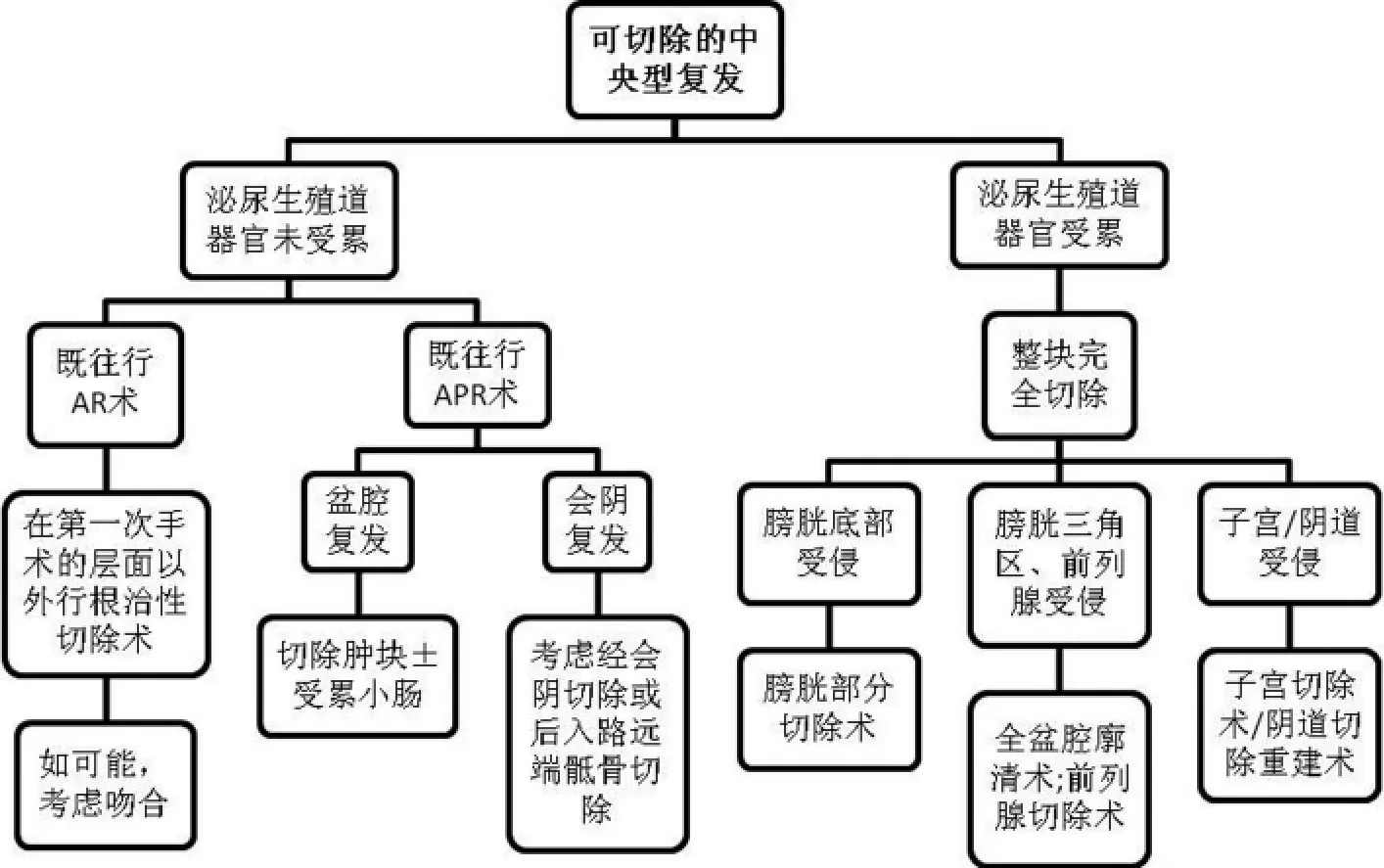
图3 中央复发型的外科流程
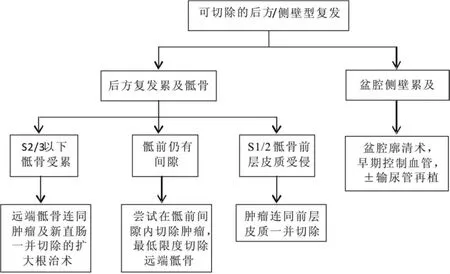
图4 后方/侧壁型复发的外科流程
4.3.2 围手术期治疗
(1)放化疗:盆腔的同步放化疗(CRT)能显著增加局部复发肿瘤切除术后的局部控制,对部分初始判断不能切除或估计切缘阳性的局部复发肿瘤,CRT能显著提高R0切除率[34]。目前国内外对此的推荐是,未接受过放射治疗的患者,只要身体允许,均应在施行复发肿瘤手术切除以前给予术前CRT,放疗采用长疗程外照射,总剂量50.4Gy,常规分割,四野照射;同期采用单药氟尿嘧啶同期增敏(如5-FU持续静脉输注或口服卡培他滨),身体情况较好者、肿瘤负荷较大者,可以考虑在放疗同时行联合方案化疗,如FOLFOX(奥沙利铂/醛氢叶酸/氟尿嘧啶)、XELOX(奥沙利铂/卡培他滨),如果既往已经行APR手术,也可以考虑用含伊立替康的方案化疗。靶向药物在这种情况下的价值未明。
如果患者既往初次治疗时已经接受了放射治疗,部分患者仍可以考虑再次放疗,剂量限制在20~30Gy,放疗相关毒性12%~21%,可以接受[35、36];但至于能给予再次放疗的安全的时间窗,目前没有统一标准,应由放疗科医生来决定。接受了术前CRT的患者,一般在放疗结束后6~8周进行手术,以便放疗对肿瘤的效应能完全发挥出来。如果无法接受术前CRT者,可以考虑在术后进行CRT。
(2)术后化疗:目前并没有随机对照研究来验证术后全身化疗在直肠癌术后局部复发的根治性治疗中的价值。只是,根据晚期疾病的总体治疗原则来外推,可以考虑围手术期6个月的全身治疗,如果术前已经进行新辅助CRT,术后化疗相应缩短疗程,放化疗方案一般参照Ⅲ期结肠癌的辅助治疗。R0切除后的全身化疗,目前不主张使用靶向药物。
(3)术中放疗:术中放疗(intraoperative radiotherapy,IORT)的价值比较有争议。多数研究认为能增加局部控制,但鉴于设备要求、手术室放射防护等客观原因,一般用于切缘太近(切缘>5mm时不需要IORT)或者为R1切除,或者残留肿瘤不太多的R2切除时,以增强局部控制,减少术后再复发。目前推荐的IORT剂量与切缘或肿瘤残留相关:切缘太近的R0切除时,TD(总剂量)=750~1250cGy;R1切除时,TD=1000~1500cGy;局部R2切除时,TD=1500~2000cGy[37~39]。IORT目前在国内仅有极少数大型研究性医院可以开展。
4.4 姑息性治疗
4.4.1 缓解症状的治疗
放射治疗:对缓解疼痛、减少分泌、控制出血均有明显效果,有研究发现放疗可以为75%的患者带来疼痛和出血的改善[40]。常用的方法同根治性治疗中的放射治疗。对部分患者,可以考虑局部放射性粒子置入达到控制疼痛等症状的目的。
姑息性肿物切除:当患者伴有全身不可切除的远处转移,而盆腔局部复发病灶伴有明显症状而且可以切除,如果不带来过大的手术创伤,可以考虑姑息切除局部复发病灶以缓解相关症状,如有可能,也可以采用局部消融来处理局部病灶。
肠梗阻的治疗:以姑息为目的的梗阻治疗,如果是吻合口复发,可以考虑支架置入,但需要注意的时距离肛门5cm之内的病灶梗阻是不适合支架置入的,因为会给患者带来明显的异物感,严重影响生活质量[41];对于该部位的肿瘤梗阻,激光再通术是个不错的选择,除了缓解梗阻,也可以减少出血。手术是治疗梗阻的最后选择,可行造口手术或短路手术,如果通过姑息切除肿物达到缓解梗阻、无需造口的目的,也应在权衡利弊后做出决定。
对症支持治疗:应考虑按晚期癌痛的治疗来控制复发肿瘤引起的疼痛,方案同三阶梯止痛治疗。对部分顽固性疼痛,可以考虑神经根阻滞或毁损。
4.4.2 延长生存的治疗 主要是全身化疗,具体方法同晚期结直肠癌的治疗,根据身体情况,选择氟尿嘧啶为基础、联合奥沙利铂(FOLFOX/XELOX)或伊立替康(FOLFIRI)的方案,有条件者,可以联合抗VEGF的靶向治疗(贝伐单抗),KRAS基因野生型患者,也可联合抗EGFR靶向治疗(如西妥昔单抗)。
4.5 MDT综合治疗的疗效 联合了放化疗、根治性手术的MDT综合治疗,为直肠癌局部复发患者带来了令人鼓舞的结果,多个研究发现5年总生存率可达20%~36%,局部控制率50%,如果R0切除,则 OS可延长至37%~60%[26、34],MDT 综合治疗带来的结局,好于单纯手术(5年OS大约24%),更远远好于既往仅接受姑息治疗者(5年OS 0%~5%)[42]。
5 结 语
直肠癌术后局部复发往往浸润盆腔多个结构和脏器,严重影响患者的生活质量,处理比较复杂,仍然是临床一大难题。在患者的处理过程中,涉及到影像、病理、结直肠外科、泌尿外科、肿瘤妇科、整形外科和造口康复治疗等多个学科,MDT综合诊疗模式不但在治疗前评估提供了最准确的分期信息,更为治疗提供了最优化的决策和治疗方法,也为患者带来了最佳的治疗结局,应该大力推广。
[1]Goligher JC,ed.Surgery of the Anus,Rectum and Colon.5th ed.London:BailliereTindall,1984.
[2]Umpleby HC,Williamson RC.Anastomotic recurrence in largebowel cancer[J].Br JSurg,1987,74:873-878.
[3]Sugarbaker PH.Recurrent and advanced primary colorectalcancer:therapeutic implications of new concepts of gastrointestinaltumour biology[J].BaillieresCIin-Gastroenterol,1989,3699-3712.
[4]Abulafi AM,Williams NS.Local recurrence of colorectal cancer:the problem,mechanisms,management and adjuvant therapy[J].Br J Surg,1994,81:7-19.
[5]McCall JL,Cox MR,Wattchow DA.Analysis of local recurrencerates after surgery alone for rectal cancer[J].Int J Colorectal Dis,1995,10:126-132.
[6]Bakx R,Visser O,Josso J,et al.Management of recurrent rectalcancer:apopulation based study in greater Amsterdam[J].World JGastroenterol,2008,14:6018-6023.
[7]Sebag-Montefiore D,Stephens RJ,Steele R,et al.Preoperativeradiotherapy versus selective postoperative chemoradiotherapyin patients with rectal cancer(MRC CR07and NCIC CTGC016):a multicentre,randomised trial[J].Lancet,2009,373:811-820.
[8]Phillips RK.Hittinger R.Blesovsky L,et al.Localrecurrence following'curative'surgery for large bowel cancer I.The overall picture[J].Br J Surg,1984,71:12-16.
[9]Carlsson U,Lasson A,Ekelund G.Recurrence rates after curativesurgery for rectal carcinoma,with special reference to theiraccuracy[J].Dis Colon Rectum,1987,30:431-434.
[10]Dent OF,Haboubi N,Chapuis PH,et al.Assessing the evidencefor an association between circumferential tumour clearance andlocal recurrence after resection of rectal cancer[J].Colorectal Dis,2007,9:112-121.
[11]G.Moore,E.Riedel,B.D.Minsky,et al.Adequacy of1-cm distal margin after restorative rectal cancer resectionwith sharp mesorectal excision and preoperative combinedmodalitytherapy[J].Annals of Surgical Oncology,2003,10(1):80-85.
[12]Bentrem DJ,Okabe S,Wong WD,et al.T1adenocarcinoma of the rectum:transanal excision or radical surgery[J].Ann Surg,2005,242(4):472-477.
[13]Stocchi L,Nelson H,Sargent DJ,et al.Impact of surgical andpathologic variables in rectal cancer:a United States communityand cooperative group report[J].J ClinOncol,2001,19:3895-3902.
[14]Suzuki M,Dozois RR,Devine RM,et al.Curative reoperationsfor locally recurrent rectal cancer[J].Dis Colon Rectum,1996,39:730-736.
[15]Hahnloser D,Nelson H,Gunderson LL,et al.Curative potentialof multimodality therapy for locally recurrent rectal cancer[J].AnnSurg,2003,237:502-508.
[16]Moore HG,Shoup M,Riedel E,et al.Colorectal cancer pelvicrecurrences:determinants of resectability[J].Dis Colon Rectum,2004,47:1599-1606.
[17]Boyle KM,Sagar PM,Chalmers AG,et al.Surgery for locallyrecurrent rectal cancer[J].Dis Colon Rectum,2005,48:929-937.
[18]Tan E,Gouvas N,Nicholls RJ,et al.Diagnostic precision ofcarcinoembryonic antigen in the detection of recurrence ofcolorectal cancer[J].SurgOncol,2009,18:15-24.
[19]Martin EW Jr,Minton JP,Carey LC.CEA-directed second-looksurgery in the asymptomatic patient after primary resection ofcolorectal carcinoma[J].Ann Surg,1985,202:310-317.
[20]Grabbe E,Winkler R.Local recurrence after sphincter savingsurgery for rectal and rectosigmoid carcinoma:value of variousdiagnostic methods[J].Radiology,1985,155:305-310.
[21]Wood CB,RatclifTe JG,Burt RW,et al.The clinical significance of the pattern of elevated serumcarcinoembryonic antigen(CEA)levels in recurrent colorectalcancer[J].Er J Surg,1980,67:46-48.
[22]Beets-Tan RG,Beets GL,Borstlap AC,et al.Preoperativeassessment of local tumor extent in advanced rectal cancer:CT orhigh-resolution MRI[J]?Abdom Imaging,2000,25:533-541.
[23]Messiou C,Chalmers AG,Boyle K,et al.PreoperativeMR assessment of recurrent rectal cancer[J].Br J Radiol,2008,81(966):468-473.
[24]Watson AJ,Lolohea S,Robertson GM,et al.The role ofpositron emission tomography in the management of recurrentcolorectal cancer:a review[J].Dis Colon Rectum,2007,50:102-114.
[25]Faneyte IF,Dresen RC,Edelbroek MA,et al.Pre-operative staging with positron emissiontomography in patients with pelvic recurrence of rectal cancer[J].Dig Surg,2008,25:202-207.
[26]Heriot Ag,Byrne CM,Dobbs B,et al.Extended radical resection:the choice for locally recurrent rectal cancer[J].Dis Colon Rectum,2008,51:284-291.
[27]Yamada K,Ishizawa T,Niwa K,et al.Pelvic exenteration andsacral resection for locally advanced primary and recurrent rectalcancer[J].Dis Colon Rectum,2002,45:1078-1084.
[28]Bouchard P,Efron J.Management of Recurrent Rectal Cancer[J].Ann SurgOncol,2010,17:1343-1356.
[29]Mirnezami AH,Sagar PM,Kavanagh D,et al.Clinical Algorithms for the Surgical Management ofLocally Recurrent Rectal Cancer[J].Dis Colon Rectum,2010,53:1248-1257.
[30]Melton GB,Paty PB,Boland PJ,et al.Sacral resection for recurrentrectal cancer:analysis of morbidity and treatment results[J].Dis Colon Rectum,2006,49:1099-1107.
[31]Sagar PM,Gonsalves S,Heath RM,et al.Composite abdominosacralresection for recurrent rectal cancer[J].Br J Surg,2009,96:191-196.
[32]Chong PS,Finlay IG.Surgical options in the management ofadvanced and recurrent colorectal cancer[J].SurgOncol,2007,16:25-31.
[33]Austin KK,Solomon MJ.Pelvic exenteration with en bloc iliacvessel resection for lateral pelvic wall involvement[J].Dis ColonRectum,2009,52:1223-1233.
[34]Dresen RC,Gosens MJ,Martijn H,et al.Radical resection afterIORT-containing multimodality treatment is the most importantdeterminant for outcome in patients treated for locally recurrentrectal cancer[J].Ann SurgOncol,2008,15:1937-1947.
[35]Mohiuddin M,Marks G,Marks J.Long-term results of reirradiationfor patients with recurrent rectal carcinoma[J].Cancer,2002,95:1144-1150.
[36]Valentini V,Morganti AG,Gambacorta MA,et al.Preoperativehyperfractionatedchemoradiation for locally recurrent rectalcancer in patients previously irradiated to the pelvis:a multicentricphaseⅡstudy[J].Int J Radiat Oncol Biol Phys,2006,64:1129-1139.
[37]Mannaerts GH,Martijn H,Crommelin MA,et al.Intraoperativeelectron beam radiation therapy for locally recurrent rectal carcinoma[J].Int J Radiat Oncol Biol Phys,1999,45:297-308.
[38]Lindel K,Willett CG,Shellito PC,et al.Intraoperative radiationtherapy for locally advanced recurrent rectal or rectosigmoidcancer[J].Radiother Oncol,2001,58:83-87.
[39]Wiig JN,Tveit KM,Poulsen JP,et al.Preoperativeirradiation and surgery for recurrent rectal cancer.Willintraoperative radiotherapy (IORT)be of additional benefit?Aprospective study[J].Radiother Oncol,2002,62:207-213.
[40]Willett CG,Gunderson LL.Palliative treatment of rectal cancer:is radiotherapy alone a good option[J].J Gastrointest Surg,2004,8:277-279.
[41]Song HY,Kim JH,Kim KR,et al.Malignant rectal obstructionwithin 5cm of the anal verge:is there a role for expandablemetallic stent placement[J].Gastrointest Endosc,2008,68:713-720.
[42]Saito N,Koda K,Takiguchi N,et al.Surgery for local pelvicrecurrence after resection of rectal cancer[J].Int J Colorectal Dis,1998,13:32-38.
