慢性肝炎基础上≤2c m肝局灶性病变的超声造影与增强C T特征比较
2015-01-29叶桂宏
叶桂宏 杨 红
广西医科大学第一附属医院超声诊断科,广西南宁 530021
早期诊断对在慢性肝病基础上的肝细胞癌(HCC)患者的预后有其深远意义,对这些患者的定期监测尤为重要[1-2],目前的监测方法主要依靠甲胎蛋白(AFP)监测和影像学检查,影像学检查中包括彩色多普勒超声、增强CT和MRI、超声造影,超声造影技术可以显示肝肿瘤的微血管灌注,明显提高肝肿瘤的检出率及鉴别诊断能力。
1 资料与方法
1.1 一般资料
回顾性分析2010年11月~2014年5月在广西医科大学第一附属医院超声诊断科行超声造影检查及超声引导穿刺活检病理证实的25例伴有肝硬化或者慢性肝病的肝局灶性病变(FLLs),患者年龄31~75岁,平均 53岁,病灶直径 1.0~1.8 cm(均≤2 cm),平均1.4 cm,所有的病例血清AFP定量诊断为0~49.6 μg/mL。
1.2 仪器
超声造影检查仪器为GE公司的LOGE9彩色多普勒超声仪。超声造影剂为Bracco公司生产的Sono-Vue。增强CT采用GE 64排Light Speed螺旋CT扫描仪。对比剂为优维显(300 mgI/mL)。超声引导穿刺活检仪器采用日立EUB6500彩色多普勒超声诊断仪,穿刺针采用美国CRbard射程可调式活检枪及18G切割针。
1.3 方法
所有患者在超声造影前签订超声造影知情同意书,然后行常规超声检查,观察目标病灶及肝组织,记录病灶的数目、大小、部位、形态、边界、内部回声及病灶内血供等。确定目标病灶的最大扫查切面后,切换至造影模式,并设置机械指数为0.15,超声造影剂使用前用5 mL生理盐水溶解造影剂冻干粉,震荡摇匀后每次抽取2.4 mL经肘静脉团注,然后用5 mL生理盐水快速冲管。注射造影剂的同时启动计时器,连续实时观察病灶及周围肝组织造影成像5 min,造影全过程的动态图像存储于仪器硬盘中。增强CT扫描条件为管电压120 kV,管电流280 mA,重建层厚为5 mm,螺距为0.908∶1。全肝平扫后行增强扫描。对比剂为优维显(300 mgI/mL),总量按1.5 mL/kg体重计算。采用高压注射器经肘静脉注射,流率为3 mL/s,注入对比剂后28 s行动脉期扫描,65 s时行门脉期扫描,160 s时行平衡期扫描。超声引导穿刺活检凸阵穿刺探头频率为2~5 MHz,穿刺针采用美国CRbard射程可调式活检枪及18G切割针,针长20 cm,射程2.2 cm或1.5 cm。
1.4 图像分析
超声造影结果由2名有3年以上超声造影经验、不知晓病理结果的超声医生协商分析图像。将病灶增强程度与邻近肝组织比较,分为高增强、等增强、低增强及无增强。CT结果由1名有10年以上工作经验的医师读片。
2 结果
25例FLLs CT平扫结果提示18例为低密度病变,7例为等密度无异常病变;增强CT扫描结果提示动脉期6例低密度、19例等密度,均无阳性表现。超声造影结果与超声引导穿刺结果对比如下:超声造影显示8例动脉期呈高增强的病灶病理结果提示高分化HCC 5例和中分化HCC 3例;13例动脉期呈等增强的病灶病理结果提示不典型增生3例、高分化HCC 5例及增生结节5例;4例动脉期呈低增强的病变病理提示包括高分化HCC 1例、增生结节3例。门脉期及延迟期22例等增强的病灶病理结果提示高分化HCC 11例、不典型增生3例及增生结节8例,3例低增强的病灶病理结果提示中分化HCC。图1所示1例男性患者,45岁,慢性乙肝病史数年,其二维超声定期复查中发现一高回声病灶(图1A),后行增强CT扫描,动脉期为低密度结节(图1B),然后行超声造影检查,动脉期为高增强(图1C),实质期为低增强(图1D),然后进行超声引导穿刺,病理结果提示高分化HCC(图 1E)。
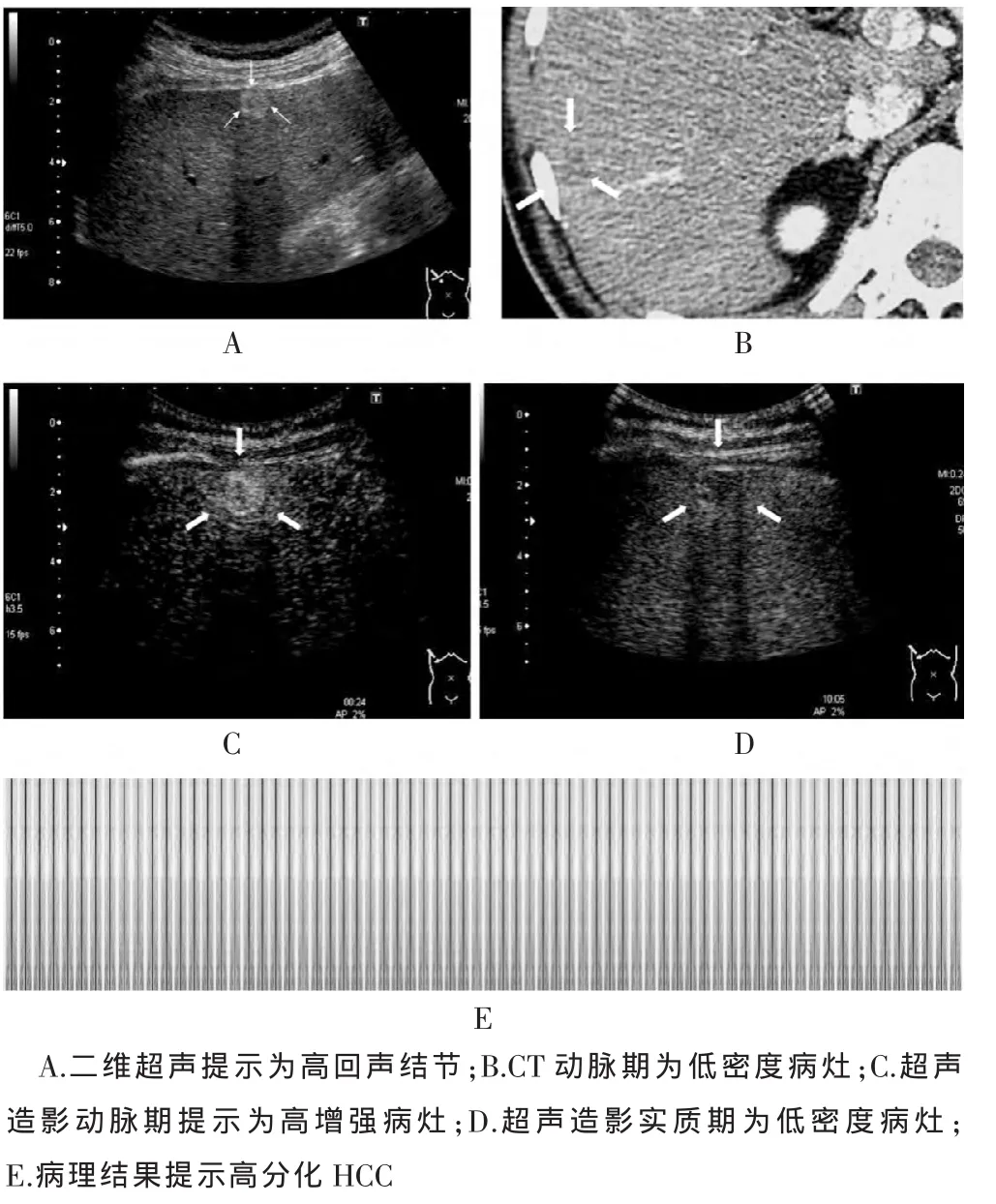
图1 1例患者二维超声、增强CT、超声造影及病理结果
3 讨论
随着超声造影剂和超声造影技术的迅速发展,超声造影在≤2 cm FLLs的诊断及鉴别诊断尤其是HCC的定期追踪观察、超声造影引导穿刺治疗、治疗后的反应评估及随访观察等方面,扮演越来越重要的角色[3]。超声造影动脉期高增强是HCC的典型表现,所有的8例动脉期高增强的病变被证实为HCC,即使它们在平扫及增强CT均无阳性表现,超声造影较增强CT在检测血流的敏感方面已经被报道过[4]。在CT上表现为乏血供的病变并不意味着就是一个乏血供的肿瘤。尤其是慢性肝炎基础上的FLLs,超声造影动脉期高增强可以省去了穿刺活检而直接诊断HCC。Bolondi等[4]报道没有一例恶性病变在CT及超声造影上都表现为乏血供的,然而最近的报道也只有4例HCC的病灶在动脉期表现为等增强或者低增强[5]。本研究统计结果中,有5例高分化HCC动脉期表现为等增强,1例表现为低增强,其频率高于其他的研究,虽然这也许是这组研究对象的一些特殊表现,但是提醒诊断医生在对那些慢性肝病基础上的FLLs即使动脉期乏血供也不能完全就排除恶性病变。
由于FLLs与周边肝实质细胞不同的血供,故恶性病变一般在增强CT的门脉期或者平衡期表现为消退征象,超声造影也采用同样的原理[5]。HCC典型表现为动脉期高增强,门脉期及延迟期消退。之前一些研究表明,延迟期等增强提示良性病变,因为与周围肝实质有表现为同等强度[6-8],在本组研究结果中,延迟期等增强并不能排除恶性病变,25例病变中3例门脉期及延迟期表现为低增强的病变病理结果皆提示为中分化HCC,10例门脉期及延迟期表现为等增强的病变病理结果提示高分化HCC,之前也有一些相同的报道[9-10]。对于这些不典型表现的恶性病变要依赖超声引导穿刺活检[11-12]。
超声造影技术可以与增强CT一样敏感地揭示FLLs的血流动力学改变,甚至对一些≤2 cm病变的血流改变更为敏感,能准确地鉴别和诊断不同的FLLs的性质。此外,凭借其实时显像和多切面显像的灵活特性、对于有肾功能损害和对碘过敏患者的安全无毒性、无辐射、可重复性及高时间分辨率,在评价肝肿瘤性病变的微血管灌注和引导介入治疗等多方面有独特的优越性,改变了传统理念中超声技术不能显示肿瘤微血管的看法,极大地拓展了超声造影技术在肝肿瘤尤其是HCC诊治中的临床应用。应用超声造影诊断和治疗HCC给在不同的疾病阶段的HCC患者提供了更多机会[3,13]。基于本研究结果以及其他研究报道,提示超声造影较增强CT更有利于检查肿瘤的多血管性。超声造影成为二维超声发现FLLs以后首选的确定肝占位病变的性质的重要检查方法。但是超声造影也有其局限性。超声检查是一个操作者依赖的过程,不同操作者之间的技术差别严重影响诊断结果。超声检查肝脏因其受肺气的干扰以及肋骨的遮挡,有其固定的扫查盲区。笔者在临床工作中也有在CT扫查提示阳性的病例,而在超声检查上无法显示,只是这些病例不在本文的描述范围之内,故在临床应用中,应将增强CT扫描与超声造影密切结合。在这组病例中还有一些不足的地方,如大部分因病变较小,即使是穿刺病理结果是HCC的,也没有选择手术治疗,所以所有的病理结果都是肝穿活检而不是手术病理,其病理结果只反映了肿瘤组织的小部分,不能避免误诊及漏诊那些没有取到的肿瘤部分。
总之,在慢性肝病基础上的FLLs,超声造影表现为动脉期富血供的FLLs是提示HCC的第一征象,门脉期低增强是HCC的另一个征象,然而从本研究结果来看,无论FLLs在CT上表现如何,尤其是≤2 cm的FLLs,即使超声造影动脉期表现为不增强,门脉期及实质期表现为不消退也不能排除恶性病变,在临床工作中必须密切观察或行超声引导穿刺活检早期发现恶性病变[14]。
[1]Bruix J,Sherman M.Management of hepatocellular carcinoma[J].Hepatology,2005,42(12):8-36.
[2]Tanaka H,Nouso K,Kobashi H,et al.Surveillance of hepatocellular carcinoma in patients with hepatitis C virus infection may improve patient survival[J].Liver Int,2006,26(5):43-51.
[3]Zheng SG,Xu HX,Liu LN.Management of hepatocellular carcinoma:theroleofcontrast-enhancedultrasoundWorld[J].Radiol,2014,6(1):7-14.
[4]Bolondi L,Gaiani S,Celli N,et al.Characterization of small nodules in cirrhosis by assessment of vascularity:the problem of hypovascular hepatocellular carcinoma[J].Hepatology,2005,4(2):27-34.
[5]Jang HJ,Kim TK,Burns PN,et al.Enhancement pattern of hepatocellular carcinoma at contrast-enhanced US:comparison with histologic differentiation[J].Radiology,2007,24(4):898-906.
[6]von Herbay A,Vogt C,Willers R,et al.Real-time imaging with the sonographic contrast agent SonoVue:differentiation between benign and malignant hepatic lesions[J].Ultrasound Med,2004,23(15):57-68.
[7]Dietrich CF,Ignee A,Trojan J,et al.Improved characterization of histologically proven livertumours by contrast enhanced ultrasonography during theportal venous and specific late phase of SHU 508A[J].Gut,2004,53(4):1-5.
[8]Bryant TH,Blomley MJ,Albrecht T,et al.Improved characterization of liver lesions with liver-phase uptake of liver-specific microbubbles:prospective multicenter study[J].Radiology,2004,23(2):799-809.
[9]Tanaka M,Nakashima O,Wada Y,et al.Pathomorphological study of Kuppfer cells in epatocellular carcinoma and hyperplastic nodular lesions in the liver[J].Hepatology,1996,24(8):7-12.
[10]Imai Y,Murakami T,Yoshida S,et al.Super paramagnetic iron oxide enhanced magnetic resonance images of hepatocellularcarcinoma:correlation with histological grading[J].Hepatology,2000,32(2):5-12.
[11]Caturelli E,Solmi L,Anti M,et al.Ultrasound guided fine needle biopsy for early hepatocellular carcinoma complicating liver cirrhosis:amulticenter study [J].Gut,2004,53(13):56-62.
[12]Durand F,Regimbeau JM,Belghiti J,et al.Assessment of the benefit and risk of percutaneous biopsy before surgical resection of hepatocellular carcinoma [J].Hepatol,2001,35(25):4-8.
[13]Ioan Sporea,Roxana Sirli.Is contrast enhanced ultrasound (CEUS)ready for use in daily practice for evaluation of focal liver lesions? [J].Med Ultrason,2014,16(1):37-40.
[14]陈敏华,严昆,戴莹,等.肝超声造影应用指南(中国)(2012 年修改版)[J].中华超声影像学杂志,2013,8(22):696-722.
