2011年夏季北极王湾细菌群落结构分析及浮游细菌丰度检测
2015-01-27乔宗赟曾胤新董培艳郑天凌
乔宗赟 曾胤新,2 董培艳 郑天凌
(1集美大学食品与生物工程学院,福建厦门361021;2国家海洋局极地科学重点实验室,中国极地研究中心,上海200136;3厦门大学生命科学学院,滨海湿地生态系统教育部重点实验室,福建厦门361005;4厦门大学近海海洋环境科学国家重点实验室,福建厦门361005)
0 引言
王湾位于北极斯匹次卑尔根群岛新奥尔松地区,是一个背靠冰川的开放峡湾。该海湾及其邻近海域是北冰洋水团和大西洋水团的交汇处,受海冰、大西洋暖水团以及北极冷水团的多重影响,对气候变化极为敏感。该区域已成为北极地区最主要的国际环境研究和监测站点之一[1]。近年来由于北极地区增温明显,导致夏季王湾附近冰川融冰加速,而北冰洋也呈现大西洋水比重增加的趋势。这些变化将影响王湾海域的水文状况,导致水温和盐度发生较大变化,进而影响到湾内整个生物群落结构[2]。
近十几年来,有关浮游细菌在海洋生态系统中的作用越来越受到人们重视。海洋中数量众多的浮游细菌(数量级在106-109cells·L-1),不仅是有机物质的分解者,也是有机颗粒的重要生产者,在营养盐和其他元素的再生中起着非常重要的作用。在一定海域,浮游细菌的群落结构相对稳定,其中的优势菌群在碳及其他元素的生物地球化学过程中起着关键作用[3]。 其中,玫瑰杆菌支系(Roseobacterclade)因其广泛分布于世界各地,具有高丰度及不同的生理多样性,相关研究业已成为海洋细菌研究中的热点之一[4]。该支系细菌在整个微生物群落中的占有比例可达25%[5]。在王湾,浮游细菌丰度在108-109cells·L-1,在原核生物群落中所占比例超过75%,相比之下,古菌仅占1%左右[6-7]。研究结果表明,α-变形菌、γ-变形菌及嗜纤维菌-曲挠杆菌-拟杆菌群(CFB)是王湾浮游细菌群落中的主要组成成分,湾内、外的浮游细菌群落在多样性组成上没有明显差异[7-9]。但我们对2011年王湾夏季样品的分析结果却显示出差异:海湾内、外的表层浮游细菌群落均以γ-变形菌及拟杆菌为主[10]。在王湾,以甲藻、绿藻及小型异养生物为主的原生生物群落在夏季期间保持相对稳定,但细菌群落则变化较大,这可能与冰川融水的输入存在关系[9]。季节、地区以及生态方面的差异,都会影响细菌的群落结构。
本文通过PCR-DGGE方法,对王湾表层海水及沉积物中的细菌群落结构进行比较,以检测该海湾不同地点细菌群落的组成情况。此外,采用实时荧光定量PCR方法对湾口、湾内的浮游细菌和玫瑰杆菌支系进行丰度检测,以了解夏季陆源性淡水输入对该海湾表层浮游细菌群落的影响。相关结果,对于我们进一步认识夏季期间环境变化对于王湾浮游细菌群落乃至整个海洋上层生态系统的影响,具有重要的参考意义。
1 材料与方法
1.1 材料
1.1.1 样品及菌种
2011年7月中国北极黄河站度夏考察期间,在王湾选取从湾口(Stn1)到湾内(Stn5)的5个站位采集表层水样1.5-2.1 L(图1,表1)。此外,在其中3个站位(Stn1、Stn3和Stn5)采集沉积物样品。海水样品经0.22μm孔径滤膜过滤。滤膜及沉积物样品冻存于-80℃并运回国内实验室开展DNA抽提。参考菌株Roseicitreum antarcticumZS2-28由中国极地研究中心俞勇先生提供。
1.1.2 主要试剂
DNA纯化通用试剂盒购自厦门鹭隆生物科技发展有限公司;UltraClean Soil DNA Isolation Kit购自MoBio公司;E.coliDH5α感受态细胞、TIAN pure Mini Plasmid Kit购自天根生化科技(北京)有限公司;pMD20-T载体、SYBR Premix Ex TaqⅡ购自TaKaRa公司。
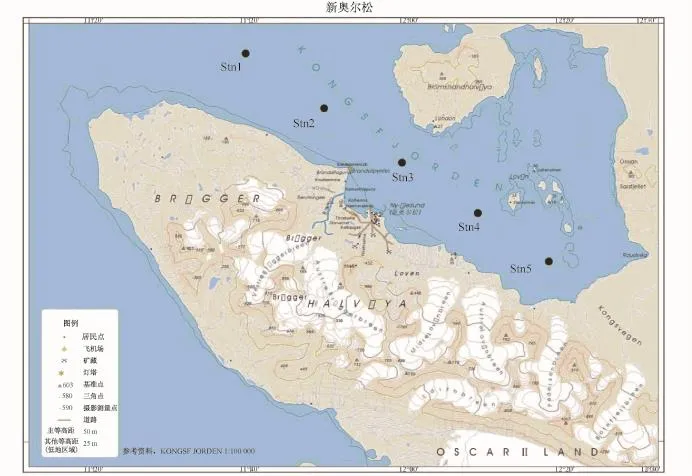
图1 王湾样品采集站位图Fig.1.Map of Kongsfjorden sampling station positions

表1 王湾采样站点环境参数及DGGE条带的丰富度、多样性指数及均匀度Table 1.Summary of seawater and sediment samples collected from Kongsfjorden(Svalbard)and their DGGE patterns.Samples Stn1 to Stn5 were collected from seawater, and samples S1, S3, and S5 were collected from sediment
1.1.3 仪器设备
Gel Doc凝胶影像分析系统(Bio-Rad);DGGE system(Bio-Rad);CFX96 Touch Real-Time PCR Detection Systems(Bio-Rad)。
1.2 方法
1.2.1 环境DNA的提取
滤膜上的样品经2 mL DNA提取缓冲液(Tris 50 mmol,EDTA 50 mmol,NaCl100 mmol,pH 8.0)冲洗、回收后,总DNA的提取参照文献方法[11-12]进行。提取的总DNA溶解于30μL TE中,-20℃保存备用。沉积物样品中的环境总DNA的提取采用MoBio公司的DNA提取试剂盒、参照产品说明书进行。细菌Roseicitreum antarcticumZS2-28的基因组提取则采用DNA纯化通用试剂盒进行。
1.2.2 16S rDNA片段扩增
以2μL经适当稀释的环境DNA(10-100 ng)为模板,采用引物 Eubac 27F和Eubac1492R[13]扩增细菌16S rDNA片段。PCR反应体系包括引物(10 μmol·L-1)各 1 μL,dNTPs(10 mmol· L-1)1 μL,Taq DNA聚合酶(2.5 U·μL-1)0.5 μL,10×PCR缓冲液5 μL,BSA(1 mg·mL-1)2 μL,补充双蒸水定容至50μL。PCR反应条件为94℃,5 min;(94℃,1 min;55℃,1 min;72℃,2 min)×30次循环;72℃延伸8 min。1%琼脂糖凝胶电泳检测扩增结果。引物合成由上海生工生物工程技术服务有限公司完成。
1.2.3 16S rDNA-V3高变区扩增
为比较直接PCR与巢式PCR对实验结果的影响,分别以2μL环境DNA和上述16S rDNA扩增产物为模板(约50ng),采用引物341F(前端加有GC钳)与534R对细菌16S rDNA片段中的V3高变区进行扩增[14]。PCR反应体系包括引物(10μmol·L-1)各 0.5 μL,dNTPs(10 mmol·L-1)0.8 μL,Taq DNA聚合酶(2.5 U·μL-1)1μL,10×PCR缓冲液5 μL,BSA(1 mg·mL-1)4 μL,补充双蒸水定容至50μL。 反应条件参考文献[8]进行。
1.2.4 变性梯度凝胶电泳(DGGE)及图谱分析
参照文献[8],采用40%-60%变性梯度对 V3区的PCR产物进行凝胶电泳,并经EB染色后,将凝胶置于Gel Doc凝胶影像分析系统(Bio-Rad)中进行拍照及保存。DGGE电泳图谱采用Quantity One处理。用BandScan4.3对DGGE指纹图谱中每个条带的灰度进行分析,计算多样性指数(H)、物种丰度(S)和均匀度(EH)。
1.2.5 优势条带序列测定及系统发育树构建
将优势DGGE条带切割回收,置于Eppendorf管中,加入50μL ddH2O,4℃过夜。12 000 rpm离心10 min。取20μL上清液作为PCR模板,按照16S rDNA-V3高变区扩增的反应体系和反应条件进行PCR扩增。扩增产物经DNA纯化通用试剂盒纯化回收后,与载体 pMD20-T连接,再转入E.coliDH5α感受态细胞。序列测定由上海美季生物技术有限公司完成。所测得的序列采用DNAMAN软件进行拼接,并利用 Blastn工具在 NCBI数据库(http://blast.ncbi.nlm.nih.gov)和模式菌种库Eztaxon sever(http://147.47.212.35:8080/)中进行比对以获得亲缘序列。利用Mega5.05构建系统发育树。28条序列已登录GenBank数据库(序列号:JX110669、JQ945201、JX110671、JQ945202、JX110672、JQ945203-JQ945206、 JX110675、 JQ945207、 JX110676-JX110678、JX041254、 JX110680、 JQ945208-JQ945211、JX110681-JX110684、JQ945213、 JX110686、 JQ945214、JQ945215)。
1.2.6 标准品与标准曲线的制备
含细菌16SrDNA-V3高变区质粒的制备:用TIAN pure Mini Plasmid Kit质粒提取试剂盒对上述测序菌液进行质粒提取。质粒起始拷贝数计算公式:

含玫瑰杆菌特异性片段质粒的制备:以Roseicitreum antarcticumZS2-28总DNA(10-100 ng)为模板,采用玫瑰杆菌特异性引物391F和536R[15]各0.5 μL(10 μmol·L-1),dNTPs(10 mmol·L-1)2 μL,Taq DNA聚合酶(2.5 U·μL-1)0.5 μL,10×PCR缓冲液2.5μL,加ddH2O定容至25μL。PCR反应条件:94℃,3 min;(94℃,30 s;58℃,30 s;72℃,1 min)×30次循环;72℃延伸5 min。PCR产物参照前面纯化及克隆步骤,转化入E.coliDH5α中并测序验证。验证通过后进行质粒制备及质粒拷贝数的计算。
分别对上述两种质粒进行10倍梯度稀释,开展5 个稀释梯度(107、106、105、104、103)的荧光定量PCR并制作相应的标准曲线。
1.2.7 实时荧光定量PCR(QPCR)
以湾口(Stn1)和湾底(Stn5)站位的总DNA为模板,采用SYBR Premix Ex TaqⅡ(2×)荧光扩增体系,分别扩增细菌16S rDNA-V3高变区和玫瑰杆菌特异性片段。每个样品做3个生物重复和3个技术重复,并用无菌水代替模板作阴性对照,反应体系为:SYBR Premix Ex TaqⅡ(2×)12.5 μL,引物(10 μmol·L-1)各1 μL,DNA 2 μL,ddH2O 8.5 μL。细菌16S rDNA-V3高变区的反应条件为:95℃,3 min;95℃,15 s;60℃,1 min(后面两步反应进行35次循环)。玫瑰杆菌特异性片段的反应条件为:95℃,3min;95℃,15 s;65℃,1 min(后两步反应进行40次循环)。反应结束后进入Bio-Rad CFX Manager分析界面,系统自动得出目的基因的平均Ct值和溶解曲线。通过上面的标准曲线可确定目的基因的拷贝数。
2 结果
2.1 直接PCR与巢式PCR对16S rDNA-V3高变区的扩增比较
结果显示,以16S rDNA扩增产物为模板的巢式PCR,其扩增产物相对于以环境DNA为模板的直接PCR而言,目标条带(200bp左右)更为锐利、明亮,更适合于后续DGGE分析所需。这一情况与我们对白令海北部沉积物细菌群落的分析结果相似[16]。
2.2 基于DGGE图谱的细菌群落组成分析
王湾表层水体及沉积物细菌群落组成的DGGE指纹图谱(图2)显示:海水细菌群落与沉积物细菌群落存在较明显的差异;在不同站位的海水或沉积物样品中,部分DGGE条带出现在相同的位置(如条带8、条带20所处位置),表明在该海域的海水或沉积物中普遍存在着一些优势的细菌系统发育型;此外,这些处于相同电泳位置的条带,在不同样品中的浓淡程度存在差别,表明其DNA浓度存在差别。而DNA浓度的差别,可能来源于相关细菌丰度的差别。
对DGGE图谱进行聚类分析,结果(图3)显示:来自湾口及海湾中间位置的沉积物样品(S1、S3)独立于其他样品、聚为一簇,显示出其细菌群落组成与其他样品的较大差异性;位于海湾最里面的沉积物样品S5则与表层水样聚集成一个大簇,反映出该站位的沉积物细菌群落与浮游细菌群落的相似性程度高。此外,在表层浮游细菌群落中,位于湾口附近的站位(Stn1、Stn2)相互间的相似性更高,与湾内的3个站位分别聚为2个簇。
利用相关软件对DGGE条带进行遗传多样性的统计学分析,结果(表1)显示,沉积物细菌群落的丰富度及多样性指数,都高于浮游细菌群落,表明沉积物中的细菌群落组成相比浮游细菌更为丰富、多样。从湾口到湾内,细菌群落的多样性指数、均匀度基本上都呈现出递增趋势。
2.3 基于DGGE条带的细菌多样性分析
DGGE对环境中微生物的数量有一定要求,能够在DGGE图谱上显现出来的条带,代表的通常是在样品中具有优势地位的细菌菌群[17]。对28条DGGE条带的测序结果表明(图2),18条来自水样的序列分别属于α-变形细菌(Alphaproteobacteria)、γ-变形细菌(Gammaproteobacteria)、放线菌(Actinobacteria)、拟杆菌(Bacteroidetes)及厚壁菌(Firmicutes)等5大类群;10条来自沉积物的序列则包括了 α-变形细菌、γ-变形细菌、δ-变形细菌(Deltaproteobacteria)、拟杆菌及厚壁菌等5大类群。其中,拟杆菌、α-变形细菌、γ-变形细菌分别占水样总序列数的38%、22%及22%。

图2 王湾海域表层海水及沉积物细菌群落组成的DGGE指纹图谱.带数字标记的条带表示已被回收、测序,Stn1-Stn5为表层海水样品;S1、S3及 S5为沉积物样品Fig.2.Denaturing gradient gel electrophoresis(DGGE)fingerprint of bacterial communications in surface water and sediment samples collected in Kongsfjorden,Svalbard.Bands indicated by numberwere excised for sequencing.Samples Stn1 to Stn5 were collected from seawater,and samples S1,S3 and S5 were collected from sediment

图3 王湾海域表层海水及沉积物细菌群落组成DGGE指纹图谱的聚类分析.Stn1-Stn5为表层海水样品,S1、S3及S5为沉积物样品Fig.3.Cluster analysis of DGGE patterns of bacterial communications in surface water and sediment samples collected in Kongsfjorden,Svalbard.Samples Stn1 to Stn5 were collected from seawater, and samples S1, S3 and S5 were collected from sediment
序列比对结果显示,分别有1条水体DGGE条带(条带4)、5条沉积物 DGGE条带(条带7、9、20、24及27)与模式菌种库Eztaxon sever中参考菌株的序列相似性在84%-96%,表明这些序列来自尚未被报道的细菌新种属。DGGE条带及其亲缘序列的系统发育树(图4)也显示,这5条序列与亲缘序列均具有较远的遗传进化距离。结果同时也表明,在沉积物中找到新颖细菌的可能性比海水更高。
2.4 浮游细菌和红细菌的丰度
应用实时荧光定量PCR方法、分别对湾口Stn1及湾内Stn5表层海水中的总细菌和玫瑰杆菌的丰度进行了检测。16S rDNA-V3区扩增曲线显示,阴性对照无扩增,表明样品未受到污染;溶解曲线出现单一锐利的峰,说明引物特异性好,不存在非特异性扩增。Stn1和Stn5的扩增效率分别为94.7%和97.4%,决定系数R2分别为0.999和1.000,说明反应已达到最优,斜率分别为-3.456和-3.385,数据理想,可用于后续分析。通过质粒标准曲线,推算得到Stn1和Stn5的总细菌丰度分别为(7.7-8.1)×108cells·L-1和(8.1-8.4) ×108cells·L-1。
同样,针对玫瑰杆菌的 Stn1和 Stn5站位的QPCR扩增曲线、溶解曲线显示,测试样品未受污染;所用引物的特异性好、扩增效率达106%,决定系数R2为0.999,斜率为-3.186,数据理想。通过质粒标准曲线,推算得到湾口Stn1和湾内Stn5浮游玫瑰杆菌的丰度分别为9.4×104cells·L-1和(6.0-6.7) ×104cells·L-1。

图4 王湾表层水体及沉积物样品中细菌16S rDNA序列的系统发育树图Fig.4.Phylogenetic tree showing the affiliation of16S rDNA sequences from surface water and sediment samples collected in Kongsfjorden(Svalbard)with selected sequences in GenBank database
3 讨论
本文利用PCR-DGGE方法检测了北极王湾表层海水及沉积物中的细菌群落组成。结果显示,拟杆菌(38%)、α-变形细菌(22%)及 γ-变形细菌(22%)在表层水样的DGGE条带中占优势地位。这与我们对该海域2007年采集样品的DGGE分析结果[8]较为相似:α-变形细菌、γ-变形细菌及拟杆菌均以22%的比例在表层水体的DGGE图谱中占据优势。但是,与2007年样品中检测到α-变形细菌、γ-变形细菌、ε-变形细菌、拟杆菌、放线菌、厚壁菌以及蓝细菌(包括微藻叶绿体)等7个大类相比,本次研究并未在表层水样中检测到ε-变形细菌与蓝细菌/叶绿体,显示在门水平上的多样性更低。我们基于454高通量测序方法对本次样品的分析结果也显示[10],γ-变形细菌、拟杆菌在表层浮游细菌群落中占据绝对优势,而营光合作用的蓝细菌(包括微藻叶绿体)基本上未被检测到。拟杆菌门中的成员能够降解海洋中的多聚物,包括藻类来源的有机物[18-19]。与2007年夏季样品相比,2011年夏季王湾浮游细菌群落出现了明显变化:异养型的拟杆菌所占比例更高、而自养型的蓝细菌/微藻所占比例下降显著。究其原因,可能与该地区冰川淡水的输入及浮游植物的水华进程有关[9]。而2007年、2011年夏季王湾浮游细菌群落组成的差异,是否反映了近年来全球气候变化对北极近岸海洋生态群落结构的影响,还需要更多研究数据的收集与分析才能得到更确切的答案。
通常情况下,来源于同一环境中的不同样品,如果在DGGE图谱的同一电泳位置存在相似条带,那么这些条带会被认为属于同一系统发育型。在本次研究中,处于相同电泳位置的水样 DGGE条带Band-12(Stn4)、Band-13(Stn5)都与模式菌Algibacter lectusKMM 3902具有亲缘关系。此外,处于相同位置的水样条带Band-21(Stn3)、Band-22(Stn4)及Band-23(Stn5)都与Loktanella salsilacusLMG21507关系密切。但同时,在DGGE图谱上具有相似迁移位置的条带也可能具有不同的序列[20]。在本次研究中,水样条带 Band-2(Stn3)的亲缘序列来自Krokinobacter eikastusPMA-26,而处于同一电泳位置的Band-3(Stn5)则与Algibacter lectusKMM3902关系密切。在沉积物样品中,也存在类似情况:处于相同位置的 Band-14(S1)、Band-15(S3)及 Band-16(S5)分别与Salmonella entericasubsp.salamaeDSM9220、Thalassobacter arenaeGA2-M15 及Pseudomonas plecoglossicidaFPC951关系密切。另一方面,处于DGGE图谱不同位置的条带却可能属于同一系统发育型:如水样条带 Band-2与 Band-5、以及Band-12/Band-13,虽然处于不同的电泳位置(图2),但亲缘关系最近的参考菌株都是Algibacter lectusKMM3902(图4)。因此,基于其自身的局限性,PCR-DGGE方法在微生物群落组成研究中更适合于不同环境之间微生物群落结构多样性的比较、以及同一环境中微生物群落结构多样性变化的动态跟踪[21]。在本次研究中,PCR-DGGE方法主要被用于王湾不同采样站点表层海水及沉积物中细菌群落结构的比较。
DGGE图谱的聚类分析结果显示(图3),所有样品被聚类为2个大簇:沉积物S1/S3簇、海水-沉积物S5簇。站位Stn1、Stn3水深皆超过200 m(表1),因此这两个站位的沉积物样品S1与S3受表层海水、尤其是夏季冰川融水的影响小,它们主要是受外来大西洋水体的影响[22]。位于湾内最里处的站位Stn5水深仅40 m左右,附近有多条冰川,因此其沉积物样品S5受表层水体的影响非常大,这就解释了为何沉积物S5中的细菌群落组成与表层浮游细菌群落的相似程度更高。而在海水-沉积物S5这一个大簇中,位于湾口位置的站位(Stn1、Stn2)又形成了一个独立于湾内站位(Stn4、Stn5及S5)的小簇,表明湾内、湾口的浮游细菌群落受周围环境、尤其是陆源性淡水输入的影响,其组成存在一定的差异。
基于实时荧光定量PCR方法的检测结果表明,王湾湾口(Stn1)、湾内(Stn5)的浮游细菌丰度相近,数量级在108cell·L-1,与文献报道的数量级一致[23]。但浮游玫瑰杆菌的丰度分布却显示出差异:湾口的玫瑰杆菌丰度高于湾内。玫瑰杆菌支系属于α-变形细菌,是全球大洋中分布最广泛的细菌类群之一,其中的Loktanella、Sulfitobacter等属成员,很多是含有pufM基因的好氧不产氧光合细菌[24],或者具有DMSP(二甲基琉基丙酸内盐)裂解酶基因[25],因此该支系细菌在海洋上层生态系统的碳、硫循环中扮演着重要角色。尽管本次研究中检测到的玫瑰杆菌在浮游细菌中所占比例极低(仅0.01%左右),但在4条属于α-变形细菌的水样DGGE条带中有3条(Band-19、21、23)属于Loktanella或Sulfitobacter属,表明玫瑰杆菌可能在王湾生态系统中具有重要的生态学功能。在海洋环境中,低丰度的微生物类群虽然数量少、但却可能具有高生长速率并在当地生态系统中发挥着重要的生态功能[26]。此外,根据海洋细菌的“种子银行”学说[27],对于玫瑰杆菌支系这类在全球海洋中广泛分布的细菌类群而言,其丰度可随环境条件的变化而发生变化,一旦环境条件适宜,它们可由细菌群落组成中的稀有成分转变成为优势成分。盐度数据(表1)证实湾内表层海水受冰川融水等陆地淡水输入的影响明显。结合DGGE图谱及细菌丰度数据,本次研究的分析结果表明,王湾内、外的浮游细菌群落受陆地淡水输入的影响明显,虽然细菌总体数量差异不大,但某些具有特定生态功能的类群(如玫瑰杆菌)的数量分布出现较大差异,并且群落结构组成也出现差异。
致谢感谢国家海洋局第二海洋研究所金海燕研究员提供海水温、盐及营养盐数据。
1 Hop H, Pearson T, Hegseth E N, et al.Themarine ecosystem of Kongsfjorden, Svalbard.Polar Research,2002,21(1):167-208.
2 Beuchel F,Gulliksen B,CarrollM L.Long-term patternsof rocky bottom macrobenthic community structure in an Arctic fjord(Kongsfjorden,Svalbard)in relation to climate variability(1980-2003).Journal of Marine Systems, 2006, 63(1-2):35-48.
3 Cottrell M T,Kirchman D L.Community composition ofmarine bacterioplankton determined by 16S rRNA gene clone libraries and fluorescence in situ hybridization.Applied and Environmental Microbiology,2000, 66(12):5116-5122.
4 Brinkhoff T, Giebel H A, Simon M.Diversity, ecology and genomics of the Roseobacter clade:a short overview.Archives of Microbiology, 2008,189(6):531-539.
5 Selje N,Simon M,Brinkhoff T.A newly discovered Roseobacter cluster in temperate and polar oceans.Nature,2004,427(6973):445-448.
6 Iversen K R,Seuthe L.Seasonalmicrobial processes in a high-latitude fjord(Kongsfjorden,Svalbard):Ⅰ.Heterotrophic bacteria,picoplankton and nanoflagellates.Polar Biology, 2011, 34(5):731-749.
7 De Corte D,Sintes E,Yokokawa T,et al.Comparison between MICRO-CARD-FISH and 16S rRNA gene clone libraries to assess the active versus total bacterial community in the coastal Arctic.Environmental Microbiology Reports, 2013, 5(2):272-281.
8 Zeng Y X,Zheng T L,Li H R.Community composition of themarine bacterioplankton in Kongsfjorden(Spitsbergen)as revealed by 16S rRNA gene analysis.Polar Biology, 2009, 32(10):1447-1460.
9 Piquet AM T,Scheepens JF,Bolhuis H,et al.Variability of protistan and bacterial communities in two Arctic fjords(Spitsbergen).Polar Biology, 2010, 33(11):1521-1536.
10 Zeng Y X,Zhang F,He JF,et al.Bacterioplankton community structure in the Arctic waters as revealed by pyrosequencing of16S rRNA genes.Antonie van Leeuwenhoek,2013,103(6):1309-1319.
11 Bosshard PP,Santini Y,Gruter DG,etal.Bacterial diversity and community composition in the chemocline of themeromictic alpine Lake Cadagno as revealed by 16S rDNA analysis.FEMSMicrobiology Ecology, 2000, 31(2):173-182.
12 Bano N,Hollibaugh JT.Diversity and distribution of DNA sequences with affinity to ammonia-oxidizing bacteria of theβsubdivision of the class Proteobacteria in the Arctic Ocean.Applied and Environmental Microbiology, 2000, 66(5):1960-1969.
13 Delong E F.Archaea in coastalmarine environments.Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(12):5685-5689.
14 Muyzer G,deWaal E C,Uitterlinden A G.Profiling of complexmicrobial populations by denaturing gradientgel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA.Applied and Environmental Microbiology, 1993, 59(3):695-700.
15 Bräuer SL, Adams C, Kranzler K, etal.Culturable Rhodobacter and Shewanella species are abundant in estuarine turbiditymaxima of the Columbia River.Environmental Microbiology, 2011, 13(3):589-603.
16 Zeng Y X,Zou Y,Chen B,etal.Phylogenetic diversity of sedimentbacteria in the northern Bering Sea.Polar Biology,2011,34(6):907-919.
17 Muyzer G.DGGE/TGGE:amethod for identifying genes from natural ecosystems.Current Opinion in Microbiology, 1999, 2(3):317-322.
18 González JM, Fernández-Gómez B, Fernàndez-Guerra A, et al.Genome analysis of the proteorhodopsin-containingmarine bacterium Polaribacter sp.MED 152(Flavobacteria).Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(25):8724-8729.
19 Teeling H,Fuchs BM,Becher D,etal.Substrate-controlled succession ofmarine bacterioplankton populations induced by a phytoplankton bloom.Science, 2012, 336(6081):608-611.
20 Nicolaisen M H,Ramsing N B.Denaturing gradient gel electrophoresis(DGGE)approaches to study the diversity of ammonia-oxidizing bacteria.Journal of Microbiological Methods, 2002, 50(2):189-203.
21 车玉伶,王慧,胡洪营,等.微生物群落结构和多样性解析技术研究进展.生态环境,2005,14(1):127-133.
22 Svendsen H,Beszczynska-Moller A,Hagen JQ,et al.The physical environment of Kongsfjorden-Krossfjorden,an Arctic fjord system in Svalbard.Polar Research,2002,21(1):133-166.
23 Jiang X D, He JF, CaiM H.Abundance and biomass of heterotrophicmicrobes in the Kongsfjorden, Svalbard.Acta Oceanologica Sinica, 2005,24(6):143-152.
24 Boeuf D,Cottrell M T,Kirchman D L,et al.Summer community structure of aerobic anoxygenic phototrophic bacteria in the western Arctic Ocean.FEMSMicrobiology Ecology, 2013,85(3):417-432.
25 Johnston AW B,Todd JD,Sun L,etal.Molecular diversity of bacterial production of the climate-changing gas,dimethyl sulphide,amolecule that impinges on local and global symbioses.Journal of Experimental Botany, 2008, 59(5):1059-1067.
26 Campbell B J,Yu L Y,Heidelberg JF,etal.Activity ofabundantand rarebacteria in a coastalocean.Proceedingsof the National Academy of Sciences of the United States of America, 2011, 108(31):12776-12781.
27 Pedrós-AlióC.Marinemicrobial diversity:can it be determined? Trends in Microbiology, 2006, 14(6):257-263.
