基质金属蛋白酶和细胞因子在多关节型JIA中的临床意义
2015-01-26刘小惠
刘小惠
(江西省儿童医院风湿免疫科,南昌 330006)
基质金属蛋白酶和细胞因子在多关节型JIA中的临床意义
刘小惠
(江西省儿童医院风湿免疫科,南昌 330006)
目的探讨多关节型幼年特发性关节炎(JIA)患儿血清和关节液中基质金属蛋白酶和细胞因子的表达差异及其临床意义。方法ELISA法检测58例患儿成对血清和关节液中 MMP-1、MMP-3、TIMP-1,IL-1、IL-6和 TNF-α的表达水平,并分析其相关性。回顾分析病历记录并建立临床和实验室疾病活动性适应证判定标准,探讨这些因子的水平和疾病活动性指标之间的关系。结果JIA组血清和关节液中 MMP-1、MMP-3、IL-1、IL-6、TNF-α浓度明显高于对照组(P<0.01),TIMP-1浓度低于对照组(P<0.05),关节液中 MMP-1、MMP-3、TIMP-1、IL-1、IL-6、TNF-α浓度明显高于血清浓度(P<0.01)。JIA 组关节液中IL-1与MMP-1呈正相关,而IL-1与TIMP-1之间呈负相关。结论JIA的部分作用机制可能是通过刺激基质金属蛋白酶和细胞因子表达实现。
基质金属蛋白酶类;细胞因子;白细胞介素;幼年特发性关节炎;多关节
国际风湿病联盟于2001年将发生于16岁以下青少年的不明原因关节肿胀并持续6周以上的关节炎统一命名为幼年特发性关节炎(juvenile idiopathic arthritis,JIA),取代了以往的幼年类风湿关节炎和幼年慢性关节炎分类标准[1-3]。JIA是一组原因未明的慢性自身免疫性疾病,病程持久,常累及多个器官,可导致儿童残疾和失明[4]。JIA通常有全身型、少关节型和多关节型等多种亚型,其中的多关节型具有致残率高和预后差等特点[5-6]。根据血液中是否存在自身抗体-类风湿因子(RF),又可以将多关节型JIA分为两型:RF阴性和RF阳性。JIA的发病机制尚不明确,一般认为是个体遗传易感性、环境因素和免疫功能紊乱共同作用的结果。在JIA的发生、发展过程中,持续存在免疫炎症反应,涉及多种免疫细胞和炎症因子,如白细胞介素(IL)、肿瘤坏死因子α(TNF-α)和基质金属蛋白酶(MMP)等[7-9],它们形成一个信号网络,通过参与免疫细胞增殖活化和基质细胞分泌等生物学过程直接或间接影响疾病的进程。本研究选取了2013年3月至2014年3月本院收治的58例多关节型JIA患儿,检测患儿血清和关节液中细胞因子和MMP的水平,分析它们之间的相关性,探讨其在JIA疾病活动中的作用和临床意义,为JIA的机制研究提供有益的参考,也为临床上寻找新的药物和治疗方法提供理论依据。
1 资料与方法
1.1 一般资料 2013年3月至2014年3月本院收治的58例多关节型JIA患儿,诊断分型符合ILAR Durban关于JIA的分类诊断标准。根据临床体征、实验室和辅助检查,排除肿瘤、急性感染、全身型JIA和其他风湿性疾病。58例患儿中,男22例,女36例,年龄3.9~14.6岁,平均(5.3±1.1)岁;病程8~65个月,平均(16±7)个月;活动期至少有5个关节受累,同时伴有关节肿痛、局部发热或关节活动受限等表现。对照组收集本院同期收治的外伤关节炎儿童志愿者的血清和关节液46例,年龄、性别与JIA组差异无统计学意义(P>0.05)。本研究经本院学术伦理委员会讨论通过,患儿家长均签署了知情同意书。
1.2 研究方法
1.2.1 疾病活动度分析 回顾分析患者病例记录,建立临床和实验室疾病活动度指标。活动关节数(active joint count,AJC),红细胞沉降率(erythrocyte sedimention rate,ESR),C反应蛋白(C reactive protein,CRP),血小板计数(platelet count,PLT),中性粒细胞计数(neutrophil count,NEC),白细胞计数(white cell count,WCC)。记录了每一个采样点的治疗方法,包括非甾体类抗炎药物治疗和抗风湿药物治疗。
1.2.2 样品采集 空腹抽取患儿外周静脉血2~5mL于抗凝管中,离心后取上清液,-40℃保存待检。同批检测ESR、CRP、PLT、NEC、WCC等指标。采集关节腔积液时,先对患儿进行局部麻醉,然后采用膝关节髌上囊穿刺,抽取关节液于干燥管中,离心后取上清液,-40℃保存待检。
1.2.3 ELISA法检测 采用ELISA检测血清和关节液中MMP-1、MMP-3、TIMP-1,IL-1、IL-6和 TNF-α的表达水平。商业化的试剂盒均购自Elabscience,线性范围5~50ng/mL。MMP-1和 TIMP-1的捕获抗体水平分别为2g/mL 和5g/mL,而 MMP-3的检测限是12.5ng/mL。用于检测 MMP的ELISA方法也可以识别 MMP前体和 MMP-TIMP-1复合物。所有样品在同一时间点测定,具体操作步骤严格参照试剂盒的说明书进行。设定重复试验,变异系数小于12%。
1.3 统计学处理 采用SPSS13.0软件进行统计学分析。计量资料以±s表示,进行t检验;计数资料进行χ2检验。检验水准α=0.05。相关性分析采用Pearson回归。P<0.05为差异有统计学意义。
2 结 果
2.1 常规检查结果 MMP-1与MMP-3与AJC有相关性,而与其他指标无显著相关性;炎性因子IL-1、IL-6和 TNF-α与AJC、CRP、ESR、PLT、NEC、WCC之间都存在一定的相关性。见表1。
2.2 ELISA浓度测定 JIA组血清和关节液中 MMP-1、MMP-3、IL-1、IL-6、TNF-α浓度明显高于对照组(P<0.01),TIMP-1浓度低于对照组(P<0.05),关节液中 MMP-1、MMP-3、TIMP-1、IL-1、IL-6、TNF-α浓 度 明 显 高 于 血 清 浓 度 (P<0.01)。见表2、3。
2.3 JIA组关节液中IL-1与 MMP-1和 TIMP-1的相关性分析 IL-1与 MMP-1呈正相关,而IL-1与 TIMP-1之间呈负相关。见表4。
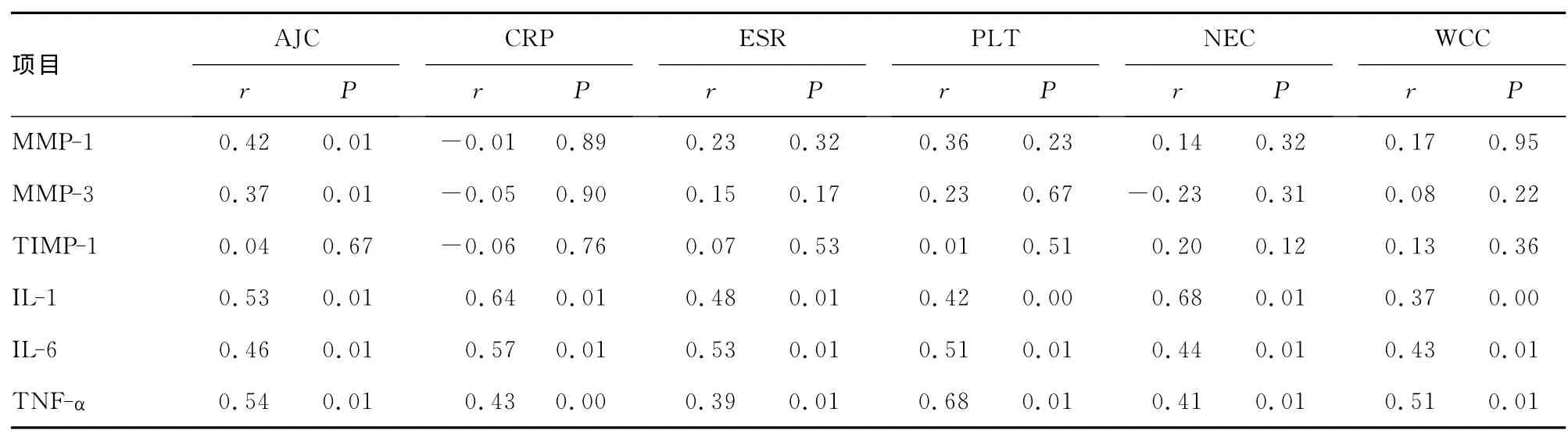
表1 MMP和细胞因子与常规检查指标间相关性分析
2.4 MMP∶TIMP分析 如图1所示,由相对分子质量为59×103的pro-MMP-3和52×103的pro-MMP-1及28×103的TIMP-1计算而来。关节液中的 MMP高于TIMP-1,而在血清中则相反。
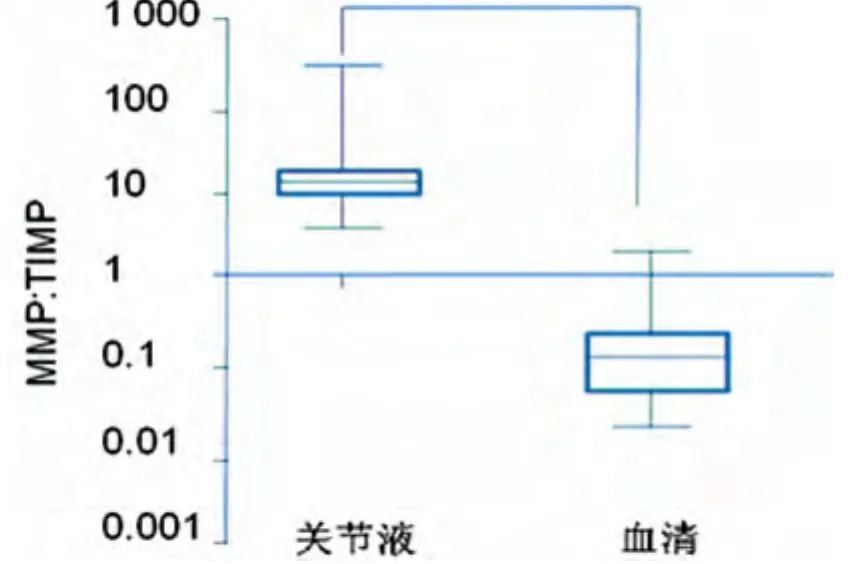
图1 MMP∶TIMP-1在JIA患者关节液与血清中的测定
表2 两组关节液和血清中 MMP-1、MMP-3和TIMP-1的水平比较( ±s)

表2 两组关节液和血清中 MMP-1、MMP-3和TIMP-1的水平比较( ±s)
项目 JIA组(n=58) 对照组(n=46)MMP-1(g/mL)关节液 0.46±0.19 0.15±0.06血清 0.07±0.01 0.04±0.01 MMP-3(g/mL)关节液 83.16±37.22 16.42±10.03血清 0.68±0.41 0.33±0.14 TIMP-1(g/mL)关节液 4.64±2.15 5.08±3.12血清0.78±0.36 0.84±0.29
表3 两组关节液和血清中IL-1、IL-6和 TNF-α的水平比较( ±s)
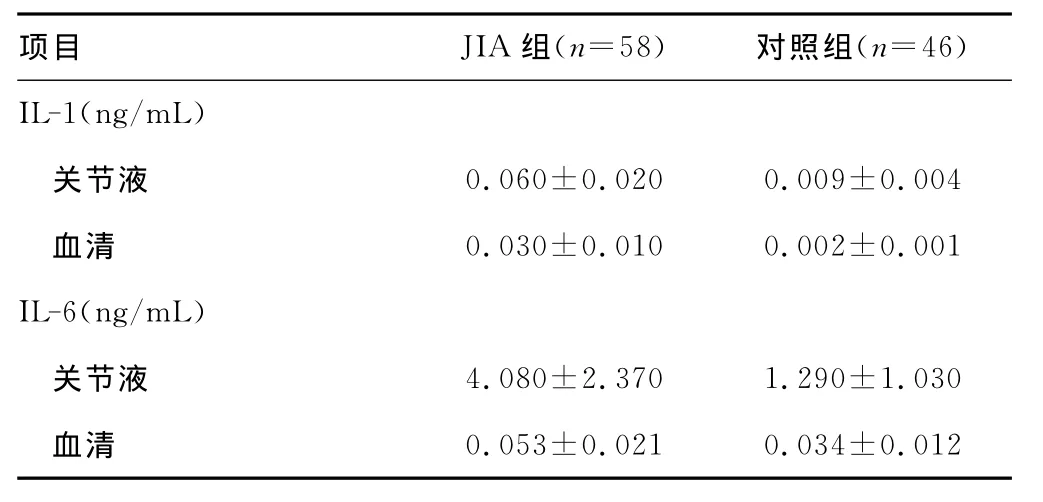
表3 两组关节液和血清中IL-1、IL-6和 TNF-α的水平比较( ±s)
项目 JIA组(n=58) 对照组(n=46)IL-1(ng/mL)关节液 0.060±0.020 0.009±0.004血清 0.030±0.010 0.002±0.001 IL-6(ng/mL)关节液 4.080±2.370 1.290±1.030血清0.053±0.021 0.034±0.012
续表3 两组关节液和血清中IL-1、IL-6和TNF-α的水平比较( ±s)

续表3 两组关节液和血清中IL-1、IL-6和TNF-α的水平比较( ±s)
项目 JIA组(n=58) 对照组(n=46)TNF-α(ng/mL)关节液 0.046±0.017 0.013±0.005血清0.028±0.011 0.010±0.006

表4 JIA组关节液中IL-1与 MMP-1和TIMP-1相关性分析
3 讨 论
JIA是儿童时期常见的自身免疫病,该疾病发病机制仍有待研究。MMP由于其能够分解Ⅱ型胶原蛋白,被认为在该疾病中起到重要作用[10-11]。MMP由正常组织或肿瘤细胞合成,需要Ca2+、Zn2+等金属离子作为辅助因子,可降解多种细胞外基质成分。目前研究认为在26种MMP中,与骨关节炎软骨降解关系最为密切的为MMP-1与 MMP-3。关节的损伤是不可逆的,JIA中Ⅱ型胶原蛋白的损伤导致关节生长面的损伤,该损伤为JIA的特征之一。大部分JIA患者关节液中可检出MMP-1,且与PLT密切相关,提示MMP在JIA中与炎症具有一定相关性。本研究结果表明JIA患者血清中 MMP-1与MMP-3的浓度非常低,检出困难,而 MMP-1和 MMP-3在JIA患者关节液中浓度较高,同时,一些炎性因子在血清中检出浓度较高,提示MMP无法作为血清中JIA的检验标志物,但血清中炎症因子的高表达可以提示JIA疾病的发生。
文献报道,MMP-3能够降解蛋白多糖,而更为重要的是,它能 够 激 活 其 他 pro-MMP,包 括 MMP-1[12]。 本 研 究 中,MMP-3在关节液中浓度达83.16ng/mL,提示 MMP-3可能激活其他MMP,形成正反馈,从而极大地恶化JIA疾病进程。
TIMP-1作为 MMP-3的特异性 抑制因子[13-14],在生理 状态下,MMP∶TIMP-1处于一种平衡状态,有文献报道,TIMP-1的水平的升高和MMP的生成量的增长一致。但病理条件下,该动态平衡被打破,TIMP-1的水平低于 MMP的生成,甚至TIMP-1的水平明显降低而 MMP却明显升高,导致关节软骨严重破坏。
细胞因子通过组织纤溶酶原途径调节MMP的活性。文献报道,TNF-α能够上调IL-6[15-16],而IL-6则下调 MMP-13。IL-1促进 MMP的合成而抑制 TIMP-1产生过程[17-18],介导了MMP与TIMP-1系统的失衡,对关节软骨的分解起到推动作用。这与本结果一致,在JIA患者血清中检测到TNF-α、IL-1与IL-6的高表达,同时检测到TIMP-1的浓度降低。通过相关性分析,也发现IL-1与 MMP-1呈正相关,而与TIMP-1呈负相关。
综上所述,本结果提示,在对JIA的治疗中,应加强对细胞因子的调控。采用药物降低IL-1的水平,从而抑制 MMP的表达;可采用抗体类药物中和IL-1,同时提高TIMP-1的表达,抑制MMP,保护关节软骨;或者采用IL-1的竞争性抑制剂,使IL-1的作用降低甚至完全被拮抗。目前已有研究表明IL-1抑制剂canakinumab和IL-6抑制剂tocilizumab用于治疗全身型JIA,但仍需要纳入更多全身性JIA患者接受IL-1或IL-6抑制剂药物治疗的试验[19]。以前,虽然甲氨蝶呤和TNF-α抑制剂可以用于JIA治疗,但严重的青少年或儿童全身性JIA患者均无有效的治疗选择。本结果对于JIA的治疗提出新的理论依据,但同时也需要更为深入的基础和临床研究来验证这些可能性。
[1]Kunjir V,Venugopalan A.Profile of Indian patients with juvenile onset chronic inflammatory joint disease using the ILAR classification criteria for JIA:a community-based cohort study[J].J Rheumatol,2010,37(8):1756-1762.
[2]Stabile A,Avallone L,Compagnone A,et al.Focus on juvenile idiopathic arthritis according to the 2001Edmonton revised classification from the International League of Associations for Rheumatology:an Italian experience[J].Eur Rev Med Pharmacol Sci,2006,10(5):229-234.
[3]Sim KT,Venning HE,Barrett S,et al.Extended oligoarthritis and other risk factors for developing JIA-associated uveitis under ILAR classification and its implication for current screening guideline[J].Ocul Immunol Inflamm,2006,14(6):353-357.
[4]Southwood TR.Paediatric rheumatic disease:Treatment of JIA in the biologic era:what are we waiting for[J].Nat Rev Rheumatol,2014,10(3):132-134.
[5]Pastore S,Gortani G,Taddio A,et al.Procedural sedation for intra-articular corticosteroid injections in juvenile idiopathic arthritis(JIA)should be a standard of care[J].Eur J Pediatr,2014,173(6):831.
[6]Wan J,Yin Y,Sun R,et al.Protective effect of the ultrafiltration extract from Xin Mai Jia on human aortic smooth muscle cell injury induced by hydrogen peroxide[J].Exp Ther Med,2014,7(1):11-16.
[7]Koos B,Tzaribachev N,Bott S,et al.Classification of temporomandibular joint erosion,arthritis,and inflammation in patients with juvenile idiopathic arthritis[J].J Orofac Orthop,2013,74(6):506-519.
[8]Abramowicz S,Susarla HK,Kim S,et al.Physical findings associated with active temporomandibular joint inflammation in children with juvenile idiopathic arthritis[J].J Oral Maxillofac Surg,2013,71(10):1683-1687.
[9]Gaspari S,Marcovecchio ML,Breda L,et al.Growth in juvenile idiopathic arthritis:the role of inflammation[J].Clin Exp Rheumatol,2011,29(1):104-110.
[10]Sarma PK,Misra R,Aggarwal.Elevated serum receptor activator of NF kappaB ligand (RANKL),osteoprotegerin(OPG),matrix metalloproteinase (MMP)3,and ProMMP1in patients with juvenile idiopathic arthritis[J].Clin Rheumatol,2008,27(3):289-294.
[11]Peake NJ,Khawaja K,Myers A,et al.Levels of matrix metalloproteinase(MMP)-1in paired sera and synovial fluids of juvenile idiopathic arthritis patients:relationship to inflammatory activity,MMP-3and tissue inhibitor of metalloproteinases-1in a longitudinal study[J].Rheumatology(Oxford),2005,44(11):1383-1389.
[12]Hasty KA,Reife RA,Kang AH,et al.The role of stromelysin in the cartilage destruction that accompanies inflammatory arthritis[J].Arthritis Rheum,1990,33(3):388-397.
[13]Wang ZZ,Wang Y,Li JM,et al.Significance of serum MMP-3,TIMP-1,and monocyte CD147in rheumatoid arthritis patients of damp-heat Bi-syndrome and of colddamp Bi-syndrome[J].Zhongguo Zhong Xi Yi Jie He Za Zhi,2013,33(6):770-773.
[14]Wang GW,Wang MQ,Wang XJ,et al.Changes in the expression of MMP-3,MMP-9,TIMP-1and aggrecan in the condylar cartilage of rats induced by experimentally created disordered occlusion[J].Arch Oral Biol,2010,55(11):887-895.
[15]Daniele G,Guardado Mendoza R,Winnier D,et al.The inflammatory status score including IL-6,TNF-alpha,osteopontin,fractalkine,MCP-1and adiponectin underlies whole-body insulin resistance and hyperglycemia in type 2 diabetes mellitus[J].Acta Diabetol,2014,51(1):123-131.
[16]Putra AB,Nishi K,Shiraishi R,et al.Jellyfish collagen stimulates production of TNF-alpha and IL-6by J774.1 cells through activation of NF-kappaB and JNK via TLR4 signaling pathway[J].Mol Immunol,2014,58(1):32-37.
[17]Nee L,O′Connell S,Nolan S,et al.Nitric oxide involvement in TNF-alpha and IL-1beta-mediated changes in human mesangial cell MMP-9and TIMP-1[J].Nephron Exp Nephrol,2008,110(2):e59-66.
[18]Nee L,Tuite N,Ryan MP,et al.TNF-alpha and IL-1beta-mediated regulation of MMP-9and TIMP-1in human glomerular mesangial cells[J].Nephron Exp Nephrol,2007,107(2):e73-86.
[19]Sandborg C,Mellins ED.A new era in the treatment of systemic juvenile idiopathic arthritis[J].N Engl J Med,2012,367(25):2439-2440.
R684.3
B
1671-8348(2015)04-0524-03
10.3969/j.issn.1671-8348.2015.04.033
刘小惠(1975-),副主任医师,硕士,主要从事风湿免疫工作。
2014-09-25
2014-10-18)
·论 著·
