全血改进线性指数聚合酶链式反应用于焦磷酸测序检测基因多态性
2015-01-20项铮刘云龙邢晓清初亚男宋沁馨周国华
项铮+刘云龙+邢晓清+初亚男+宋沁馨+周国华
摘 要 焦磷酸测序是目前基因多态性检测的主要方法之一,但是其前期的样本制备工作较为繁琐,限制了其在临床检测中的应用。为了简化焦磷酸测序的流程,本研究根据不对称PCR原理,改进了线性指数聚合酶链式反应(LATE-PCR)的引物设计方法,增加过量引物的长度和浓度,并结合全血直接扩增技术,建立了基于普通rTaq聚合酶和高pH 缓冲液(HpH Buffer)的全血改进LATE-PCR(Improved LATE-PCR, imLATE-PCR)方法。考察了方法的最优扩增体系、血液抗凝剂对其影响以及全血模板量。采用单管、一步法直接扩增出单链测序模板,成功地对24例临床血样的乙醇脱氢酶基因多态性进行了检测,检测结果可用于指导临床个体化用药。24例样本的基因型分别为ADH1B位点AA纯合6例、AG杂合14例、GG纯合4例; ADH1C位点GG纯合20例、AG杂合4例、AA纯合0例。
关键词 全血直接扩增; 线性指数聚合酶链式反应; 焦磷酸测序; 基因多态性; 酒精代谢
1 引 言
随着基因组学及后基因组学的发展,人们意识到基因多态性在阐明疾病的发生和发展、毒物的易感性与耐受性、疾病临床表现的多样性以及对药物治疗的反应上都起着重要作用,而单核苷酸多态性是目前最受关注的一类多态性。
焦磷酸测序技术是通过核苷酸和单链模板结合后释放焦磷酸引发酶级联反应,促使荧光素发光并进行检测的一种核酸测序技术[1~3],用于基因多态性检测[4]、微生物分型[5]、基因甲基化检测[6]等领域,尤其是在大规模DNA测序中[7]的应用,使测序技术发生了革命性变化。但是目前焦测序的单链模板制备主要采用固相微球法[8],该方法操作步骤繁琐且效率较低; 使用生物素标记引物、链亲和素包被微球增加了检测的成本; 同时,单链制备过程中容易引起样品的交叉污染,以上不足极大地妨碍了焦测序技术的临床应用[9]。
为了解决单链模板制备问题,可以采取不对称PCR直接产生单链产物[10],但常规不对称PCR方法扩增单链的效率低,无法得到广泛使用。线性指数PCR(Linear-after-the exponential-polymerase chain Rreaction, LATE-PCR)[11]在不对称PCR的基础上,通过优化引物浓度和Tm值,可获得接近对称PCR的扩增效率,产生大量单链DNA产物,能够满足基于单链核酸序列的杂交、实时荧光PCR等反应的需要[12]。但是LATE-PCR引物设计要求严格,且随着PCR的进行,非限制性引物与扩增产物产生竞争,若扩增片段较长则得到的单链DNA产率会降低。改进的LATE-PCR方法(Improved LATE-PCR, imLATE-PCR)[13]弥补了LATE-PCR的不足,增加非限制性引物长度,减少限制性引物长度,使两者的Tm差值更大,引物的设计相较于LATE-PCR更为宽泛,产生扩增片段长度也更长,扩大了不对称PCR的实际使用范围。
为了提高基因检测速度,降低样本污染的可能性,本研究将全血直接扩增和imLATE-PCR技术相结合,建立了基于普通rTaq聚合酶和“高pH缓冲液(HpH Buffer)”的全血imLATE-PCR扩增方法。本方法具有以下优点:(1)检测速度快,操作简便。采用全血直接作为扩增单链DNA测序的模板,省去了DNA提取和单链模板制备两个繁琐的步骤,极大提高了检测速度,简化了操作过程,缩短了检测时间; (2)成本低,经济环保。无需制备DNA单链可以避免使用生物素修饰引物和磁性微球,无需DNA提取可以省去大量有机试剂和实验耗材,降低了成本; (3)污染少。避免了DNA提取和模板制备过程中反复打开管盖进行加液、移液等操作,减少了平行测多份样品时交叉污染的可能性; (4)灵敏度高。实验表明, 0.1 μL全血即采用指尖取血即可得到较好的测序结果,应用于临床检测方便、快速[14]。采用本方法对酒精代谢相关基因ADH1B、ADH1C进行了基因多态性焦测序检测,用于临床快速评估人体酒精代谢能力,对于预防与饮酒行为相关的多种疾病,以及常规体检监测有重要意义。
2 实验部分
2.1 仪器与试剂
EDC-10基因扩增仪(东胜创新生物科技有限公司); 小型焦测序仪(日本Hitachi公司)。
三磷酸腺苷硫酸化酶(ATP-sulfurylase)和Klenow聚合酶为实验室自表达; rTaq DNA聚合酶、500 bp DNA Ladder marker(日本Takara公司); 聚乙烯吡咯烷酮(PVP)、QuantiLum重组荧光素酶(美国Promega公司); 腺苷三磷酸双磷酶-Ⅶ(Apyrase-Ⅶ)、腺苷-5′-磷酸硫酸(Adenosine 5′-phosphosulfate, APS)、牛血清蛋白(Bovine serum albumin, BSA)(美国Sigma公司); Sepharose Beads(美国GE Healthcare公司); α-硫化三磷酸腺苷 (dATPαS)、三磷酸脱氧胞苷酸(dCTP)、三磷酸脱氧鸟苷酸(dGTP)、三磷酸脱氧胸腺苷酸(dTTP)(美国Amersham Pharmacia公司); 其它试剂均为分析纯; 实验用水均为灭菌二次蒸馏水。endprint
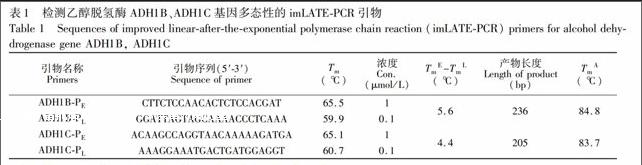
所有引物由上海Invitrogen公司合成,具体引物名称及序列见表1。
2.2 实验方法
2.2.1 imLATE-PCR引物设计 本研究选取与酒精代谢相关的乙醇脱氢酶(ADH)基因中中国人较常见位点进行扩增。扩增引物使用Primer 5.0软件进行设计,引物设计原则:TmE-TmL≥5 ℃; TmA-TmE≤13 ℃[13](TmE为过量引物Tm值,TmL为限制性引物Tm值,TmA为扩增产物Tm值)。Tm值计算采用OligoAnalyzer 3.1软件(地址:http://www.idtdna.com/analyzer/Applications/OligoAnalyzer/)。本实验中所用到的PCR扩增引物见表1。
2.2.2 全血imLATE-PCR扩增 取抗凝外周全血样本1μL(本研究中血样均来源于南京军区总院受试者,受试者已签署知情同意书并获得伦理委员会同意。除特别说明,抗凝血所用抗凝剂均为EDTA二钾。)直接用于ADH1B、ADH1C位点的目的片段扩增。PCR 反应体系包括用于全血PCR 反应的HpH Buffer(100 mmol/L Tris-HCl,50 mmol/L KCl,pH 9.3~9.5)5.35 μL,2 mmol/L Mg2+,dNTPs 100 μmol/L,过量引物(PE)1 μmol/L,限制性引物(PL)0.1 μmol/L,Taq 酶2.5 U,适当PCR添加剂(10% BSA和5% 吐温20),全血模板1 μL,加水补充至50 μL。ADH1B位点PCR反应条件:3个循环(94 ℃, 3 min; 55 ℃, 3 min); 65个循环(90 ℃, 10 s; 53 ℃, 20 s; 72 ℃, 20 s)。ADH1C位点PCR反应条件: 94 ℃预变性3 min; 65个循环(90 ℃,10 s; 55 ℃, 20 s; 72 ℃, 20 s)。
2.2.3 单链扩增产物处理以及焦磷酸测序 imLATE-PCR扩增产物除了大量单链DNA可用做测序模板,还含有过量的dNTPs、延伸产生的PPi、部分未完全延伸的产物等,这些成分都会对后续的焦测序反应造成影响。因此,扩增产物需经过处理后方可进行焦测序反应。本研究使用自制的焦测序反应液[15]对产物进行处理,主要成分为0.1 mol/L Tris-HAc(pH 7.7),2 mmol/L EDTA,10 mmol/L Mg(Ac)2, 0.1% BSA,1 mmol/L DTT,80 μmol/L APS,0.4 mmol/L D-虫萤光素,60 U/mL ATP-sulfurylase,1.6 U/mL Apyrase-Ⅶ,18 U/mL Klenow聚合酶,适量荧光素酶。反应液中的APS可以和延伸产生的PPi作用生成ATP,过量的dNTPs和少量的ATP可以在Aprase-Ⅶ作用下发生降解,从而减少对焦测序反应的影响[10]。具体步骤为:取3 μL imLATE-PCR扩增产物,加入自制焦测序反应液,置于小型焦磷酸测序仪中,室温反应5 min; 加入10 pmol测序引物,常温下退火5 min,再循环加入dATPαS, dCTP, dTTP 和dGTP 进行焦测序反应。测序引物如下: ADH1B: 5′-ATGGTGGCTGTAGGAATCTGTC-3′, ADH1C: 5′-TTTCGTTTGAAGTCATCGGTC-3′。
3 结果与讨论
3.1 PCR扩增体系对全血imLATE-PCR的影响
以全血代替DNA作为模板,其中的免疫球蛋白G、血红蛋白和乳铁蛋白等成分会抑制PCR反应,且常用血液抗凝剂EDTA或肝素也会抑制PCR反应。所以,采用全血代替DNA作为PCR反应模板时,需要调整PCR反应体系。本实验室之前报道的“HpH Buffer”体系可以很大程度上减少全血成分对PCR扩增的影响,主要由于高pH值的缓冲体系可以使蛋白质表面带负电,抑制其与带负电的基因组DNA相互作用,从而降低对PCR反应的抑制作用[16]。
3.2 全血imLATE-PCR扩增血液模板量考察
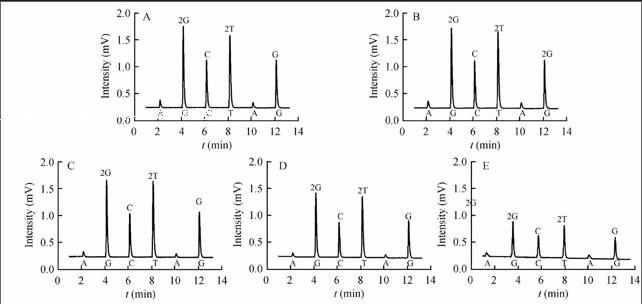
考察了上述方法在进行全血imLATE-PCR扩增时,0.05, 0.10, 0.50, 1.00和2.00 μL 5个模板加入量对扩增和测序结果的影响。结果表明,50 μL扩增体系中加入0.10~2.00 μL的EDTA抗凝全血作为模板进行扩增,扩增产物经处理后进行焦测序,均可得到良好的焦测序结果(图2),扩增产物的检测平均单碱基信号值分别为0.629、0.794、0.879、0.883,均可进行准确的SNP分型。由此证明,本方法仅需0.10 μL全血样本就可对乙醇脱氢酶的两个SNP位点进行焦测序检测并分型,大大减少了对病人的创伤。
3.3 乙醇脱氢酶ADH1B、ADH1C基因SNP位点检测
对收集到的24例临床血样的乙醇脱氢酶基因ADH1B、ADH1C的多态性检测结果(图3)显示,本方法测序结果较好,测序信号强度高,可以进行准确的SNP分型。24例样本的基因型测序结果如表2所示,其中ADH1C位点AA纯合型本实验中未检测到,而NCBI数据库也显示了亚洲人群中AA型基因频率接近于0。为了验证测序结果的准确性,从24例样本中抽取10例进行Sanger测序(图4),结果与本实验的测序结果完全一致,证明了本方法的准确性。ADH1B位点的AA型和ADH1C位点的GG型的患者酒精代谢能力较强,可加快乙醇向乙醛转化的速度,易产生面红、恶心等反应,使饮酒者对乙醇耐受性降低,一定程度上可以避免产生酗酒或酒精依赖[17]; ADH1B位点的GG纯合型和ADH1C位点的endprint
AA型患者的乙醇代谢能力较弱,易产生酒精依赖和酒精滥用,临床应建议减少酒精的摄入[18]。
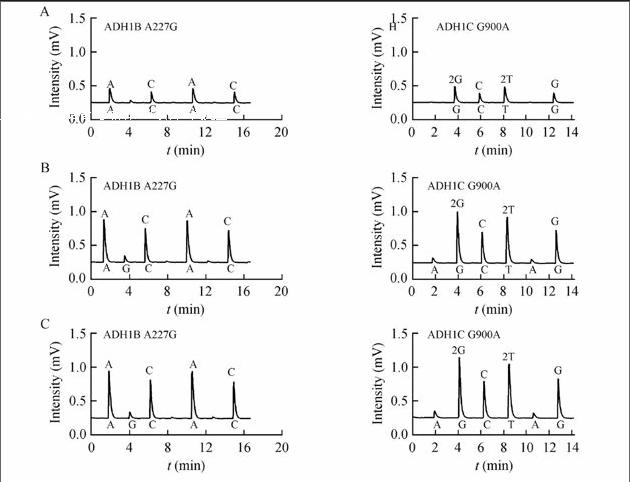
考察了临床上常用的3种血液抗凝剂EDTA二钾、柠檬酸钠和肝素钠对全血imLATE-PCR扩增的影响。结果表明,3种抗凝剂对扩增无明显影响,均能够得到准确的测序结果。
3.4 本方法与传统焦测序检测方法的比较
表3是本实验方法和传统焦磷酸测序检测方法[20,21]在耗时和成本方面的比较。本方法以全血作为模板省去了DNA提取过程,从收到样本到得到PCR扩增产物可在2 h内完成,同时降低了样品间交叉污染的可能性; 另外,高灵敏的焦磷酸测序在保证检测准确性的前提下仅使用0.10 μL全血或3.00 μL PCR产物,与传统焦磷酸测序方法相比,成本下降了约40%。
a基因组DNA提取使用QIAamp DNA 血液提取试剂盒。b传统PCR方法和全血imLATE-PCR方法均使用rTaq DNA 聚合酶。c传统基于PCR的焦测序方法单链DNA制备使用链亲和素琼脂糖球珠。d传统基于PCR的焦测序方法采用PyroMark Gold Q24 焦测序试剂。
a QIAamp DNA Blood Mini Kit (QIAGEN) was used for gDNA extraction. b rTaq DNA polymerase (TaKaRa) was used for conventional PCR and whole blood-imLATE-PCR. c Streptavidin Sepharose beads (GE Healthcare) were used for ssDNA preparation in conventional PCR-based pyrosequencing. d PyroMark Gold Q24 Reagents (QIAGEN) were used for conventional PCR-based pyrosequencing.
4 结 论
乙醇脱氢酶基因多态性导致乙醇在不同个体中的代谢速率不同。研究表明,急性酒精中毒、酒精性肝病、胰腺炎、心脑血管疾病、肝癌以及结直肠癌等一些癌症都与乙醇脱氢酶基因多态性有关[17,18]。乙醇对许多肿瘤是一种促癌剂,已有报道表明乙醇代谢酶基因多态性与肿瘤发生密切相关[19]。所以检测酒精代谢相关基因的多态性,评估人体酒精代谢能力,可用于预防与饮酒相关疾病,对人类健康有着非常重要的意义。
本研究改进了LATE-PCR方法,采用“HpH Buffer”以全血为模板直接扩增,建立了全血imLATE-PCR方法,该方法具有检测速度快、灵敏度高、污染少、成本较低等优点,为临床上检测基因多态性和疾病早期预警提供了新手段。
References
1 Ronaghi M, Uhlen M, Nyren P. Science, 1998, 281(5375): 363-365
2 CHEN Zhi-Yao, ZHOU Guo-Hua. Progress in Modern Biomedicine, 2008, 8(8): 1573-1576
陈之遥, 周国华. 现代生物医学进展, 2008, 8(8): 1573-1576
3 YE Hui, LIU Yun-Long, ZOU Bing-Jie, WU Hai-Ping, ZHOU Guo-Hua. Chinese J. Anal. Chem., 2013, 41(9): 744-748
叶 卉, 刘云龙, 邹秉杰, 武海萍, 周国华. 分析化学, 2013, 41(9): 744-748
4 Chen Z Y, Fu X Y, Zhang X D, Liu X Q, Zou B J, Wu H P, Song Q X, Li J H, Kajiyama T, Kambara H, Zhou G H.Chem. Commun., 2012, 48(18): 2445-2447
5 Yang H Y, Huang H, Wu H P, Zou B J, Zhou G H, Kajiyama T, Kambara H. Anal. Methods, 2011, 3(11): 2517-2523
6 Brakensiek K, Wingen L U, Langer F, Kreipe H, Lehmann U. Clin. Chem., 2007, 53(1): 17-23
7 Schuster S C. Nat. Methods, 2008, 5(1): 16-18
8 Diggle M A, Clarke S C. Mol. Biotechnol., 2003, 24(2): 221-224
9 Royo J L, Hidalgo M, Ruiz A. Nat. Protoc., 2007, 2(7): 1734-1739
10 YANG Hui-Yong, XI Tao, LIANG Chao, CHEN Zhi-Yao, XU Ding-Bang, ZHOU Guo-Hua. Chinese J. Anal. Chem., 2009, 37(4): 489-494
杨会勇, 奚 涛, 梁 超, 陈之遥, 徐定邦, 周国华. 分析化学, 2009, 37(4): 489-494endprint
11 Salk J J, Sanchez J A, Pierce K E, Rice J E, Soares K C, Wangh L J. Anal. Biochem., 2006, 353(1): 124-132
12 Liu Y L, Wu H P, Ye H, Chen Z Y, Song Q X, Zou B J, Rui G J, Zhou G H. Anal. Methods, 2014, 6(5): 1384-1390
13 Song Q X, Yang H Y, Zou B J, Kajiyama T, Kambara H, Zhou G H. Analyst, 2013, 38(17):4991-4997
14 LIU Yun-Long, CHEN Zhi-Yao, WU Hai-Ping, ZHOU Guo-Hua. Chinese J. Anal. Chem., 2012, 40(7): 1037-1042
刘云龙, 陈之遥, 武海萍, 周国华. 分析化学, 2012, 40(7): 1037-1042
15 Wu H P, Wu W J, Chen Z Y, Wang W P, Zhou G H, Kajiyama T, Kambara H. Anal. Chem., 2011, 83(9): 3600-3605
16 Bu Y, Huang H, Zhou G H. Anal. Biochem., 2008, 375(2): 370-372
17 ZENG Fang-Fang, LIU Sheng-Yuan, WANG Bin-You. Chin. J. Dis. Control Prev., 2008, 12(2): 164-167
曾芳芳, 刘盛元, 王滨有. 疾病控制杂志, 2008, 12(2): 164-167
18 Yamauchi M, Maezawa Y, Mizuhara Y, Ohata M, Hirakawa J, Nakajima H, Toda G. Hepatology, 1995, 22(4): 1136-1142
19 ZHANG Zhu-Mei, BIAN Jian-Chao. Chin. J. Med. Genet., 2001, 18(1): 62-65
张竹梅, 边建超. 中华医学遗传学杂志, 2001, 18(1): 62-65
20 Royo J L, Hidalgo M, Ruiz A. Nat. Protoc., 2007, 2(7): 1734-1739
21 Royo J L, Galan J J. Methods Mol. Biol., 2009, 578: 123-133
Genotyping of Alcohol Dehydrogenase Gene by Pyrosequencing
Coupled with Improved Linear-after-the-Exponential
Polymerase Chain Reaction Using Human
Whole Blood as Starting Material
XIANG Zheng1, LIU Yun-Long2, XING Xiao-Qing1, CHU Ya-Nan2, SONG Qin-Xin*1,2, ZHOU Guo-Hua1,2
1(Key Laboratory of Drug Quality Control and Pharmacovigilance of Ministry of Education,
China Pharmaceutical University, Nanjing 210009, China)
2(Department of Pharmacology, Jinling Hospital, Nanjing University School of Medicine, Nanjing 210002, China)
Abstract Pyrosequencing is one of the important genetic polymorphism detection methods currently, but the complicated pretreatment procedure limits its application in clinical test. To simplify the whole process of pyrosequencing, on the basis of the linear-after-the-exponential-polymerase chain reaction (LATE-PCR), we improved the primer design method of LATE-PCR, increased the length and the concentration of the excess primer, applied direct amplification technology with whole blood, and established a whole blood-imLATE-PCR method based on common rTaq polymerase and “HpH Buffer” (High pH buffer). The amplification system was optimized, and the influences of blood anticoagulant and the amount of whole blood template were investigated. The single stranded template for the pyrosequencing was obtained by PCR amplification using a single tube in one-step process, and the alcohol dehydrogenase gene polymorphisms of 24 clinical blood samples were then detected successfully. The results could be used to guide clinical individualized medication. The genotypes of ADH1B locus of 24 samples were 6 cases of AA homozygote, 14 cases of AG heterozygote, and 4 cases of GG homozygote. The genotypes of ADH1C were 20 cases of GG homozygote, 4 cases of AG heterozygote, and no cases of AA homozygote.
Keywords Whole blood-polymerase chain reaction; Linear-after-the-exponential-polymerase chain reaction; Pyrosequencing; Gene polymorphism; Ethanolic metabolism
(Received 6 May 2014; accepted 9 September 2014)endprint
