土壤动物多样性及其生态功能
2015-01-20邵元虎张卫信刘胜杰王晓丽傅声雷
邵元虎,张卫信,刘胜杰,王晓丽,2,傅声雷,*
1 中国科学院华南植物园,退化生态系统植被恢复与管理重点实验室,广州 510650 2 中国科学院大学, 北京 100049
土壤动物多样性及其生态功能
邵元虎1,张卫信1,刘胜杰1,王晓丽1,2,傅声雷1,*
1 中国科学院华南植物园,退化生态系统植被恢复与管理重点实验室,广州 510650 2 中国科学院大学, 北京 100049
土壤无脊椎动物生物量通常小于土壤生物总生物量的10%,但它们种类丰富,取食行为及生活史策略多种多样,且土壤动物之间,土壤动物与微生物之间存在着复杂的相互作用关系。土壤动物的生态功能主要通过取食作用(trophic effect)和非取食作用 (non-trophic effect)来实现。原生动物数量大、周转快,故原生动物本身的代谢活动(即取食作用)对碳氮矿化的贡献可以接近甚至超过细菌的贡献; 然而大多数中小型土壤动物的本身代谢过程对碳氮矿化的贡献远低于土壤微生物,但它们可以通过取食作用来调节微生物进而影响碳氮的矿化。大型节肢动物中的蜘蛛和地表甲虫等捕食者经常活跃于地表,它们常常会通过级联效应对土壤生态系统产生重要的影响。蚯蚓、白蚁等大型土壤动物除可以通过取食作用以外,还可以通过非取食作用调控土壤微生物,进而显著影响土壤碳氮过程。土壤动物取食行为的多样性和复杂的非营养关系的存在造就了多维度的土壤食物网,给土壤动物的生态功能研究带来了巨大的挑战。介绍了土壤动物的多样性及主要的生态功能,并对研究的热点和前沿问题进行了探讨,以期引起关于土壤动物多样性及其生态功能的深入思考。
土壤动物;生物多样性;生态系统功能;取食作用;非取食作用
土壤是地球上生物多样性最丰富的生境[1-2],土壤中高度异质的空间结构、化学组成复杂多样的底物为不同大小、物理活动、行为和特征的生物群体提供了各种各样的栖息场所[3]。土壤动物约占全球所有被描述过的生物多样性的23%[4],一克土壤中包括上万个原生动物,几十到上百条线虫以及数量众多的螨类和弹尾类等[5]。然而, 考虑到绝大多数土壤动物还没有被记录或描述过,这一数字可能被大大低估了。一般是根据体宽把它们分成小型(microfauna)(平均体宽小于0.1或0.2 mm,比如原生动物和线虫)、中型(mesofauna)(平均体宽在0.1或0.2—2mm之间,比如跳虫和螨类)、大型(macrofauna)(平均体宽大于2mm,比如蚯蚓和多足类土壤动物)和巨型土壤动物(megafauna)(平均体宽大于2cm,比如鼹鼠)[6]。其中,前三类主要指土壤中的无脊椎动物。
土壤生物多样性在维持陆地生态系统碳氮循环等方面具有重要作用[7]。在陆地生态系统中,土壤动物是陆地生态系统种类最为丰富的生物组份[8],而且几乎所有的地下生态学过程都与土壤动物有关。例如,土壤动物在全球尺度上对凋落物的分解有一致的正效应[9]。本文在概述土壤无脊椎动物多样性及特征的基础上,介绍主要类群及代表性土壤动物的生态功能,并讨论土壤动物生态功能研究的难点和热点等问题,以期引起关于土壤动物多样性及其生态功能的深入思考。
1 土壤动物多样性
土壤中的原生动物是非常原始的单细胞动物,个体微小、数量庞大,种类也十分丰富[10-13]。过去10a的证据表明,依靠传统形态学的鉴定大大低估了土壤原生动物的多样性[14]。按照生态类群主要划分为四个类群:主要是鞭毛虫、裸变形虫、有壳类变形虫和纤毛虫[15-16]。土壤原生动物主要以细菌为食,当可使用细菌资源耗尽时,一些原生动物会取食真菌、藻类和其它动物。鞭毛虫是数量最多也是最活跃的原生动物,主要以细菌为食,在荒漠土中的数量大约为每克土100条,森林土中可达每克土100000条。它们的取食活动对土壤养分的周转起到了非常重要的作用。农田、草地和森林中的裸变形虫都非常活跃并且数量众多,特别是在耕作土中它们往往占优势。它们吞噬纤毛虫、细菌、真菌和藻类等。可以进入土壤团聚体内部很小的空隙里面取食细菌。与裸变形虫相比,有壳类变形虫数量相对较少,喜欢在栖息在潮湿的森林土壤中。相对于上述几类原生动物,纤毛虫的数量更少,每克凋落物或土壤中的数量只有10—500条。
线虫是地球上数量最多和功能类群最丰富的多细胞动物,据估计占多细胞动物总数的80%左右[17]。线虫可以生活在包括海水、淡水和陆地等各种各样的生态系统中。土壤中的自由生活的线虫体长大约在150 μm (microns) 到 10 mm之间,植物寄生性线虫体长大约在0.25 mm 到12 mm之间[18-20]。线虫种类繁多,种群密度庞大,但97%以上的线虫种类是未知的;可能的原因一方面是线虫个体很小以致形态分类较难,另外一方面是从事线虫分类研究方面的专家很少,并且他们在世界各地分布又极其不均匀[21]。线虫普遍存在于在各种类型的土壤中,在4200m或者更高的高山土中也普遍存在。一些农业生态系统的土壤中,至少5米多深的地方可以发现植物寄生性线虫。有些线虫在世界各地都有分布,还有一些线虫的分布受到地理或者环境条件的限制,还有许多种受人类活动的影响,一些寄生种寄主范围广,一些寄主范围窄。线虫一般喜欢潮湿的生境,土壤中的线虫生活在土壤孔隙的水膜中。在同样的寄主或同样的生境发现不同种的线虫是很普遍的[20,22]。
螨类是物种数和生态多样性最高的节肢动物类群[23-24]。主要分为五个大类,中气门、前气门、无气门亚目、隐气门亚目(甲螨)和寄生性的后气门亚目,因为寄生性的后气门亚目主要寄生在脊椎动物身上,因此土壤和凋落物中的螨类主要是前面的四个大类。螨类是土壤节肢动物中数量最多的一类,它们耐干旱和极端温度的特性使它们适应各种类型的土壤,包括南极寒冷沙漠到热带沙漠。它们多数体宽在0.1—0.2mm到1.5—2mm,栖息于凋落叶和表层土壤孔隙中,属表栖类动物。生态策略上分为三大类,大型的植食者,主要是甲螨和中气门亚目Uropodida,主要以凋落叶为食;小型的菌食/植食者,主要取食细菌、真菌和藻类;捕食者,大多数的中气门和前气门亚目是捕食者,主要捕食小的无脊椎动物。但也有些螨虫是杂食的,比如一些无气门螨可以吃凋落叶和微生物,一些前气门螨类既可以取食植物的根系或者寄生在高等植物的叶片上,又可以取食微生物和捕食其它小的无脊椎动物[11]。
甲螨是土壤螨类中种类和数量最多的一类,它们在螨类中的相对多度为16%—90%,大多数为30%—70%。文献报道过的甲螨大约有10000种,172个科,甲螨的种群密度可以达到每平方米400000条。很多的防御机制使它们很少受到一些捕食者的攻击,比如角质化或钙化的表皮,保护性的刚毛,坚硬的突起,良好的跳跃能力,分泌一些特殊的物质等等,所以食物网中的甲螨密度似乎不太可能受到捕食者控制,这或许是甲螨的种群密度特别高的原因之一[25-26]。大多数甲螨栖息在土壤和凋落物里面,土壤甲螨全部是自由生活的[27],大多数的以真菌为食[15]或者以取食微生物和凋落物等植物材料的混合物为主[28]。如此特化的食物资源却支撑了巨大的多样性,这被称作生态学上的一个难解之谜,但这也说明了关于甲螨在食物资源利用的生态位分化方面有巨大的研究空间[29-30]。除甲螨外,中气门螨是螨类中另外一个重要类群,相对多度最大可达20%,在树木繁茂的系统最多。前气门螨一般相对多度比较低,但也有研究发现可以达到55%,由于它们的个体相对较小,它们的密度往往是被被低估的。而无气门螨的密度很少,每平方米的密度很少超过1000只。
跳虫,也称弹尾虫,是除螨类以外的另外一大类节肢动物。它们分布很广, 除了在海中和淡水水面以下的水体中外, 几乎任何有生命存在的地方都有跳虫栖息[31-32]。研究表明跳虫的密度为每平方米100—670000个[33], 但大多数在每平方米10000—100000个, 寒冷的苔原其密度最小,温带草地的密度最高,它们的多样性也展现出与密度相似的规律[11,32]。它们个体生物量约为1—20 μg干重(约3—60 μg鲜重)[11]。跳虫的物种数已知为7600多种,但其85%还是未知的[34]。
蚯蚓是陆地生态系统最常见的大型土壤动物类群,文献记录的蚯蚓约4000种,人类仅仅对其中的大约数十种蚯蚓的生物学特性和生态学功能有过不同程度的研究。除海洋外,大多数生态系统中都有蚯蚓存在,但沙漠区和终年冰雪区比较少见[35-36],估计仍有50%是未知的[34]。根据蚯蚓的栖居特点可以将蚯蚓划分为表栖型、内栖型和深栖类三大类;而根据它的食性可以划分为腐生者、根食者和捕食者,其中的腐生者占绝大多数,由食碎屑者、食土者(食腐殖质者)和粪食者组成。关于蚯蚓种群密度的估计为一般为每平方米范围为100—500条,约30—100g鲜重[11]。
除上述介绍的土壤动物外,还有一些植食性、腐食性、捕食性、杂食性、寄生性等类群的大型节肢动物经常活跃于地表并具有较高的物种丰富度和多样性,同时它们也会对土壤生态系统产生重要的影响。本文概述其中部分捕食者多样性及特征并介绍它们的主要生态功能。一般来说,土壤生态系统中体型较大的捕食者有蜘蛛、蜈蚣、捕食性的甲虫、蚂蚁、白蚁和拟蝎。其中蜘蛛是陆地生态系统中最丰富的捕食者,同时也是多样性最高的节肢动物之一,在生态系统中发挥着重要的作用[37]。全世界的蜘蛛已知超过40000种,仍有很多有待进一步去认识,中国记载约3000种,除南极洲以外,全世界都有分布。从生物量和种群数量来说,蜘蛛是碎屑食物网中较为重要的捕食者类群[38-40],而且蜘蛛的多度和多样性具有明显的时空异质性[41]。地表甲虫(ground beetle)是另一类体型较大的(从2 mm到35 mm)类群,目前全世界发现的共有40000多种,其多度也有很大的空间异质性,北美大约有2000种,欧洲有2700种。大多数地表甲虫都是广义捕食者,取食的猎物种类较为丰富,其中包括膜翅目幼虫、蛹、蚯蚓和蜗牛等[42]。
总之,土壤动物种类繁多,数量巨大(表1)[10-13,22, 40, 42],绝大多数土壤动物个体很小,分类学家和分类手段都十分缺乏,这对研究土壤动物多样性来说是巨大的挑战。

表1 主要土壤动物类群的物种数和密度
2 土壤动物主要类群的生态功能
2.1 小型土壤动物(以原生动物和线虫为例)的生态功能
在土壤食物网中,原生动物和大部分的线虫因为个体较小,被当作小型土壤动物;它们在土壤中的活动能力有限,对土壤的物理结构的改变影响较小。原生动物因为数量众多,周转快速以及作为主要的细菌消费者的角色而占据了食物网中一些重要的节点;一般认为它们的生态功能主要体现在可以通过取食微生物来调节微生物种群,比如,可以抑制病原微生物。此外,原生动物的碳氮比一般大于它们主要的食物—细菌的碳氮比,通过取食细菌它们可以释放多余的氮素来刺激植物生长。原生动物取食细菌还会通过其它方式影响植物生长:植物根系周围的原生动物可以选择性地取食特定的细菌类群,从而影响细菌共生的植物激素的产生,比如吲哚乙酸。原生动物还可以作为土壤食物网中一些其它动物的食物来源[43]。近些年来由于技术上的发展,比如电子显微镜、分子技术的发展使上述的分类经历了快速和根本性的变化[44-45]。尽管它们的生态重要性被广泛接受,但分类明确的土壤原生动物的生态功能仍有很多不为人知。

土壤线虫的另一个主要功能是作为指示生物来评价生态系统的土壤生物学效应、土壤健康水平、生态系统演替或受干扰的程度[57-62]。土壤线虫能够被用作指示生物主要是因为它们具有以下几个特征:(1)是所有多细胞生物中结构最简单和数量最多的,而且它们无处不在;(2)占据土壤食物网的很多关键节点;(3)身体透明,结构简单易辨,而且它们的结构和功能的关系密切,往往与土壤质量及健康指标有很高的关联度;(4)对环境因子的变化十分敏感,世代周期一般为数天或几个月,可以在短时间内对环境变化做出响应[58]。20世纪90年代线虫生态学上一个突出的贡献是Bongers成熟指数(Maturity Index)的提出。Bongers 将陆地和淡水生活的线虫按照生活史的多样性把线虫划分成r-对策者向k-对策者过渡的5个类群,即不同的c-p(colonizer-persister)类群:c-p1,世代时间短,产卵量大,在食物充足的条件下能够快速增长,代谢快,耐污染和环境压力;c-p2,世代时间短,产卵量大,较耐污染和环境压力;c-p3,世代时间较长,对环境压力较为敏感;c-p4,世代时间长,对环境压力敏感;c-p5,世代时间很长,产卵量小,对污染和环境压力特别敏感,易受扰动,杂食者和捕食者占优势。c-p 值的分类可以提供可能的土壤环境条件方面的信息,直接反映线虫群落在环境被扰动之后的演替状态,从而可以反映环境受胁迫的程度[57]。Neher等认为成熟指数的发展代表了在解释土壤线虫群落生态学和土壤功能的关系方面的一个巨大的进步[63]。线虫生态学发展史上另一个突出贡献是Ferris 等发现在胁迫条件下最丰富的类群是c-p2类群的线虫,而当扰动导致食物网富集时,c-p1类群的线虫迅速增加。为了改善线虫的指示能力,Ferris 等提出富养指数(Enrichment Index, EI),通道指数(Channel Index, CI)和结构指数(Structure Index, SI),主要是根据不同线虫功能团的相对平均生物量赋予不同的权重值,结合EI和SI分析,图示的线虫区系分析(Weighted faunal analysis)也可以清晰的表示土壤的养分、扰动以及土壤食物网的状况[60]。
2.2 中型土壤动物(以螨类和跳虫为例)的生态功能
与原生动物和线虫不同的是,螨类和跳虫一般是中型土壤动物的代表,它们主要取食真菌、细菌以及植物凋落物碎屑,少部分也可以捕食其它小型土壤动物[11]。它们常常会对凋落物的破碎产生很大影响,同时又可以通过取食调节微生物群落[28]。比如:跳虫可以通过取食植物病原菌或一些寄生性的害虫来抑制植物虫害[32]。甲螨对凋落物分解主要体现在三个方面:(1)直接取食凋落物;(2)破碎凋落物或通过物理的移动影响微生物的扩散;(3)通过取食微生物间接影响凋落物的分解[64]。这些作用有利于有机质的分解,并提高了土壤肥力。
因为螨类和跳虫种类丰富,数量众多,因此它们也包括多样的生活史策略。比如,甲螨通常表现出K-对策者的生活史特征,表现在每年繁殖1—3代,温带针叶林的甲螨大概可以存活1—2年[26],这些特征说明甲螨可能对环境变化或扰动是比较敏感的[65]。因此它们也常被用作指示生物[66]。除甲螨外,跳虫也经常被用来作为指示生物反应土壤质量、污染程度等[32]。
螨类和跳虫在土壤团聚体形成过程中的功能角色在近年来吸引了越来越多人的注意[32,67],它们通过直接或间接的方式影响土壤团聚体的形成,进而对生物地球化学过程、水分渗透,气体交换以及抵抗侵蚀损失等方面产生重要的影响。比如,甲螨可以产生大量的粪便颗粒促进团聚体的形成。但它们主要是通过取食微生物导致微生物的补偿性生长、改变微生物的群落组成、携带并传播微生物等间接的作用影响土壤团聚体的形成。因此,这种间接的调节微生物影响团聚体形成的作用可能大于直接作用[67]。
大多数中气门和前气门螨在土壤生态系统中属于捕食者,在一些食物网模型的研究中捕食性螨与甲螨对碳的矿化能力接近,但是它们在自然生态系统中氮的矿化过程中起了重要的作用,贡献了15%—30%的氮矿化[68]。除此之外,它们可以调节其它土壤动物的种群密度[26],从而间接地调节微生物群落并影响相关的生态过程。
2.3 大型土壤动物(以蚯蚓为例)的生态功能
蚯蚓是常见的大型土壤动物类群,除取食、消化、排泄和分泌等过程外,它们还可以通过掘穴等非取食活动而发挥其生态功能。蚯蚓在生态系统中的功能主要表现在三个方面:(1)对土壤有机质分解和养分循环等关键过程的影响;(2)对土壤理化性质的影响;(3)与植物、微生物及其他动物的相互作用。具体来讲,蚯蚓能够通过直接摄取土壤和凋落物,从而取食其中的微生物、线虫或者通过蚓粪间接的改变微生物或线虫群落结构[69]。
蚯蚓作为“生态系统的工程师”,其在生态系统碳循环中的贡献却一直众说纷纭。过去的研究表明蚯蚓似乎同时扮演着两个截然矛盾的角色,它们即通过翻耕土壤会使二氧化碳排放提高33%,也的确能提高土壤肥力。研究表明:蚯蚓刺激二氧化碳排放和提高土壤肥力是同一过程的两个方面,但是某一特定时间内的二氧化碳释放的增加,并不一定意味着蚯蚓将不利于生态系统碳的净固存。大部分碳在短时间内被分配到“即时可矿化碳”和“稳定碳”这两个碳库中,前者导致短期内二氧化碳释放明显增加,后者则把大量的碳混合入土壤中特别是使这些碳被土壤团聚体包裹保护起来,不再分散地暴露于空气和微生物中,明显减慢了碳及其耦合的养分的周转过程[70]。蚯蚓的存在同时加快了有机质的矿化速率和稳定化过程,而且两个过程不对称而使稳定化大于矿化,最终导致生态系统碳的净固存[70]。蚯蚓在多数情况下促进土壤养分可利用性,有利于植物生长,但最终贡献受生态系统的肥力水平、植物种类以及水热环境等许多因素的影响[35](表2)。

表2 蚯蚓对植物生长的影响
值得注意的是,大型土壤动物的肠道微生物可能是影响生态系统过程的主角,比如蚯蚓的肠道富含厌氧微生物群落及其他微生物种群[80]。蚯蚓是陆地生态系统N2O排放的生物源之一[81],而这可能与蚯蚓肠道中的脱氮菌密切相关(蚯蚓肠道为产N2O细菌提供了有利的微环境)。据报道,蚯蚓肠道中可培养的脱氮菌是相应土壤的256倍,达到73107个/g(干重)[82-85]。除此之外,蚯蚓的肠道过程还可以和掘穴等物理过程交互作用对生态系统过程产生影响。比如蚯蚓以植物残体为食,经过蚯蚓肠道作用,产生的蚓粪中含有大量的大团聚体。此外,它们还可以掘穴形成蚓道,这种“运移”过程可以使蚓粪等有机物质与无机的土壤矿物颗粒充分混合,大大的影响土壤有机质动态和土壤团聚体的形成与稳定[86]。
2.4 捕食者(以蜘蛛和甲虫为例)的生态功能
近年来,捕食者的级联效应(trophic cascade)受到越来越多生态学家的关注[87-89]。地表的体型较大的捕食者,比如蜘蛛、地表甲虫等,在土壤生态系统中主要通过下行效应而发挥作用,即捕食者通过抑制碎屑食物网中的土壤动物数量,改变土壤动物的物种组成,从而间接地影响凋落物分解和养分循环等生态系统过程[87-88,90-92]。
研究表明,蜘蛛会对凋落物的分解速率和养分循环速率产生级联效应,但这种效应会因环境条件的不同有不同的表现[87-88]。碎屑食物网中的级联效应过程会涉及到蜘蛛和其它大中型土壤动物。土壤食物网中大型土壤动物的主要功能是碎化凋落物,增加凋落物的接触面积,加速后续中小型土壤动物对凋落物的分解[93]。但是,关于蜘蛛在碎屑食物网中级联效应的研究结果却差别很大,还没有形成统一的结论。例如,在落叶林中降低蜘蛛的密度会增加弹尾目的数量,从而加速了凋落物的分解速率。同样的研究地点[90],另外一个长期的实验却发现了相反的结果,即较高的蜘蛛密度反而增加了凋落物的分解[91]。而也有研究发现蜘蛛的存在确实影响了弹尾目的种群数量,但是并没有改变凋落物的分解速率[92]。蜘蛛所引起的碎屑食物网中的级联效应在一定程度上是由环境条件所决定的,比如水分[87]和养分[94]条件。在降雨丰富的地区,减少水分供应能够加强级联效应的强度;而在降雨较少地区,改变降雨量并不会显著地影响蜘蛛级联效应的强度。在营养贫乏的地区,顶级捕食者对土壤小型动物的级联效应显著,而在营养丰富的地区则不显著。环境条件也能够通过影响土壤动物的出现种类来影响级联效应的强度[94]。例如,在主要由细菌和取食细菌的动物组成的土壤食物网中,级联反应要明显强于由真菌和取食真菌的动物组成的土壤食物网[95]。
有研究结果表明捕食性甲虫会显著降低食粪类甲虫的密度,这种影响会通过级联效应减慢了牛粪的分解速率和养分释放速率,进而导致地上植物的生产力降低[89]。另外一个研究发现捕食者不止会降低猎物的种群密度,还会影响猎物的行为,从而对食物链的其它层次产生明显的级联效应。研究结果发现:在没有捕食者出现的条件下,蚯蚓主要在土壤表层活动,虽然蚯蚓显著地改变了土壤的理化性质,但是并没有促进地上植物的生物量积累。当捕食性的甲虫出现的时候,甲虫并没有显著降低蚯蚓的密度。蚯蚓为了躲避甲虫的捕食,活动区域从土壤表层向深层移动,从而改善了深层土壤的理化性质,最终增加了地上植物的生物量[79]。
3 土壤动物生态功能总体分析
土壤动物之间,土壤动物与微生物之间存在着复杂的相互作用关系,土壤动物的生态功能主要通过取食作用和非取食作用来实现。中小型土壤动物在土壤中迁移能力有限,所以它们对土壤结构的影响较小,而主要通过取食过程影响养分循环和植物生长。地表的蜘蛛以及甲虫等捕食者则可以通过基于取食作用的级联效应来影响生态系统功能。大型土壤动物等则还可以通过非取食作用改变土壤团粒结构、透气性、pH值等影响土壤生态过程,而且大型土壤动物还可以通过其肠道过程及其活动形成的孔穴来发挥它们的生态功能。被誉为“生态系统工程师”的蚯蚓、白蚁和蚂蚁,以及其它大型土壤动物(如马陆)等一方面可以通过自身的活动改变土壤物理和化学性状进而影响土壤结构、地表径流、养分循环和植物生长,另一方面它们可以通过直接的取食和肠道过程等影响其它生物进而影响生态系统功能。此外,因为土壤动物种类繁多,取食行为及生活史策略多种多样,这些特征使它们常常被用作反映土壤养分与扰动状态的指示生物(图1)。
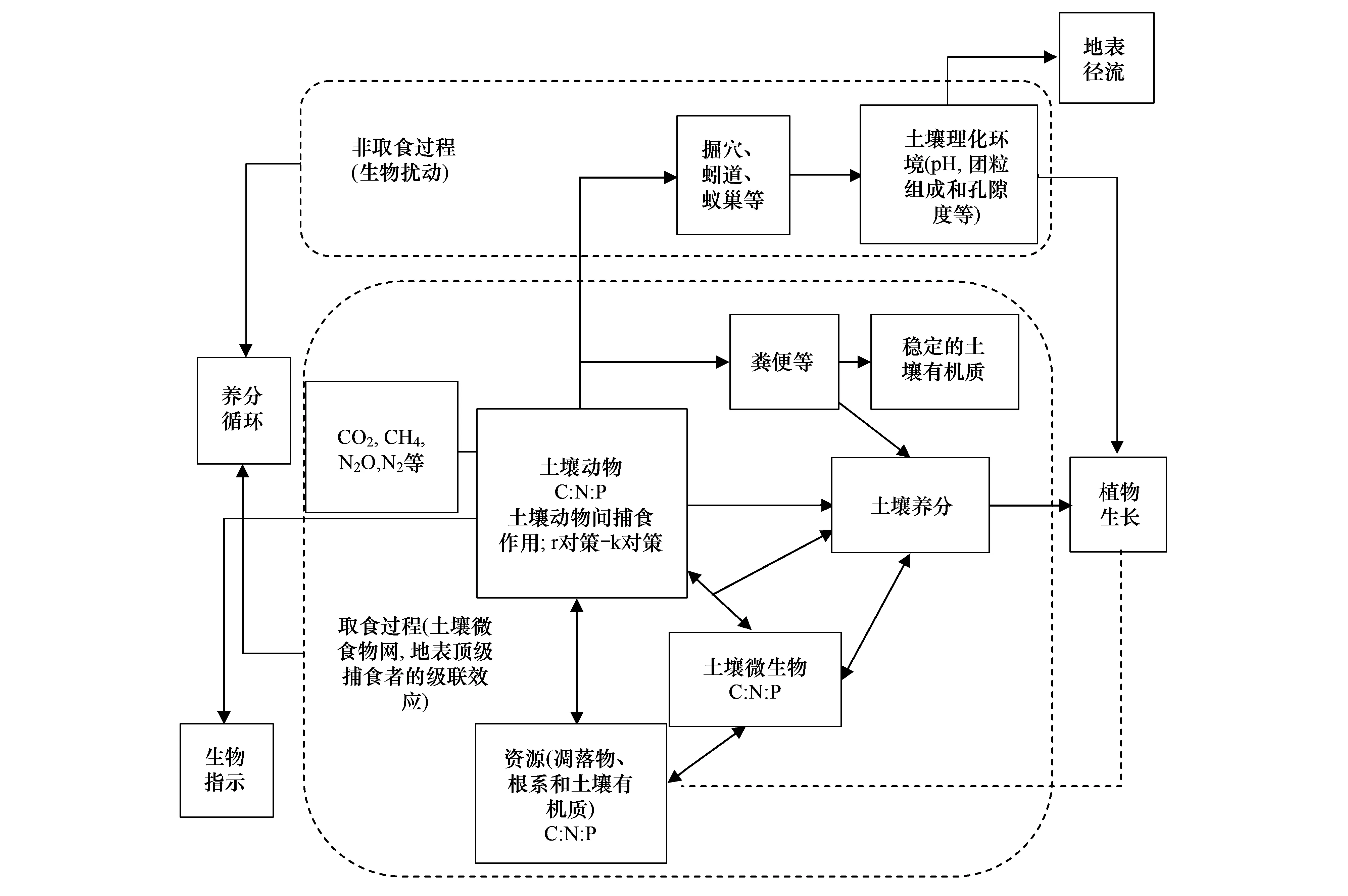
图1 土壤动物生态功能示意图Fig.1 The ecosystem functions of soil fauna
关于土壤动物的生态功能,有以下需要强调:
(1)原生动物的生活史特征与细菌类似,数量大、周转快,故原生动物本身的代谢活动对碳氮矿化的贡献可能接近甚至超过细菌的贡献[96]。
(2)土壤动物的生物量占土壤生物总生物量的比例常小于10%,故土壤动物主要通过调控微生物群落来影响碳氮矿化,它们(原生动物除外)本身的代谢过程对碳氮矿化的贡献远低于土壤微生物[96-97]。
(3)土壤动物的取食作用对碳和养分循环的贡献,可以通过其摄食速率、年死亡率、生物量以及捕食被捕食者的化学计量学特征(C∶N∶P)来计算[96,98]。土壤动物(特别是蚯蚓、白蚁等大型土壤动物)可以通过非取食作用调控土壤微生物,进而主导土壤碳氮过程。但是,土壤动物的非取食作用对碳氮循环的贡献,则很难直接估算,一般通过比较相应的土壤动物处理及对照系统的差异间接评估。这类研究又面临两个难题:首先,如何有效地控制土壤动物群落组成?目前为止,仅有少数类群如蚯蚓[99]、蚂蚁[100]或蜘蛛[90-91]可在野外较成功地控制;其次,如何区分土壤动物的取食作用和非取食作用?例如,蚯蚓对土壤微生物的直接取食作用,肠道过程对土壤微生物的影响,蚯蚓孔道和粪便等对土壤理化环境的改变等都可能影响土壤微生物群落结构和活性,进而改变土壤碳氮循环,如何量化上述过程的贡献,依然困难重重。
(4)很多研究关注的是土壤动物对有机质分解的贡献,但分解不等于真正的矿化,混淆了土壤动物尤其是破碎作用强的类群(蚯蚓、马陆和部分螨类)的生态功能[101]。
(5)土壤动物对有机质分解的影响,一般在易利用碳氮资源较贫乏的系统中更明显[79,101-102]。可能的原因是在资源贫乏的系统中,土壤微生物对碳氮资源的利用过程更加依赖于土壤动物对有机质的预处理。
(6)由于影响土壤动物的非取食作用的因素很多,大型土壤动物对生态系统过程的贡献很不确定。以蚯蚓为例,它对植物生长的影响不仅途径复杂,效应也不完全一致(表2)。其中一个重要的难点,是缺乏有效的手段将蚯蚓对养分可利用性的影响与对其他过程的影响(如植物虫害)区分开来[77]。
4 展望
土壤动物种类繁多、数量庞大,传统的形态学鉴定对很多研究者来说是一个瓶颈;而较细水平的土壤动物多样性分类,比如某一功能类群内的物种多样性可以推断可利用资源的开发程度和生态系统功能的互补性[3]。然而,受传统分类的限制,土壤生物的物种多样性和丰富度研究被认为是继深海、热带森林树冠生物多样性之后的第三个生物学研究前沿领域[103]。分子技术可能会对土壤动物多样性的研究起到巨大的推动作用。目前,很多土壤动物方面的研究已经开始了分子技术方面的尝试性研究。比如,传统的土壤线虫形态鉴定是非常耗时的,并且很多幼虫很难鉴定。Donn等设计了分子分析系统,用定向的末端限制性片段长度多态性(dT-RFLP)技术可以描述不同营养类群线虫的相对多度,这对开展大规模的采样并分析线虫群落的研究者来说是非常有吸引力的[104]。另外,稳定性同位素技术是重新构建食物网中营养关系的一个强有力的工具。例如最新应用稳定性同位素技术的研究发现捕食性线虫跟捕食性螨类有相同的营养位置,质疑了以往常见的食物网分析中把捕食性螨当作顶级捕食者的观点[105]。再者,各种“热点”和关键界面,如大型土壤动物的肠道、粪便、蚓触圈(Drilosphere)、蚁巢和根际等,是土壤动物影响生态系统过程的主要场所,值得关注。最后,全球气候变化被认为是对地球上所有生物多样性的一个主要威胁[106],温度升高、降水格局改变、N沉降和极端气候事件的增加等都会对生物多样性产生影响。因此,在全球变化背景下考虑土壤动物的某一功能类群内的物种多样性及功能群多样性对于研究受干扰土壤生态系统的恢复力和生态系统管理也非常重要。
不同土壤动物之间有着各种各样的直接或间接的关系,大多数关于土壤动物的研究只是针对某一类群展开研究,但这既低估了捕食者多样性对生态系统的作用,又忽视了捕食者之间存在着相互竞争或协作对生态系统结构和功能的调节作用[107-108],并且有证据表明,处于食物链同一营养级捕食者会对生态系统的结构和功能产生完全不同的影响[107,109]。例如:以往对捕食者的研究总是将捕食者简单的归为食物链的某一个营养级或者功能群[110],认为它们对生态系统的作用是相同的而且是可以相互取代的。因此,在食物网水平上分析土壤动物对土壤生态过程以及相关的地上植物的影响是很重要的。土壤生态学家面临的任务是结合新的方法把近20年研究的新认识整合到新的生物多样性和功能研究的生态学框架中,为认知自然和人类社会的可持续发展服务。
[1] Deca⊇ns T. Macroecological patterns in soil communities. Global Ecology and Biogeography, 2010, 19(3): 287-302.
[2] Powell J R, Craven D, Eisenhauer N. Recent trends and future strategies in soil ecological research—Integrative approaches at Pedobiologia. Pedobiologia, 2014, 57(1): 1-3.
[3] Ferris H, Tuomisto H. Unearthing the role of biological diversity in soil health. Soil Biology and Biochemistry, 2015, 85: 101-109.
[4] Deca⊇ns T, Jiménez J J, Gioia C, Measey G J, Lavelle P. The values of soil animals for conservation biology. European Journal of Soil Biology, 2006, 42(S1): S23-S38.
[5] Phillips D A, Ferris H, Cook D R, Strong D R. Molecular control points in rhizosphere food webs. Ecology, 2003, 84(4): 816-826.
[6] Wurst S, De Deyn G B, Orwin K. Soil biodiversity and functions // Wall D H, Bardgett R D, Behan-Pelletier V, Herrick J E, Jones T H, Six J, Strong D R, Van Der Putten W H, eds. Soil Ecology and Ecosystem Services. Oxford: Oxford University Press, 2013: 28-45.
[7] Bardgett R D, Wardle D A. Aboveground-belowground linkages: biotic interactions, ecosystem processes, and global change. Oxford: Oxford University Press, 2010.
[8] Giller P S. The diversity of soil communities, the ‘poor man′s tropical rainforest’. Biodiversity & Conservation, 1996, 5(2): 135-168.
[9] García‐Palacios P, Maestre F T, Kattge J, Wall D H. Climate and litter quality differently modulate the effects of soil fauna on litter decomposition across biomes. Ecology Letters, 2013, 16(8): 1045-1053.
[10] Geisen S. Soil Protists Diversity, Distribution and Ecological Functioning [D]. Köln: Universität zu Köln, 2014.
[11] Lavelle P, Spain A. Soil Ecology. Berlin: Springer Science & Business Media, 2001.
[12] Mora C, Tittensor D P, Adl S, Simpson A G B, Worm B. How many species are there on Earth and in the ocean? PLoS Biology, 2011, 9(8): e1001127.
[13] Wall D H, Adams G, Parsons A N. Soil biodiversity // Chapin F S, Sala O E, Huber-Sannwald E eds. Global Biodiversity in a Changing Environment. New York: Springer, 2001: 47-82.
[14] Adl S M, Habura A, Eglit Y. Amplification primers of SSU rDNA for soil protists. Soil Biology and Biochemistry, 2014, 69: 328-342.
[15] Coleman D C, Crossley D A Jr. Hendrix, P F. Fundamentals of soil ecology. 2nd ed. San Diego: Academic press, 2004.
[16] Lousier J D, Bamforth S S. Soil protozoa // Dindal D L, ed. Soil biology guide. New York: Wiley, 1990: 97-136.
[17] Lorenzen S. The phylogenetic systematics of free living nematodes. London: The Ray society, 1994.
[18] Agrios G N. Plant pathology. San Diego: Academic Press, 1969.
[19] Gaugler R, Bilgrami A L. Nematode behaviour. UK: CABI Publication, 2004.
[20] Maggenti A. General nematology. New York: Springer-Verlag, 1981.
[21] Abebe E, Decraemer W, De Ley P. Global diversity of nematodes (Nematoda) in freshwater. Hydrobiologia, 2008, 595(1): 67-78.
[22] Ayoub S M. Plant nematology: an agricultural training aid. Sacramento, CA: NemaAid Publication, 1980.
[23] Walter D E, Proctor H C. Mites as modern models: Acarology in the 21st century. Acarologia, 2010, 50(1): 131-141.
[24] Zhang Z.Q. Phylum Arthropoda von Siebold, 1848//Zhang Z Q ed. Animal Biodiversity: An Outline of Higher-Level Classification and Survey of Taxonomic Richness. Zootaxa, 2011: 99-103.
[25] Heethoff M, Bergmann P, Laumann M, Norton R A. The 20th anniversary of a model mite: a review of current knowledge aboutArchegozeteslongisetosus(Acari, Oribatida). Acarologia, 2013, 53(4): 353-368.
[26] Krantz G W, Walter D E. A Manual of Acarology. 3rd ed. Lubbock, Texas: Texas Tech University Press, 2009: 807-807.
[27] Johnston D E. Acari // Parker S P, ed. Synopsis and classification of living organisms. New York: McGraw-Hill, 1982: 111-111.
[28] Scheu S, Ruess L, Bonkowski M. Interactions between microorganisms and soil micro-and mesofauna // Varma A, Buscot F, eds. Microorganisms in Soils: Roles in Genesis and Functions. Berlin: Springer, 2005: 253-275.
[29] Anderson J M. The enigma of soil animal species diversity//Van⊇k J, ed. Progress in Soil Zoology. Netherlands: Springer, 1975: 51-58.
[30] Gan H J, Zak D R, Hunter M D. Chronic nitrogen deposition alters the structure and function of detrital food webs in a northern hardwood ecosystem. Ecological Applications, 2013, 23(6): 1311-1321.
[31] Christiansen K A. Springtails. Kansas: Emporia State University, 2003.
[32] 陈建秀, 麻智春, 严海娟, 张峰. 跳虫在土壤生态系统中的作用. 生物多样性, 2007, 15(2): 154-161.
[33] Petersen H, Luxton M. A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos, 1982, 39(3): 288-388.
[34] De Deyn G B, Van der Putten W H. Linking aboveground and belowground diversity. Trends in Ecology & Evolution, 2005, 20(11): 625-633.
[35] Brown G G, Edwards C A, Brussaard L. How earthworms affect plant growth: burrowing into the mechanisms // Edwards C A, ed. Earthworm Ecology. Boca Raton, FL: CRC Press, 2004, 2: 13-49.
[36] 张卫信, 陈迪马, 赵灿灿. 蚯蚓在生态系统中的作用. 生物多样性, 2007, 15(2): 142-153.
[37] Wise D H. Spiders in Ecological Webs. Cambridge, UK: Cambridge University Press, 1993.
[38] Kajak A. Effects of epigeic macroarthropods on grass litter decomposition in mown meadow. Agriculture, Ecosystems & Environment, 1997, 64(1): 53-63.
[39] Kajak A, Chmielewski K, Kaczmarek M, Rembialkowska E. Experimental studies on the effect of epigeic predators on matter decomposition processes in managed peat grasslands. Polish Ecological Studies, 1991,17: 289-310.
[40] Adis J, Harvey M S. How many Arachnida and Myriapoda are there world-wide and in Amazonia? Studies on Neotropical Fauna and Environment, 2000, 35(2): 139-141.
[41] Uetz G W. Temporal and spatial variation in species diversity of wandering spiders (Araneae) in deciduous forest litter. Environmental Entomology, 1975, 4(5): 719-724.
[42] Lövei G L, Sunderland K D. 1996. Ecology and behavior of ground beetles (Coleoptera: Carabidae). Annual Review of Entomology, 41: 231-256.
[43] Eisenbeis G. Biology of soil invertebrates// König H, Varma A, eds. Intestinal Microorganisms of Termites and Other Invertebrates. Berlin: Springer, 2006: 3-53.
[44] Adl S M, Simpson A G B, Farmer M A, Andersen R A, Anderson O R, Barta J R, Bowser S S, Brugerolle G, Fensome R A, Fredericq S, James T Y, Karpov S, Kugrens P, Krug J, Lane C E, Lewis L A, Lodge J, Lynn D H, Mann D G, Mccourt R M, Mendoza L, Moestrup O, Mozley-Standridge S E, Nerad T A, Shearer C A, Smirnov A V, Spiegel F W, Taylor M F J R. The new higher level classification of eukaryotes with emphasis on the taxonomy of protists. Journal of Eukaryotic Microbiology, 2005, 52(5): 399-451.
[45] Adl S M, Simpson A G B, Lane C E, Lukeš J, Bass D, Bowser S S, Brown M W, Burki F, Dunthorn M, Hampl V, Heiss A, Hoppenrath M, Lara E, Le Gall L, Lynn D H, McManus H, Mitchell E A D, Mozley-Stanridge S E, Parfrey L W, Pawlowski J, Rueckert S, Shadwick L, Schoch C L, Smirnov A, Spiegel F W. The revised classification of eukaryotes. Journal of Eukaryotic Microbiology, 2012, 59(5): 429-514.
[46] Anderson R V, Coleman D C, Cole C V. Effects of saprotrophic grazing on net mineralization// Clark FE, Rosswall T, eds. Terrestrial Nitrogen Cycles: Processes, Ecosystem Strategies and Management Impacts. Ecological Bulletins. Stockholm: Swedish Natural Science Research Council, 1981: 201-216.
[47] Neher D A. Role of nematodes in soil health and their use as indicators. Journal of Nematology, 2001, 33(4): 161-168.
[48] Hunt H W, Coleman D C, Ingham E R, Ingham R E, Elliott E T, Moore J C, Rose S L, Reid C P P, Morley C R. The detrital food web in a shortgrass prairie. Biology and Fertility of Soils, 1987, 3(1/2): 57-68.
[49] Chen J, Ferris H. The effects of nematode grazing on nitrogen mineralization during fungal decomposition of organic matter. Soil Biology and Biochemistry, 1999, 31(9): 1265-1279.
[50] Ferris H, Venette R C, Lau S S. Population energetics of bacterial-feeding nematodes: carbon and nitrogen budgets. Soil Biology and Biochemistry, 1997, 29(8): 1183-1194.
[51] Ingham R E, Trofymow J A, Ingham E R, Coleman D C. Interactions of bacteria, fungi, and their nematode grazers: effects on nutrient cycling and plant growth. Ecological Monographs, 1985, 55(1): 119-140.
[52] Okada H, Ferris H. Effect of temperature on growth and nitrogen mineralization of fungi and fungal-feeding nematodes. Plant and Soil, 2001, 234(2): 253-262.
[53] 吴纪华, 宋慈玉, 陈家宽. 食微线虫对植物生长及土壤养分循环的影响. 生物多样性, 2007, 15(2): 124-133.
[54] Freckman D W. Bacterivorous nematodes and organic-matter decomposition. Agriculture, Ecosystems & Environment, 1988, 24(1/3): 195-217.
[55] Fu S L, Ferris H, Brown D, Plant R. Does the positive feedback effect of nematodes on the biomass and activity of their bacteria prey vary with nematode species and population size?. Soil Biology and Biochemistry, 2005, 37(11): 1979-1987.
[56] Neher D A. Ecology of plant and free-living nematodes in natural and agricultural soil. Annual Review of Phytopathology, 2010, 48: 371-394.
[57] Bongers T. The maturity index: an ecological measure of environmental disturbance based on nematode species composition. Oecologia, 1990, 83(1): 14-19.
[58] Bongers T, Ferris H. Nematode community structure as a bioindicator in environmental monitoring. Trends in Ecology & Evolution, 1999, 14(6): 224-228.
[59] Bongers T, Van Der Meulen H, Korthals G. Inverse relationship between the nematode maturity index and plant parasite index under enriched nutrient conditions. Applied Soil Ecology, 1997, 6(2): 195-199.
[60] Ferris H, Bongers T, De Goede R G M. A framework for soil food web diagnostics: extension of the nematode faunal analysis concept. Applied Soil Ecology, 2001, 18(1): 13-29.
[61] Shao Y H, Zhang W X, Liu Z F, Sun Y X, Chen D M, Wu J P, Zhou L X, Xia H P, Neher D A, Fu S L. Responses of soil microbial and nematode communities to aluminum toxicity in vegetated oil-shale-waste lands. Ecotoxicology, 2012, 21(8): 2132-2142.
[62] Shao Y H, Zhang W X, Shen J C, Zhou L X, Xia H P, Shu W S, Ferris H, Fu S L. Nematodes as indicators of soil recovery in tailings of a lead/zinc mine. Soil Biology and Biochemistry, 2008, 40(8): 2040-2046.
[63] Neher D A, Wu J, Barbercheck M E, Anas O. Ecosystem type affects interpretation of soil nematode community measures. Applied Soil Ecology, 2005, 30(1): 47-64.
[64] Lussenhop J. Mechanisms of microarthropod-microbial interactions in soil. Advances in Ecological Research, 1992, 23: 1-33.
[65] Behan-Pelletier V M. Oribatid mite biodiversity in agroecosystems: role for bioindication. Agriculture, Ecosystems & Environment, 1999, 74(1/3): 411-423.
[66] Gergócs V, Hufnagel L. Application of oribatid mites as indicators (review). Applied Ecology and Environmental Research, 2009, 7(1): 79-98.
[67] Maaß S, Caruso T, Rillig M C. Functional role of microarthropods in soil aggregation. Pedobiologia, 2015, 58(2/3): 59-63.
[68] Berg M, De Ruiter P, Didden W, Janssen M, Schouten T, Verhoef H. Community food web, decomposition and nitrogen mineralisation in a stratified Scots pine forest soil. Oikos, 2001, 94(1): 130-142.
[69] Räty M, Huhta V. Earthworms and pH affect communities of nematodes and enchytraeids in forest soil. Biology and Fertility of Soils, 2003, 38(1): 52-58.
[70] Zhang W X, Hendrix P F, Dame L E, Burke R A, Wu J P, Neher D A, Li J X, Shao Y H, Fu S L. Earthworms facilitate carbon sequestration through unequal amplification of carbon stabilization compared with mineralization. Nature Communications, 2013, 4: 2576.
[71] Van Groenigen J W, Lubbers I M, Vos H M J, Brown G G, De Deyn G B, Van Groenigen K J. Earthworms increase plant production: a meta-analysis. Scientific Reports, 2014, 4: 6365.
[72] 刘宾, 李辉信, 朱玲, 刘满强, 胡锋. 接种蚯蚓对红壤氮素矿化特征的影响. 生态环境, 2006, 15(5): 1056-1061.
[73] 刘德辉, 胡锋, 胡佩, 成杰民. 蚯蚓活动对红壤磷素主要形态及有效磷含量的影响. 应用生态学报, 2006, 16(10): 1898-1902.
[74] Chaoui H I, Zibilske L M, Ohno T. Effects of earthworm casts and compost on soil microbial activity and plant nutrient availability. Soil Biology and Biochemistry, 2003, 35(2): 295-302.
[75] Frelich L E, Hale C M, Scheu S, Holdsworth A R, Heneghan L, Bohlen P J, Reich P B. Earthworm invasion into previously earthworm-free temperate and boreal forests. Biological Invasions, 2006, 8(6): 1235-1245.
[76] Derouard L, Tondoh J, Vilcosqui L, Lavelle P. Effects of earthworm introduction on soil processes and plant growth. Soil Biology and Biochemistry, 1997, 29(3/4): 541-545.
[77] Scheu S. Effects of earthworms on plant growth: patterns and perspectives: The 7th international symposium on earthworm ecology · Cardiff · Wales · 2002. Pedobiologia, 2003, 47(5/6): 846-856.
[78] 胡艳霞, 孙振钧, 周法永, 刘小秧, 曹坳程. 蚯蚓粪对黄瓜苗期土传病害的抑制作用. 生态学报, 2002, 22(7): 1106-1115.
[79] Zhao C, Griffin J N, Wu X W, Sun S C. Predatory beetles facilitate plant growth by driving earthworms to lower soil layers. Journal of Animal Ecology, 2013, 82(4): 749-758.
[80] Pedersen J C, Hendriksen N B. Effect of passage through the intestinal tract of detritivore earthworms (Lumbricusspp.) on the number of selected Gram-negative and total bacteria. Biology and Fertility of Soils, 1993, 16(3): 227-232.
[81] 韩兴国, 王智平. 土壤生物多样性与微量气体(CO2, CH4, N2O)代谢. 生物多样性, 2003, 11(4): 322-332.
[82] Horn M A, Drake H L, Schramm A. Nitrous oxide reductase genes (nosZ) of denitrifying microbial populations in soil and the earthworm gut are phylogenetically similar. Applied and Environmental Microbiology, 2006, 72(2): 1019-1026.
[83] Horn M A, Schramm A, Drake H L. The earthworm gut: an ideal habitat for ingested N2O-producing microorganisms. Applied and Environmental Microbiology, 2003, 69(3): 1662-1669.
[84] Ihssen J, Horn M A, Matthies C, Gößner A, Schramm A, Drake H L. N2O-producing microorganisms in the gut of the earthwormAporrectodeacaliginosaare indicative of ingested soil bacteria. Applied and Environmental Microbiology, 2003, 69(3): 1655-1661.
[85] Karsten G R, Drake H L. Comparative assessment of the aerobic and anaerobic microfloras of earthworm guts and forest soils. Applied and Environmental Microbiology, 1995, 61(3): 1039-1044.
[86] Bossuyt H, Six J, Hendrix P F. Interactive effects of functionally different earthworm species on aggregation and incorporation and decomposition of newly added residue carbon. Geoderma, 2006, 130(1/2): 14-25.
[87] Lensing J R, Wise D H. Predicted climate change alters the indirect effect of predators on an ecosystem process. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(42): 15502-15505.
[88] Liu S J, Chen J, He X X, Hu J, Yang X D. Trophic cascade of a web-building spider decreases litter decomposition in a tropical forest floor. European Journal of Soil Biology, 2014, 65: 79-86.
[89] Wu X W, Duffy J E, Reich P B, Sun S C. A brown-world cascade in the dung decomposer food web of an alpine meadow: effects of predator interactions and warming. Ecological Monographs, 2011, 81(2): 313-328.
[90] Lawrence K L, Wise D H. Spider predation on forest-floor Collembola and evidence for indirect effects on decomposition. Pedobiologia, 2000, 44(1): 33-39.
[91] Lawrence K L, Wise D H. Unexpected indirect effect of spiders on the rate of litter disappearance in a deciduous forest. Pedobiologia, 2004, 48(2): 149-157.
[92] Miyashita T, Niwa S. A test for top-down cascade in a detritus-based food web by litter-dwelling web spiders. Ecological Research, 2006, 21(4): 611-615.
[93] David J F. The role of litter-feeding macroarthropods in decomposition processes: A reappraisal of common views. Soil Biology and Biochemistry, 2014, 76: 109-118.
[94] Lenoir L, Persson T, Bengtsson J, Wallander H, Wirén A. Bottom-up or top-down control in forest soil microcosms? Effects of soil fauna on fungal biomass and C/N mineralisation. Biology and Fertility of Soils, 2007, 43(3): 281-294.
[95] Wardle D A, Yeates G W. The dual importance of competition and predation as regulatory forces in terrestrial ecosystems: evidence from decomposer food-webs. Oecologia, 1993, 93(2): 303-306.
[96] De Ruiter P C, Neutel A M, Moore J C. Biodiversity in soil ecosystems: the role of energy flow and community stability. Applied Soil Ecology, 1998, 10(3): 217-228.
[97] Fierer N, Strickland M S, Liptzin D, Bradford M A, Cleveland C C. Global patterns in belowground communities. Ecology Letters, 2009, 12(11): 1238-1249.
[98] Osler G H, Sommerkorn M. Toward a complete soil C and N cycle: incorporating the soil fauna. Ecology, 2007, 88(7): 1611-1621.
[99] Liu Z G, Zou X M. Exotic earthworms accelerate plant litter decomposition in a Puerto Rican pasture and a wet forest. Ecological Applications, 2002, 12(5): 1406-1417.
[100] Wardle D A, Hyodo F, Bardgett R D, Yeates G W, Nilsson M -C. Long-term aboveground and belowground consequences of red wood ant exclusion in boreal forest. Ecology, 2011, 92(3): 645-656.
[101] Huhta V. The role of soil fauna in ecosystems: a historical review. Pedobiologia, 2007, 50(6): 489-495.
[102] Yang X D, Chen J. Plant litter quality influences the contribution of soil fauna to litter decomposition in humid tropical forests, southwestern China. Soil Biology and Biochemistry, 2009, 41(5): 910-918.
[103] Briones M J I. Soil fauna and soil functions: a jigsaw puzzle. Frontiers in Environmental Science, 2014, 2: 1-22.
[104] Donn S, Neilson R, Griffiths B S, Daniell T J. A novel molecular approach for rapid assessment of soil nematode assemblages-variation, validation and potential applications. Methods in Ecology and Evolution, 2012, 3(1): 12-23.
[105] Kudrin A A, Tsurikov S M, Tiunov A V. Trophic position of microbivorous and predatory soil nematodes in a boreal forest as indicated by stable isotope analysis. Soil Biology and Biochemistry, 2015, 86: 193-200.
[106] Wardle D A, Verhoef H A, Clarholm M. Trophic relationships in the soil microfood-web: Predicting the responses to a changing global environment. Global Change Biology, 1998, 4(7): 713-727.
[107] Cardinale B J, Srivastava D S, Duffy J E, Wright J P, Downing A L, Sankaran M, Jouseau C. Effects of biodiversity on the functioning of trophic groups and ecosystems. Nature, 2006, 443(7114): 989-992.
[108] France K E, Duffy J E. Diversity and dispersal interactively affect predictability of ecosystem function. Nature, 2006, 441(7097): 1139-1143.
[109] Finke D L, Denno R F. Predator diversity dampens trophic cascades. Nature, 2004, 429(6990): 407-410.
[110] Fretwell S D. Food chain dynamics: the central theory of ecology?. Oikos, 1987, 50(3): 291-301.
Diversity and function of soil fauna
SHAO Yuanhu1, ZHANG Weixin1, LIU Shengjie1, WANG Xiaoli1, 2, FU Shenglei1,*
1KeyLaboratoryofVegetationRestorationandManagementofDegradedEcosystems,SouthChinaBotanicalGarden,ChineseAcademyofSciences,Guangzhou510650,China2UniversityofChineseAcademyofSciences,Beijing100049,China
Soil invertebrate biomass accounts for less than 10% of the total soil biomass, but it is characterized by abundant species, and diverse feeding behavior and life strategies, which can result in complex interactions among soil faunal groups and soil microbes. Soil fauna contribute primarily to ecosystem functioning through trophic and/or non-trophic effects. Soil protozoa, the most abundant faunal group with the highest turnover rate among soil fauna, equivalent to or even higher than that of soil bacteria, contribute to carbon and nitrogen mineralization via their own metabolic processes. In contrast, other soil faunal groups have much less impact on carbon and nitrogen mineralization, as compared to soil microbes. Most micro-and/or meso-faunal groups can regulate soil microbial processes directly by feeding on detritus and microbes, and indirectly affect soil carbon and nitrogen processes. In addition, predators such as spiders and ground beetles can affect soil ecosystems via the trophic cascade effects of predators. However, macrofauna such as earthworms and termites may regulate soil microbes, and thus alter soil carbon and nitrogen processes considerably by non-trophic effects. The diverse feeding strategies of soil fauna and the complex non-trophic relationships establish multi-dimensional soil food webs, and these pose enormous challenges to the studies of soil faunal function. Here, we outline briefly the diversity and ecosystem functioning of soil fauna, and highlight some frontiers and hot issues to inspire in-depth understanding of interactions between the diversity and function of soil fauna.
soil fauna; biodiversity; ecosystem function; trophic effect; non-trophic effect
国家自然科学基金(U1131001, 31470559, 31100385, 31210103920); 中国科学院青年创新促进会基金(2014318)
2015-06-02;
2015-07-31
10.5846/stxb201506021109
*通讯作者Corresponding author.E-mail: sfu@scbg.ac.cn
邵元虎,张卫信,刘胜杰,王晓丽,傅声雷.土壤动物多样性及其生态功能.生态学报,2015,35(20):6614-6625.
Shao Y H, Zhang W X, Liu S J, Wang X L, Fu S L.Diversity and function of soil fauna.Acta Ecologica Sinica,2015,35(20):6614-6625.
